Antibiotická rezistence u uroinfekcí – současný stav a výzvy pro praxi
Infekce močových cest patří mezi běžná bakteriální onemocnění. Častá antibiotická (ATB) terapie přináší riziko vzniku polyrezistentních patogenů. Nárůst rezistence na antibiotika je alarmující. V současné době je patrná snaha regulovat, a hlavně omezit jejich nadbytečné užívání. V rámci dlouhodobé prevence recidivujících infekcí močových cest jsou proto preferovány neantibiotické postupy.
Infekce močových cest
Infekce močových cest (IMC) je zánětlivá odpověď organismu na přítomnost patogenu v močových cestách. Nejčastěji se jedná o bakteriální zánět urotelu močového měchýře. Ve věku do šesti let bývají více postiženi chlapci, v souvislosti s přítomností vrozených vývojových vad nebo fimózy. Později dominují uroinfekce u dívek a žen, s vrcholy výskytu při hormonálních změnách (puberta, menopauza) a zahájení pohlavního života. Přibližně polovina žen prodělá během svého života zánět močového měchýře, z toho 20–30 % mívá recidivující infekci, která je definována jako zánět, jenž se vyskytne 2krát za 6 měsíců nebo 3krát v průběhu jednoho roku.1 Vždy je nutno rozlišit, zda se jedná o rekurenci různých patogenů, anebo o perzistující infekci, která nebyla dostatečně sanována, například z důvodu přítomnosti patologie urotraktu (porucha vyprazdňování močového měchýře, píštěle, přítomnost cizího tělesa, močového katétru apod.). Dále je nutno určit, zda se jedná o asymptomatickou bakteriurii, která se stanoví ze dvou po sobě jdoucích pozitivních kultivačních nálezů u bezpříznakových pacientů.2 U postmenopauzálních žen se jedná o kolonizaci močových cest a není třeba tento stav eradikovat pomocí cílené ATB terapie, pouze při nutnosti eliminovat případný infekční fokus před plánovanými výkony s implantáty.
Diagnostika IMC je založena na přítomnosti typických příznaků dolních cest močových, jako jsou dysurie, uretralgie, polakisurie a urgence, a dále na laboratorním průkazu infekce (vyšetření močového sedimentu, případně kultivace moči). U nekomplikované cystitidy v běžné praxi stačí orientační vyšetření moči papírkem, které může mít falešně negativní, ale i pozitivní výsledek. Proto u pacientů s nejasným klinickým nálezem nebo s recidivujícími obtížemi je nutno provést bakteriologické vyšetření k jednoznačnému průkazu patogenu.
Bakteriální rezistence
Historicky je nová éra terapie infekcí pomocí antibiotik spojena se Sirem Alexandrem Flemingem, který v roce 1928 objevil penicilin. Od té doby, zejména v období 2. světové války, ATB terapie zachránila miliony životů. Nicméně již v poválečném období jejich nadužívání vedlo k narůstající bakteriální rezistenci, která se stále zhoršuje i přes vyvinutí dalších ATB tříd.3 V současné době je vývoj nových přípravků pro farmaceutický průmysl nevýhodný. Ekonomické náklady mnohonásobně převyšují případný zisk, který je dán relativně nízkou cenou této léčby. Navíc po vyvinutí nového potentního léku jej není možné použít u všech pacientů, ale jen pro specifické případy. Také relativně krátká délka terapie přináší ve srovnání s chronickou medikací nižší profit, tudíž se investice do vývoje nemusejí navrátit. Z globálního hlediska je současná situace antimikrobiální rezistence považována za kritickou. Polyrezistentní kmeny jsou definovány jako rezistence na tři a více antimikrobiálních tříd při testování in vitro na citlivost k ATB. Rezistentní bakterie jsou zodpovědné za špatnou odpověď na léčbu.4
Infekce močových cest nejčastěji způsobují koliformní bakterie, které jsou normálně přítomny v tlustém střevě. V 85 % jsou IMC způsobeny bakteriemi E. coli, následovanými kmeny Klebsiella pneumoniae, Enterococcus faecalis, dále Pseudomonas aeruginosa, Proteus mirabilis a dalšími. Tyto mikroorganismy mají přirozenou vlastnost se rychle rozmnožovat a adaptovat na nové podmínky pomocí mutací genů, které vedou ke změně bakteriální stěny anebo ke schopnosti neutralizovat účinek ATB. Opakované užívání těchto látek pak může vést ke vzniku bakteriální rezistence. Přibližně 25 % všech ATB je preskribováno z důvodu léčby IMC.5 Při nedodržení doporučené délky léčby nebo při vynechání dávky se rovněž zvyšuje riziko vzniku rezistence. Ve většině případů empirické terapie dojde k usmrcení části bakterií, ale mutované rezistentní kmeny mohou perzistovat. Dalším příkladem je inadekvátní indikace k ATB terapii, například při virovém onemocnění.
K bakteriální rezistenci přispívá i užívání ATB v zemědělství, zejména v chovatelství zvířat, a používání pesticidů. Až 90 % ATB podávaných skotu se vylučuje močí a stolicí, kudy se dostává do spodních vod.6 Dochází tak ke kontaminaci životního prostředí, kdy se polyrezistentní kmeny mohou potravou dostávat do gastrointestinálního traktu a snížená diverzita střevního mikrobiomu v populaci negativně ovlivňuje prevenci infekcí a přispívá ke kolonizaci tlustého střeva patogenními bakteriemi.
Možnosti neantibiotické profylaxe
Přestože se IMC považují za běžné onemocnění s dobrou prognózou, mají výrazný dopad na kvalitu života a představují ekonomickou zátěž pro pacienta i společnost. Vzhledem k narůstající antimikrobiální rezistenci je patrná tendence omezit nebo výrazně snížit spotřebu ATB. Zejména v případě recidivujících IMC je proto vhodné znát možnosti neantibiotické terapie, která má za úkol redukovat riziko brzké recidivy zánětu. V první řadě se doporučují režimová opatření, zvýšený příjem tekutin, prodyšné spodní prádlo, správná hygiena, vyprázdnění močového měchýře po styku apod. Při recidivujících IMC bývá doporučováno profylaktické užívání ATB v subinhibiční dávce, většinou 1 tableta před spaním. Tendence k redukci této terapie vedla ke zkoumání dalších možností neantibiotické prevence. Mezi ty, které pacienti preferují nejčastěji, patří přírodní zdroje, jako jsou D‑manóza, brusinky, ibišek, xyloglukan a propolis. Dále je v praxi možné použít imunostimulaci, probiotika, laktobacily, topické estrogeny a intravezikální aplikaci kyseliny hyaluronové.
Přírodní zdroje v prevenci IMC
Zprávy o používání přírodních zdrojů v léčbě infekcí jsou stejně staré jako lidstvo. Před objevením ATB bylo běžné používat léčivé substance pro jejich antibakteriální a protizánětlivé účinky. Vzhledem k přirozenému mechanismu účinku a dobré snášenlivosti jsou u pacientů velmi oblíbeny a často používány.
D‑manóza
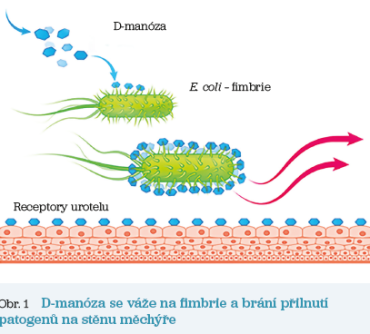 Klíčovým faktorem bakteriální virulence E. coli jsou fimbrie, které se nacházejí na povrchu těla těchto bakterií a umožňují adhezi k urotelu. Podobné struktury byly identifikovány i u jiných kmenů enterobakterií, např. u Klebsiella pneumoniae.7 D‑manóza je monosacharid, který má podobnou stavbu jako receptory buněk urotelu, proto se kompetitivním inhibičním mechanismem váže na fimbrie a brání přilnutí patogenů na stěnu měchýře (obr. 1). Dále se předpokládá, že D‑manóza má komplexní vliv na infekce, nicméně tato oblast vyžaduje další výzkum.
Klíčovým faktorem bakteriální virulence E. coli jsou fimbrie, které se nacházejí na povrchu těla těchto bakterií a umožňují adhezi k urotelu. Podobné struktury byly identifikovány i u jiných kmenů enterobakterií, např. u Klebsiella pneumoniae.7 D‑manóza je monosacharid, který má podobnou stavbu jako receptory buněk urotelu, proto se kompetitivním inhibičním mechanismem váže na fimbrie a brání přilnutí patogenů na stěnu měchýře (obr. 1). Dále se předpokládá, že D‑manóza má komplexní vliv na infekce, nicméně tato oblast vyžaduje další výzkum.
D‑manóza se fyziologicky vyskytuje v nízké koncentraci v lidském těle, kde se syntetizuje z glukózy, anebo se získává alimentací. Přirozeně se v přírodě vyskytuje v ovoci a zelenině (pomeranče, jablka, broskve), kde jsou její koncentrace nízké, tudíž nestačí jako vhodný zdroj k udržení dostatečné hodnoty. Proto se doporučuje její substituce jako doplněk stravy. Nejčastěji se užívá ve formě prášku, který se rozpustí ve vodě, anebo v kapslích užívaných orálně. D‑manóza se špatně vstřebává z gastrointestinálního traktu, nicméně i nevstřebaná část působí blahodárně na střevní mikrobiom tím, že podporuje produkci mastných kyselin s krátkým řetězcem.
Přesto, že se zdá, že sacharid jako D‑manóza by mohl být potenciálním zdrojem pro růst bakterií, in vitro bylo prokázáno, že nemá vliv na metabolismus a růst patogenů. Protože nemění buněčnou strukturu bakterií, nemá vliv na mechanismus účinku ATB a při dlouhodobém užívání nebylo popsáno riziko vzniku rezistence. V rámci terapie akutní cystitidy se naopak doporučuje ji kombinovat s ATB, protože urychluje úlevu od subjektivních potíží.
U doporučené dávky 1–2 g, která se užívá jednou až třikrát denně, nebyly popsány žádné závažné vedlejší nežádoucí účinky, pouze malá část pacientů uváděla průjem. Jako horní hranice denní dávky pro dlouhodobou profylaxi se doporučuje 0,2 g/kg tělesné hmotnosti. Protože se D‑manóza vylučuje močí, je při jejím užívání nutná dostatečná hydratace.
Brusinka, propolis, ibišek a xyloglukan
Vaccinium macrocarpon neboli klikva velkoplodá je u nás známa spíše pod označením brusinka. Její extrakt obsahuje antioxidanty a další prospěšné látky. Z hlediska IMC jsou nejdůležitější proantokyanidy. Brusinky acidifikují moč a mají příznivý vliv na střevní mikrobiom.8 Na trhu se vyskytuje velké množství přípravků s různým zastoupením proantokyanidů, proto je široké rozmezí doporučené denní dávky a délky trvání terapie. Podobné účinky má kombinace propolisu, ibišku a xyloglukanu. Tyto látky kromě acidifikace moči navíc umožňují obnovení střevního mikrobiomu, protože ve střevě pomáhají vytvořit přirozený střevní hlen, který umožňuje vstřebávání živin, vody a léků, ale brání pomnožení patogenních bakterií. Tuto kombinovanou terapii je možné použít v případě akutní infekce anebo jako prevenci recidivujících IMC.9
Imunostimulace, laktobacily, topické estrogeny a probiotika
Imunostimulace znamená podávání bakteriálních lyzátů, které vedou k posílení buněčných složek přirozené imunity. Tyto látky jsou připravovány z usmrcených bakteriálních kmenů, které nejčastěji způsobují IMC.10 Při pozitivním kultivačním nálezu je možné připravit autovakcínu na mikrobiologickém pracovišti, jež se této problematice věnuje. V menopauze má nedostatek estrogenů negativní dopad na změny poševní mikroflóry, kde hrají nejdůležitější roli laktobacily, jež jsou odpovědné za nízkou hodnotu pH. Proto lokální aplikace estrogenů a doplnění laktobacilů mají protektivní účinky.11 Při substituci je nutno mít na zřeteli, že ne všechny laktobacily mají stejnou efektivitu. Nejvyšší účinnost byla popsána u kmenů L. rhamnosus GR‑1, L. reuteri B‑54, L. reuteri RC‑14, L. casei Shirota a L. crispatus CTV‑05.12 Po ATB terapii často dochází ke změnám složení střevní mikroflóry a k přemnožení škodlivých patogenů. Užívání probiotik vede k obnovení rovnováhy fyziologického střevního mikrobiomu, který má zásadní vliv na imunitní systém.13
Minimálně invazivní postupy
Neporušená glykosaminoglykanová vrstva na povrchu stěny močového měchýře představuje bariéru proti invazi bakterií. Intravezikální instilace kyseliny hyaluronové a chondroitin sulfátu, jež jsou součástí této ochrany, umožňuje na povrchu stěny měchýře vytvoření nesmáčivého filmu, který brání adherenci patogenů k buňkám urotelu. Při intravezikálním použití dochází k obnově integrity této přirozené bariéry.14 Připravený roztok se aplikuje přes zavedený jednorázový katétr přímo do močového měchýře. Jednotlivé přípravky se liší složením (poměr zastoupení látek), ale i doporučeným schématem aplikace. Většinou se instiluje 8–10 dávek v týdenním až měsíčním intervalu. Nevýhodou je invazivita aplikace.
Závěr
Narůstající antimikrobiální rezistence představuje globální zdravotní problém. Uroinfekce jsou běžná onemocnění s rizikem časté rekurence. Používání neantimikrobiálních postupů výrazně redukuje spotřebu ATB. V rámci prevence recidivujících IMC máme celé spektrum možností, které pacientům doporučit.
MUDr. Eva Burešová, Ph.D.
Urologická klinika FN Olomouc LF Univerzity Palackého
E‑mail: Eva.buresova@fnol.cz
Literatura
- Brubaker L. American Urogynecologic Society best‑practice statement: recurrent UTI in adult women. Urogynecology 2018:24: 321–325.
- Bilsen MP, Conroy SP, Schneeberger C, et al.; UTI Reference Standard Consensus Group. A reference standard for UTI research: A multidisciplinary consensus study. Lancet Inf Dis 2024:24:e513–e521.
- Karhstrom CT. The antibiotic alarm. Nature 2013:495:141.
- Magiorakos AP, Srinivasan A, Carey RB, et al. Multi‑drug resistant, extensively drug‑resistant and pandrug‑resistant bacteria: An international expert proposal for interim standard definition for aquire resitance. Clin Microbiol Infect 2012:18:268–281.
- Sihra N, Goodma A, Zakri R, et al. Nonantibiotic prevention and management of recurrent UTI. Nat Rev Urol 2018:15:750–756.
- Centers for disease control an prevention, office of infectious diseases. Antibiotic resistance threats in the United States 2013: April 2013.
- Burešová E. D‑manóza jako prevence recidivujících infekcí močových cest. Urol praxi 2023:24:14–16.
- Wang CH, Fang CC, Chen NC, et al. Cranberry containing products for prevention of UTI in susceptible populations: a systematic review. Arch Inter Med 2012:172:988–996.
- Cai T, Anceschi U, Tamanini I, et al. Xyloglucan, hibiscus and propolis in the management of noncomplicated lower UTI: a systematic review. Antibiotics 2021:11:14. doi: 10.3390/antibiotics11010014.
- Petanová J. Imunostimulační léčba v urologii. Urol praxi 2013:14:100–103.
- Pinggera GM, Feuchtner G, Frauscher F, et al. Effects of local estrogen therapy on recurrent UTI in young females under oral contraceptives. Eur Urol 2005:47:243–249.
- Beerefot MA, Geerlings SE, van Haarst EP, et al. Nonantibiotic profylaxis for recurrent UTI: a systematic review and meta analysis. J Urol 2013:190:1981–1989.
- Belkaid Y, Hand TW. Role of the microbiota in immunity and inflammation. Cell 2014;157:121–141.
- Musilová H. Kyselina hyaluronová – užití v urologické praxi. Urol praxi 2023:24:64–67.