Cerebrální autozomálně dominantní arteriopatie se subkortikálními infarkty a leukoencefalopatií (CADASIL)
CADASIL je zkratka pro cerebrální autozomálně dominantní arteriopatii se subkortikálními infarkty a leukoencefalopatií. Jedná se o hereditární onemocnění malých mozkových tepen, které postihuje dospělé ve středním věku a vede k chronicko‑progredientní vaskulární demenci. Příčinou jsou mutace v genu NOTCH3 způsobující vaskulární degeneraci, jejímž důsledkem je postižení bílé hmoty mozkové vícečetnými lakunami a/nebo rozsáhlými až splývavými podkorovými vaskulárními změnami. Hlavními klinickými projevy jsou rekurentní tranzitorní ischemické ataky, mozkové infarkty a progresivní kognitivní porucha vedoucí k demenci. Dalším, relativně časným příznakem bývá migréna s aurou. Poměrně běžné jsou i deprese a apatie. Diagnostika onemocnění CADASIL se opírá o klinický obraz, vyšetření mozku magnetickou rezonancí a genetické vyšetření. V současné době není k dispozici kauzální léčba.
Prezentujeme případ 58letého muže s onemocněním CADASIL, které bylo potvrzeno genetickým vyšetřením. Prvními symptomy byly porucha soustředění, výbavnosti a mírná porucha časoprostorové orientace. Vyšetření mozku výpočetní tomografií (CT) a především magnetickou rezonancí (MR) prokázalo postižení bílé hmoty obou hemisfér a pontu. V dalším průběhu se rozvinuly opakované ischemické ikty a kognitivní deteriorace.
Klinické aspekty onemocnění CADASIL
Asi u 40 % pacientů, obvykle ve věku 20–30 let, je prvním projevem migréna, zpravidla s aurou.1 Charakter aury je převážně typický se zrakovými, senzitivními či senzorickými symptomy. Až u 50 % pacientů jsou záchvaty migrény spojeny s prolongovanou aurou či symptomy bazilární nebo hemiplegické migrény. Hemiplegická varianta může být vysvětlena přítomností genu kódujícího hemiplegickou migrénu v blízkosti NOTCH3 na chromozomu 19.2 Nejvýznamnějšími klinickými projevy jsou recidivující tranzitorní ischemické ataky (TIA) a ischemické cévní mozkové příhody (iCMP), které jsou nejčastější manifestací onemocnění CADASIL a postihují 80–85 % pacientů, nejčastěji ve věku 40–50 let.1 Typická je absence vaskulárních rizikových faktorů, zejména pak v mladším věku. Ischemické CMP představují dominantně subkortikální infarkty, které se projevují typickými lakunárními syndromy. Recidivující subkortikální infarkty vedou k trvalé invaliditě spojené s ložiskovým neurologickým deficitem, kognitivní poruchou, narušením stability a chůze, pseudobulbárním syndromem a inkontinencí.
Dalším závažným klinickým aspektem je kognitivní porucha vedoucí k vaskulární demenci, která se vyskytuje u vysokého procenta pacientů v pátém a šestém decenniu. Kognitivní profil se vyznačuje narušením exekutivních funkcí a poruchou výbavnosti. Nemocní také často neudrží pozornost a mají problémy s pracovní pamětí. Oproti tomu sémantická a rozpoznávací paměť zůstávají zachovány, rovněž těžká afázie, agnózie či apraxie jsou ojedinělé.1 Neuropsychiatrické příznaky ve smyslu apatie a poruchy nálady se vyskytují asi u 20 % případů, obvykle se projevují jako epizody deprese. Mezi vzácné projevy onemocnění CADASIL patří epileptické záchvaty, intracerebrální krvácení, teritoriální infarkty, parkinsonismus či vestibulární syndromy.3
Diagnostika onemocnění CADASIL
 Na CADASIL pomýšlíme u pacientů s opakovanými TIA nebo iCMP v mladším a středním věku při současné absenci vaskulárních rizikových faktorů. Diagnostickou úvahu podporuje anamnéza migrény s aurou či pozitivní rodinná anamnéza (výskyt iCMP v mladém věku, demence, případně náhlá úmrtí apod.). Rozvoj a progrese kognitivní deteriorace zvyšují klinické podezření. Pescini v roce 2012 publikoval skórovací systém, který může být pomocným vodítkem k identifikaci pacientů s možným onemocněním CADASIL (tab. 1). Maximum bodů je 25, dosažení hodnoty 15 bodů a více predikuje diagnózu CADASIL.4
Na CADASIL pomýšlíme u pacientů s opakovanými TIA nebo iCMP v mladším a středním věku při současné absenci vaskulárních rizikových faktorů. Diagnostickou úvahu podporuje anamnéza migrény s aurou či pozitivní rodinná anamnéza (výskyt iCMP v mladém věku, demence, případně náhlá úmrtí apod.). Rozvoj a progrese kognitivní deteriorace zvyšují klinické podezření. Pescini v roce 2012 publikoval skórovací systém, který může být pomocným vodítkem k identifikaci pacientů s možným onemocněním CADASIL (tab. 1). Maximum bodů je 25, dosažení hodnoty 15 bodů a více predikuje diagnózu CADASIL.4
Vyšetření mozku pomocí CT není pro CADASIL patognomické. Nacházíme sice oblasti bílé hmoty se sníženou atenuací nebo s lakunární infarkty, ale jedná se o nespecifické změny. Vyšší specificitu má vyšetření mozku MR, zejména v sekvencích T2 a FLAIR. V bazálních gangliích, kapsule, thalamu, ale také v corona radiata, corpus callosum či v pontu jsou ohraničené hyperintenzní lakuny a/nebo rozsáhlé až splývavé léze bílé hmoty obou hemisfér. Pro CADASIL jsou signifikantní především změny ve vnější kapsule a přední části temporálního laloku, které nacházíme u 80–90 % pacientů.5,6 Změny bílé hmoty na MR bývají detekovatelné ještě před klinickou manifestací choroby. U 25–70 % pacientů jsou v thalamu, bazálních gangliích či mozkovém kmeni přítomna i mikrokrvácení, jež ale nemají charakteristickou distribuci.3 Pro stanovení definitivní diagnózy je stěžejní molekulárně genetické vyšetření s průkazem mutace genu NOTCH3, který je kauzálním genem pro CADASIL.
Léčba onemocnění CADASIL
Specifická terapie neexistuje. Při absenci efektivních léčebných možností jsou namístě farmakologické a režimové postupy, které mohou ovlivnit některé klinické projevy. V profylaktické léčbě migrény se může uplatnit kyselina valproová.7 Při záchvatu migrény s aurou se nedoporučují léky s vazokonstrikčním účinkem, jako jsou triptany, preferována jsou jednosložková analgetika. V rámci sekundární prevence cerebrovaskulárních příhod jsou standardem protidestičkové léky (přípravky s kyselinou acetylsalicylovou [ASA], klopidogrel). Současně je kladen důraz na léčbu vaskulárních rizikových faktorů, pokud jsou přítomny (korekce krevního tlaku, terapie diabetes mellitus i hyperlipidemie, zanechání kouření). Při hyperhomocysteinemii lze užívat kyselinu listovou. Důležitá je pravidelná pohybová aktivita, rehabilitace a kognitivní trénink. Podávání kognitiv není všeobecně doporučeno.8 Důležitou roli má terapie psychických poruch s použitím antidepresiv, případně neuroleptik.
Výskyt a prognóza
CADASIL se řadí mezi vzácná onemocnění, jejichž incidence i prevalence nejsou stále dostatečně známy. V současné době se prevalence onemocnění CADASIL odhaduje na 2–5 případů na 100 000 obyvatel.7,9 Obvykle se soudí, že reálný počet případů tohoto onemocnění je vyšší.
Klinické projevy onemocnění CADASIL bývají zpočátku variabilní, ale téměř ve všech případech se v dalších fázích nemoci rozvinou ischemické ikty, kognitivní porucha, omezení mobility a nastává „předčasné“ úmrtí. Při analýze 411 geneticky verifikovaných případů onemocnění CADASIL bylo zjištěno, že věkový medián pro první iCMP byl 52,5 roku u žen a 50,7 roku u mužů. V téže studii byl věkový medián pro neschopnost chůze 62,1 roku u žen a 58,9 roku u mužů. Současně bylo zjištěno, že muži umírají dříve než ženy (medián u mužů byl 64,6 roku, u žen 70,7 roku). Nejčastější příčinou úmrtí byla pneumonie, následovaná náhlým úmrtím a asfyxií.10
Kazuistika
Osmapadesátiletý muž, nekuřák, měl během roku 2018 řídce a přechodně se vyskytující potíže s koncentrací, výbavností a udržením pozornosti. Tyto stavy byly provázeny i poruchou nálady. Sám tyto potíže spojoval s náročnou a stresující prací ve směnném provozu. Při psychiatrickém vyšetření nebyly zjištěny psychopatologické změny či známky duševního onemocnění. Dle závěru psychiatrického vyšetření se mohlo jednat o přechodnou lehkou poruchu přizpůsobení při zvýšené zátěži. Doporučené psychologické vyšetření pacient neabsolvoval.
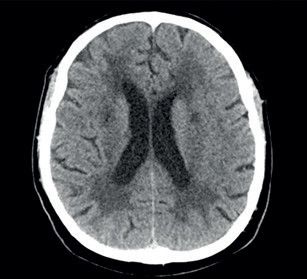
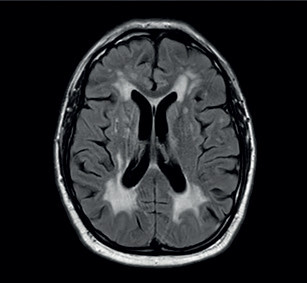 Potíže se začátkem roku 2019 opakovaly a přidala se k nim porucha časové orientace a pracovní paměti, pro což byl odeslán k akutnímu vyšetření v naší ambulanci. Pacient potíže negoval. Při neurologickém vyšetření byl klidný a orientovaný všemi modalitami. Působil zpomalenějším dojmem. Řeč byla plynulá, slovní projev měl normální. Nevykazoval známky kognitivní poruchy, neurotopický nález byl v normě. Vyšetření pomocí CT mozku prokázalo nespecifické změny bílé hmoty paraventrikulárně a subkortikálně (obr. 1). Vyšetření pomocí elektroencefalogramu (EEG) bylo normální. U pacienta byla zahájena léčba ASA v dávce 100 mg 1× denně a atorvastatinem v dávce 40 mg 1× denně. Dle MR mozku (únor 2019) byly přítomny změny bílé hmoty obou mozkových hemisfér charakteru splývající gliózy, která postihovala i pons. Dalším nálezem byly lakuny v bazálních gangliích, více vpravo (obr. 2). Dle radiologa obraz nejvíce připomínal Binswangerovu nemoc. Pacient se vyučil a v poslední době pracoval ve 12hodinovém směnném provozu jako řidič nákladního vozu na šachtě. Vojenskou prezenční službu absolvoval bez omezení. Úraz hlavy neprodělal. Nekouřil, denně vypil 1–2 piva. Dlouhodobě užíval alopurinol pro dnavou artropatii. Sledovaná interní a neurologická onemocnění negoval. V rodinné anamnéze stojí za zmínku náhle úmrtí otce v 59 letech (nalezen na chodníku), příčinu úmrtí neznal. Matka a synové jsou zdrávi. V rodině není zaznamenán výskyt neurologického nebo psychiatrického onemocnění. V březnu 2019 byl pacient přijat na naše oddělení pro smíšenou afázii, která v době přijetí trvala déle než 8 hodin. Další neurologický deficit přítomen nebyl. Vstupní CT mozku neprokázalo akutní změny v terénu splývajících hypodenzních změn v supratentoriální bílé hmotě oboustranně. CT angiografie (CTA) mozkových tepen ani neurosonologické vyšetření neprokázaly významnější patologii na extrakraniálních i intrakraniálních tepnách. Biochemické vyšetření séra potvrdilo hyperurikemii a hyperlipidemii, jiné abnormality přítomny nebyly. Glykemický profil byl normální. Vstupní hodnoty krevního tlaku byly mírně zvýšené (140–160/90–100 mm Hg), spontánně se během 24 hodin upravily do normotenzních hodnot. Vstupní EKG bylo normální a i monitorace EKG včetně Holterova monitorování EKG neodhalily srdeční arytmii. EEG bylo abnormní pro pomalou aktivitu theta a delta frontotemporálně vpravo. Sérologický test na syfilis, onkomarkery, onkoneurální protilátky a laboratorní testy na vaskulitidy byly negativní. Během 48 hodin se fatická porucha plně upravila. Pacient sděloval, že se cítí dobře a nemá žádné potíže. Na vlastní žádost (negativní revers) byl propuštěn do domácí péče. K vyšetření trombofilních stavů se nedostavil. Po opakovaném odložení ze strany pacienta bylo v dubnu 2019 doplněno vyšetření mozkomíšního moku z lumbální punkce. Zjištěna lehce zvýšená hodnota bílkoviny (0,68 g/l) a hraniční lymfocytární pleocytóza s přítomností výraznější aktivity v monocytární řadě. Cytologický nález byl v normě. Absence známek intratekální oligoklonální syntézy imunogobulinů G, A, M (IgG, IgA, IgM) a volných lehkých řetězců (FLC) kappa/lambda nesvědčily pro demyelinizační onemocnění typu sclerosis multiplex. Absence protilátek IgG proti aquaporinu 4 v krvi vylučovaly neuromyelitis optica. Koncentrace tau proteinu byla normální. Protein 14‑3‑3 byl negativní. Neuroborelióza byla vyloučena. S odstupem bylo provedeno kontrolní vyšetření mozku pomocí MR, ve srovnání s předchozím vyšetřením však neodhalilo nové změny. MR angiografie (MRA) mozkových tepen zobrazovala normální nález na intrakraniálních tepnách. Další vyšetření včetně genetického pacient neakceptoval.
Potíže se začátkem roku 2019 opakovaly a přidala se k nim porucha časové orientace a pracovní paměti, pro což byl odeslán k akutnímu vyšetření v naší ambulanci. Pacient potíže negoval. Při neurologickém vyšetření byl klidný a orientovaný všemi modalitami. Působil zpomalenějším dojmem. Řeč byla plynulá, slovní projev měl normální. Nevykazoval známky kognitivní poruchy, neurotopický nález byl v normě. Vyšetření pomocí CT mozku prokázalo nespecifické změny bílé hmoty paraventrikulárně a subkortikálně (obr. 1). Vyšetření pomocí elektroencefalogramu (EEG) bylo normální. U pacienta byla zahájena léčba ASA v dávce 100 mg 1× denně a atorvastatinem v dávce 40 mg 1× denně. Dle MR mozku (únor 2019) byly přítomny změny bílé hmoty obou mozkových hemisfér charakteru splývající gliózy, která postihovala i pons. Dalším nálezem byly lakuny v bazálních gangliích, více vpravo (obr. 2). Dle radiologa obraz nejvíce připomínal Binswangerovu nemoc. Pacient se vyučil a v poslední době pracoval ve 12hodinovém směnném provozu jako řidič nákladního vozu na šachtě. Vojenskou prezenční službu absolvoval bez omezení. Úraz hlavy neprodělal. Nekouřil, denně vypil 1–2 piva. Dlouhodobě užíval alopurinol pro dnavou artropatii. Sledovaná interní a neurologická onemocnění negoval. V rodinné anamnéze stojí za zmínku náhle úmrtí otce v 59 letech (nalezen na chodníku), příčinu úmrtí neznal. Matka a synové jsou zdrávi. V rodině není zaznamenán výskyt neurologického nebo psychiatrického onemocnění. V březnu 2019 byl pacient přijat na naše oddělení pro smíšenou afázii, která v době přijetí trvala déle než 8 hodin. Další neurologický deficit přítomen nebyl. Vstupní CT mozku neprokázalo akutní změny v terénu splývajících hypodenzních změn v supratentoriální bílé hmotě oboustranně. CT angiografie (CTA) mozkových tepen ani neurosonologické vyšetření neprokázaly významnější patologii na extrakraniálních i intrakraniálních tepnách. Biochemické vyšetření séra potvrdilo hyperurikemii a hyperlipidemii, jiné abnormality přítomny nebyly. Glykemický profil byl normální. Vstupní hodnoty krevního tlaku byly mírně zvýšené (140–160/90–100 mm Hg), spontánně se během 24 hodin upravily do normotenzních hodnot. Vstupní EKG bylo normální a i monitorace EKG včetně Holterova monitorování EKG neodhalily srdeční arytmii. EEG bylo abnormní pro pomalou aktivitu theta a delta frontotemporálně vpravo. Sérologický test na syfilis, onkomarkery, onkoneurální protilátky a laboratorní testy na vaskulitidy byly negativní. Během 48 hodin se fatická porucha plně upravila. Pacient sděloval, že se cítí dobře a nemá žádné potíže. Na vlastní žádost (negativní revers) byl propuštěn do domácí péče. K vyšetření trombofilních stavů se nedostavil. Po opakovaném odložení ze strany pacienta bylo v dubnu 2019 doplněno vyšetření mozkomíšního moku z lumbální punkce. Zjištěna lehce zvýšená hodnota bílkoviny (0,68 g/l) a hraniční lymfocytární pleocytóza s přítomností výraznější aktivity v monocytární řadě. Cytologický nález byl v normě. Absence známek intratekální oligoklonální syntézy imunogobulinů G, A, M (IgG, IgA, IgM) a volných lehkých řetězců (FLC) kappa/lambda nesvědčily pro demyelinizační onemocnění typu sclerosis multiplex. Absence protilátek IgG proti aquaporinu 4 v krvi vylučovaly neuromyelitis optica. Koncentrace tau proteinu byla normální. Protein 14‑3‑3 byl negativní. Neuroborelióza byla vyloučena. S odstupem bylo provedeno kontrolní vyšetření mozku pomocí MR, ve srovnání s předchozím vyšetřením však neodhalilo nové změny. MR angiografie (MRA) mozkových tepen zobrazovala normální nález na intrakraniálních tepnách. Další vyšetření včetně genetického pacient neakceptoval.
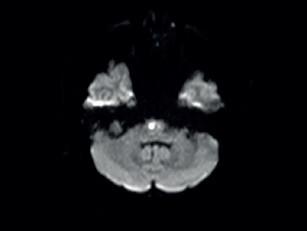
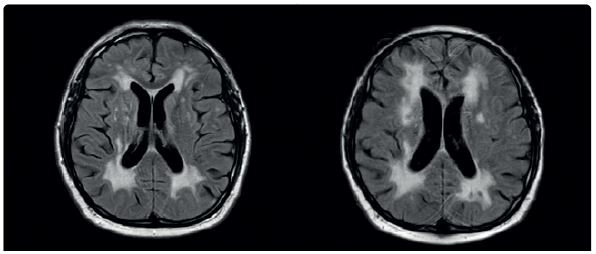 V lednu 2020 byl pacient opět hospitalizován na našem oddělení. V mezidobí mu byla přiznána invalidita I. stupně. Doporučenou ASA a atorvastatin přestal užívat. Byl skeptický a negativistický, měl potíže s krátkodobou pamětí, občas se objevil sklon k emoční labilitě a impulzivitě. Důvodem přijetí k hospitalizaci byla čtyři dny narůstající kmenová symptomatologie pod obrazem dysartrie, parézy n. III vlevo, parézy n. VII vlevo, lehké kvadruparézy a ataxie. Pacient byl orientovaný všemi modalitami, psychomotorické tempo bylo pomalejší. Řeč byla plynulá a srozumitelná. Stoj a chůze byly nestabilní, nebyl schopen samostatné chůze. Vyšetření MR mozku verifikovalo recentní ischemii v pontu velikosti 6 mm, splývající změny bílé hmoty byly v mírné progresi ve srovnání s předchozími vyšetřeními (obr. 3, obr. 4). Podle MRA a neurosonologie byl nález na extra‑ i intrakraniálních tepnách bez významnější patologie. Při biochemickém vyšetření séra byla nově zjištěna hyperhomocysteinemie. Hereditární trombofilie a Fabryho nemoc nebyly prokázány. Do medikace byla vrácena ASA, zvýšena dávka atorvastatinu (80 mg denně) a přidána kyselina listová. Kontrolní náběry na vaskulitidy byly negativní nebo v normě. Při kontrolním vyšetření likvoru byla zjištěna elevace bílkoviny (0,86 g/l), mírná lymfocytární pleocytóza, nespecifické zvýšení koncentrace cytokinů (IL‑1 a IL‑8), C‑reaktivního proteinu (CRP), C3 složky komplementu a vyšší koncentrace neurofilament i proteinu S100, ostatní nálezy byly obdobné jako v dubnu 2019. Při Mini mental testu (MMSE) dosáhl pacient 26 bodů, při Montrealském kognitivním testu (MoCA) činila dosažená hodnota 18. Narušena byla krátkodobá paměť, zrakově‑prostorové a exekutivní funkce. Neurologický deficit byl bez podstatné změny. Pro zvažovanou možnost malotepenné varianty primární angiitidy centrálního nervové systému (PACNS) byl intravenózně podán pulz methylprednisolonu v celkové dávce 3,5 g s následným tapperem per os, ale léčba nepřinesla žádoucí efekt. Pro depresivní ladění pacienta byl k léčbě přidán citalopram v dávce 20 mg denně a na noc mirtazapin v dávce 15 mg. Monitorace EKG a Holterovo monitorování EKG neprokázaly fibrilaci síní nebo jinou srdeční arytmii. Krevní tlak pacienta se pohyboval převážně v hodnotách do 120/80 mm Hg. Transtorakální a transezofageální echokardiografie, stejně jako ultrazvukové vyšetření ledvin a renálních tepen byly normální a odpovídaly věku. Pro upřesnění diagnózy, především směrem k malotepenné variantě PACNS a dědičným nemocem postihujícím bílou hmotu mozku včetně onemocnění CADASIL či CARASIL, byl pacient přeložen na neurologickou kliniku FN v Motole k doplnění digitální subtrakční angiografie (DSA) mozkových tepen, genetického vyšetření a případně i mozkové biopsie. Z provedených vyšetření: oční vyšetření nezjistilo vaskulitidu drobných cév oka, DSA neprokázala vaskulitidu mozkových tepen. Dle neuropsychologického vyšetření byl přítomen selektivní kognitivní deficit na úrovni syndromu mírné kognitivní poruchy (amnestické, vícedoménové a nehipokampální) s dominujícím zpomalením psychomotorického tempa, výrazným narušením pracovní paměti, výbavnosti a exekutivních či zrakově‑prostorových funkcí (především v oblasti konstrukce a ve zrakové diskriminaci komplexních podnětů). V prožívání dominovalo subdepresivní ladění, nestabilní emotivita a pohotovost k pláči. Při molekulárně genetickém vyšetření sekvenováním PCR produktů genu NOCTH3 byla prokázána patogenní heterozygotní mutace c.2989T>C(p.997R). Další léčba probíhala na neurologickém a rehabilitačním oddělení naší nemocnice. Poslední únorový den roku 2020 byl pacient propuštěn do domácí péče. Při propuštění byl schopen samostatné chůze s oporou francouzské hole nebo s rolátorem, modifikovaná Rankinova škála (mRS) = 3, skóre indexu Barthelové = 70, funkční míra nezávislosti (FIM) se pohybovala na hodnotě 5–7 ve většině činností (činnosti vykonával pacient buď sám, s pomůckami nebo pod dozorem druhé osoby). Plánované ambulantní kontroly byly znemožněny nástupem pandemie covidu‑19 a souvisejících epidemiologických opatření. V červnu 2021 absolvoval nemocný kontrolní vyšetření MR mozku se stacionárním nálezem rozsáhlé a splývající gliózy v obou mozkových hemisférách, mezencefalu a pontu. Stejně jako při předchozích vyšetřeních (únor 2019, leden 2020) nebyly postiženy temporální laloky, vnější kapsula byla postižena mírněji než kapsula vnitřní (obr. 5). Pacienta v říjnu 2021 a dubnu 2023 postihly další iCMP z levého karotického povodí, obě iCMP byly úspěšně léčeny intravenózní trombolýzou. V roce 2022 prodělal fokální levostranný motorický epileptický záchvat, pro který byla zahájena léčba valproátem v dávce 2× 500 mg denně. Prohlubuje se kognitivní deficit.
V lednu 2020 byl pacient opět hospitalizován na našem oddělení. V mezidobí mu byla přiznána invalidita I. stupně. Doporučenou ASA a atorvastatin přestal užívat. Byl skeptický a negativistický, měl potíže s krátkodobou pamětí, občas se objevil sklon k emoční labilitě a impulzivitě. Důvodem přijetí k hospitalizaci byla čtyři dny narůstající kmenová symptomatologie pod obrazem dysartrie, parézy n. III vlevo, parézy n. VII vlevo, lehké kvadruparézy a ataxie. Pacient byl orientovaný všemi modalitami, psychomotorické tempo bylo pomalejší. Řeč byla plynulá a srozumitelná. Stoj a chůze byly nestabilní, nebyl schopen samostatné chůze. Vyšetření MR mozku verifikovalo recentní ischemii v pontu velikosti 6 mm, splývající změny bílé hmoty byly v mírné progresi ve srovnání s předchozími vyšetřeními (obr. 3, obr. 4). Podle MRA a neurosonologie byl nález na extra‑ i intrakraniálních tepnách bez významnější patologie. Při biochemickém vyšetření séra byla nově zjištěna hyperhomocysteinemie. Hereditární trombofilie a Fabryho nemoc nebyly prokázány. Do medikace byla vrácena ASA, zvýšena dávka atorvastatinu (80 mg denně) a přidána kyselina listová. Kontrolní náběry na vaskulitidy byly negativní nebo v normě. Při kontrolním vyšetření likvoru byla zjištěna elevace bílkoviny (0,86 g/l), mírná lymfocytární pleocytóza, nespecifické zvýšení koncentrace cytokinů (IL‑1 a IL‑8), C‑reaktivního proteinu (CRP), C3 složky komplementu a vyšší koncentrace neurofilament i proteinu S100, ostatní nálezy byly obdobné jako v dubnu 2019. Při Mini mental testu (MMSE) dosáhl pacient 26 bodů, při Montrealském kognitivním testu (MoCA) činila dosažená hodnota 18. Narušena byla krátkodobá paměť, zrakově‑prostorové a exekutivní funkce. Neurologický deficit byl bez podstatné změny. Pro zvažovanou možnost malotepenné varianty primární angiitidy centrálního nervové systému (PACNS) byl intravenózně podán pulz methylprednisolonu v celkové dávce 3,5 g s následným tapperem per os, ale léčba nepřinesla žádoucí efekt. Pro depresivní ladění pacienta byl k léčbě přidán citalopram v dávce 20 mg denně a na noc mirtazapin v dávce 15 mg. Monitorace EKG a Holterovo monitorování EKG neprokázaly fibrilaci síní nebo jinou srdeční arytmii. Krevní tlak pacienta se pohyboval převážně v hodnotách do 120/80 mm Hg. Transtorakální a transezofageální echokardiografie, stejně jako ultrazvukové vyšetření ledvin a renálních tepen byly normální a odpovídaly věku. Pro upřesnění diagnózy, především směrem k malotepenné variantě PACNS a dědičným nemocem postihujícím bílou hmotu mozku včetně onemocnění CADASIL či CARASIL, byl pacient přeložen na neurologickou kliniku FN v Motole k doplnění digitální subtrakční angiografie (DSA) mozkových tepen, genetického vyšetření a případně i mozkové biopsie. Z provedených vyšetření: oční vyšetření nezjistilo vaskulitidu drobných cév oka, DSA neprokázala vaskulitidu mozkových tepen. Dle neuropsychologického vyšetření byl přítomen selektivní kognitivní deficit na úrovni syndromu mírné kognitivní poruchy (amnestické, vícedoménové a nehipokampální) s dominujícím zpomalením psychomotorického tempa, výrazným narušením pracovní paměti, výbavnosti a exekutivních či zrakově‑prostorových funkcí (především v oblasti konstrukce a ve zrakové diskriminaci komplexních podnětů). V prožívání dominovalo subdepresivní ladění, nestabilní emotivita a pohotovost k pláči. Při molekulárně genetickém vyšetření sekvenováním PCR produktů genu NOCTH3 byla prokázána patogenní heterozygotní mutace c.2989T>C(p.997R). Další léčba probíhala na neurologickém a rehabilitačním oddělení naší nemocnice. Poslední únorový den roku 2020 byl pacient propuštěn do domácí péče. Při propuštění byl schopen samostatné chůze s oporou francouzské hole nebo s rolátorem, modifikovaná Rankinova škála (mRS) = 3, skóre indexu Barthelové = 70, funkční míra nezávislosti (FIM) se pohybovala na hodnotě 5–7 ve většině činností (činnosti vykonával pacient buď sám, s pomůckami nebo pod dozorem druhé osoby). Plánované ambulantní kontroly byly znemožněny nástupem pandemie covidu‑19 a souvisejících epidemiologických opatření. V červnu 2021 absolvoval nemocný kontrolní vyšetření MR mozku se stacionárním nálezem rozsáhlé a splývající gliózy v obou mozkových hemisférách, mezencefalu a pontu. Stejně jako při předchozích vyšetřeních (únor 2019, leden 2020) nebyly postiženy temporální laloky, vnější kapsula byla postižena mírněji než kapsula vnitřní (obr. 5). Pacienta v říjnu 2021 a dubnu 2023 postihly další iCMP z levého karotického povodí, obě iCMP byly úspěšně léčeny intravenózní trombolýzou. V roce 2022 prodělal fokální levostranný motorický epileptický záchvat, pro který byla zahájena léčba valproátem v dávce 2× 500 mg denně. Prohlubuje se kognitivní deficit.
Diskuse
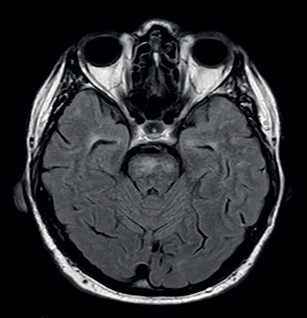 CADASIL je vzácné hereditární cévní onemocnění mozku s počátečním variabilním vývojem a rozmanitými klinickými obrazy včetně migrény, kognitivní poruchy a fokálních neurologických symptomů. Naší kazuistikou jsme chtěli upozornit nejen na stále ojediněle se vyskytující onemocnění, ale také na možné diagnostické a etiologické rozpaky, pokud se iCMP a vaskulární kognitivní porucha rozvinou v mladším a středním věku. I když je CADASIL hereditární generalizovaná arteriopatie postihující malé tepny, jsou dominantně postiženy arterioly mozku. S tím souvisí i závažnost klinických projevů, které se zpravidla objevují ve věku mezi 30.–50. rokem (bez rozdílu pohlaví). Onemocnění je klasifikováno jako neaterosklerotická a neamyloidová arteriopatie, jejímž následkem vznikají mnohočetné subkortikální infarkty a poškození bílé hmoty vedoucí ke kognitivní deterioraci a demenci. CADASIL představuje nejčastější monogenické onemocnění malých mozkových tepen. Hlavními klinickými projevy jsou migréna s aurou, rekurentní subkortikální mozkové infarkty, poruchy nálady, progresivní kognitivní porucha a demence. Četnost symptomů se liší v závislosti na věku a délce onemocnění.3,7 O možné či pravděpodobné diagnóze CADASIL lze uvažovat, když se první příznaky rozvinou ve věku před 50. rokem a vyskytují se nejméně dva z klinických projevů, kterými jsou migréna, epizody ložiskového neurologického deficitu, afektivní porucha a kognitivní deteriorace. Dále mají být přítomny tyto faktory: postižení bílé hmoty mozku detektované MR (může mít i atypickou lokalizaci, ale nemá být přítomen kortikální infarkt), pozitivní rodinná anamnéza dědičného onemocnění (nebo jsou tyto údaje neznámé či nezjistitelné) a absence vaskulárních rizikových faktorů.4,11
CADASIL je vzácné hereditární cévní onemocnění mozku s počátečním variabilním vývojem a rozmanitými klinickými obrazy včetně migrény, kognitivní poruchy a fokálních neurologických symptomů. Naší kazuistikou jsme chtěli upozornit nejen na stále ojediněle se vyskytující onemocnění, ale také na možné diagnostické a etiologické rozpaky, pokud se iCMP a vaskulární kognitivní porucha rozvinou v mladším a středním věku. I když je CADASIL hereditární generalizovaná arteriopatie postihující malé tepny, jsou dominantně postiženy arterioly mozku. S tím souvisí i závažnost klinických projevů, které se zpravidla objevují ve věku mezi 30.–50. rokem (bez rozdílu pohlaví). Onemocnění je klasifikováno jako neaterosklerotická a neamyloidová arteriopatie, jejímž následkem vznikají mnohočetné subkortikální infarkty a poškození bílé hmoty vedoucí ke kognitivní deterioraci a demenci. CADASIL představuje nejčastější monogenické onemocnění malých mozkových tepen. Hlavními klinickými projevy jsou migréna s aurou, rekurentní subkortikální mozkové infarkty, poruchy nálady, progresivní kognitivní porucha a demence. Četnost symptomů se liší v závislosti na věku a délce onemocnění.3,7 O možné či pravděpodobné diagnóze CADASIL lze uvažovat, když se první příznaky rozvinou ve věku před 50. rokem a vyskytují se nejméně dva z klinických projevů, kterými jsou migréna, epizody ložiskového neurologického deficitu, afektivní porucha a kognitivní deteriorace. Dále mají být přítomny tyto faktory: postižení bílé hmoty mozku detektované MR (může mít i atypickou lokalizaci, ale nemá být přítomen kortikální infarkt), pozitivní rodinná anamnéza dědičného onemocnění (nebo jsou tyto údaje neznámé či nezjistitelné) a absence vaskulárních rizikových faktorů.4,11
U našeho pacienta za první příznaky považujeme poruchy nálady a přechodnou poruchu orientace, výbavnosti i soustředění, které se objevily asi rok před rozvojem prvního ložiskového neurologického deficitu. Vyšetření mozku pomocí CT a MR prokázalo rozsáhlé postižení bílé hmoty obou hemisfér i pontu. Nicméně jak první klinické příznaky, tak nálezy na CT a MR mozku nebyly patognomické pro některé z cerebrovaskulárních onemocnění včetně CADASIL. Proti zvažované sporadické subkortikální leukoencefalopatii (historicky vžita jako Binswangerova nemoc) hovořil nejen věk pacienta (58 let), ale především nepřítomnost arteriální hypertenze, diabetes mellitus či kouření. Na druhou stranu ji ani definitivně nevylučovaly. V dalším průběhu se u našeho pacienta rozvinuly přechodné fokální neurologické příznaky a neuropsychiatrické projevy. Stanovení etiologie a určení diagnózy zpočátku ztěžoval i přístup pacienta s neakceptováním hospitalizace či s odkládáním ambulantních vyšetření. Což mohlo souviset i s poruchami nálady, negativistickým postojem a občasným impulzivním chováním při nastupující kognitivní poruše. V rámci úvodní diferenciální diagnostiky jsme zvažovali i jiné alternativy než cévní. Vyšetřením mozkomíšního mozku jsme neprokázali sclerosis multiplex či neuroboreliózu. V kontextu anamnézy, průběhu onemocnění a pomocných laboratorních vyšetření jsme vyloučili i neuromyelitis optica, progresivní multifokální leukoencefalopatii, jiné příčiny demence či paraneoplastický syndrom. Krevní testy na vaskulitidy byly negativní a normální titr protilátek proti fosfolipidům nesvědčil pro antifosfolipidový syndrom. Nepřítomnost dalších klinických projevů, normální hodnoty reaktantů akutní fáze (CRP, sedimentace) a normální nálezy dalších markerů autoimunitního onemocnění včetně revmatoidního faktoru, anti‑dsDNA, AMA, ANA, ANCA či ENA signalizovaly, že se nejedná o lupus či jinou systémovou vaskulitidu s postižením CNS. Postižení mozku (mozkový infarkt nebo akutní leukoencefalopatie) bývá většinou až pozdním projevem systémových vaskulitid.12 V tu dobu pacient neměl závažnější zdravotní potíže či je negoval a nebyl nakloněn dalšímu diagnostickému procesu nebo hospitalizaci. Brali jsme i v úvahu, že existují lidé s rozsáhlejšími změnami bílé hmoty, kteří nemají závažnější kognitivní úbytek nebo trpí jen mírně nespecifickými potížemi.13 Při recidivě fokální neurologické symptomatologie pod obrazem kmenových příznaků byla vyšetřením pomocí MR verifikována čerstvá ischemie v pontu v terénu rozsáhlých a splývavých změn bílé hmoty. Přítomna byla také kognitivní porucha. MR opět neprokázala postižení temporálních laloků ani výraznější postižení vnější kapsuly. Pro CADASIL bývají signifikantní právě změny ve vnější kapsule (až v 93 % případů) a v předních částech temporálních laloků (až u 86 % pacientů), a to již v počátečních stadiích.5,6 CTA či MRA mozkových tepen ani neurosonologické vyšetření neprokázaly signifikantní postižení extrakraniálních a intrakraniálních tepen. Při neurosonologickém vyšetření pacientů s onemocněním CADASIL mohou být patrné povšechně nízké toky, vyšší index rezistence a snížená vazomotorická rezerva.14 U našeho pacienta jsme tyto sonografické jevy nezaznamenali ani při opakovaném vyšetření. Diagnostický proces jsme směrovali i k dalším klinickým jednotkám. Zvažovali jsme malotepennou variantu PACNS. Tomu nahrávalo i opakované vyšetření mozkomíšního moku s nálezem proteinorachie, mírné lymfocytární pleocytózy a reaktantů akutní fáze (zvýšené hodnoty interleukinů 1 a 8 [IL‑1, IL‑8], C3 složky komplementu a CRP). Výsledek vyšetření likvoru je abnormální až u 90 % pacientů s PACNS, typická je proteinorachie a lymfocytární pleocytóza, která může být i mírná.15 Také negativní nález CTA nebo MRA mozkových tepen PACNS nevylučuje. I kognitivní deficit bývá charakteristický pro mikroangiopatickou formu PACNS a vyskytuje se asi u 67 % pacientů.12 Jako léčbu volby k možnému navození remise jsme v této fázi iniciálně zvolili methylprednisolon, ale bez klinického efektu. Neuropsychologické vyšetření specifikovalo kognitivní poruchu jako mírnou a s dominujícím narušením funkcí fronto‑subkortikálních okruhů. Pro trvající diagnostické rozpaky byly doplněny DSA mozkových tepen a genetické vyšetření (před mozkovou biopsií). DSA neprokázala změny svědčící pro vaskulitidu. Molekulárně genetické vyšetření potvrdilo mutaci v genu NOTCH3 na 19. chromozomu – patognomickou pro CADASIL. Stanovení definitivní diagnózy přineslo až genetické vyšetření, které bylo indikováno na základě anamnézy, klinického obrazu a nálezu na MR.
V případě našeho pacienta ne zcela typický obraz onemocnění vedl zpočátku k diagnostickým rozpakům, přičemž na CADASIL bylo pomýšleno v době, kdy výsledky pomocných (i opakovaných) vyšetření nebyly zcela patognomické pro léčitelné cévní onemocnění mozku a klinický stav pacienta byl dán nejen ložiskovým neurologickým deficitem, ale také progresivní kognitivní poruchou subkortikálního charakteru. Kauzální léčba onemocnění CADASIL neexistuje. Terapie zahrnuje podávání protidestičkových léků v sekundární prevenci iCMP a ovlivnění krevního tlaku s cílovou hodnotou < 130/80 mm Hg. Důležitá je léčba deprese a rehabilitace včetně kognitivního tréninku.
Závěr
I přes nízký výskyt onemocnění CADASIL má znalost jeho průběhu, klinického obrazu a pomocných vyšetření důležité místo v diferenciální diagnostice cerebrovaskulárních onemocnění. Náš případ dokumentuje nutnost zvažovat CADASIL u dospělých osob mladšího a středního věku s „kryptogenní“ etiologií iCMP a/nebo s vaskulárním kognitivním deficitem, především při průkazu rozsáhlejšího postižení bílé hmoty mozku dle MR. U těchto pacientů považujeme za účelné provést molekulárně genetické vyšetření. Potvrzení diagnózy CADASIL či jiného hereditárního onemocnění je věcí zásadního významu také pro rodinné příslušníky pacienta, zejména jedná‑li se o onemocnění s neexistující kauzální terapií.
Podpořeno grantem Krajské zdravotní, a.s., IGA‑KZ‑2022‑1‑5.
MUDr. Michaela Jüngerová, MUDr. Jiří Neumann, FESO
Neurologické oddělení, Krajská zdravotní, a.s. – Nemocnice Chomutov, o.z.
Korespondenční adresa:
jiri.neumann@kzcr.eu
Literatura
- Rusina R, Matěj R. Vaskulární demence. Neurol praxi 2009;10:250–253.
- Viitanen M, Kalimo H. CADASIL: hereditary arteriopathy leading to multiple brain infarcts and dementia. Ann N Y Acad Sci 2000;903:273–284. doi: 10.1111/j.1749‑6632.2000.tb06377.x
- Chabriat H, Joutel A, Dichgans M, et al. Cadasil. Lancet Neurol 2009;8:643–653. doi: 10.1016/S1474‑4422(09)70127‑9
- Pescini F, Nannucci S, Bertaccini B, et al. The Cerebral Autosomal‑Dominant Arteriopathy With Subcortical Infarcts and Leukoencephalopathy (CADASIL) Scale: a screening tool to select patients for NOTCH3 gene analysis. Stroke 2012;43:2871–2876. doi: 10.1161/STROKEAHA.112.665927
- Auer DP, Pütz B, Gössl C, et al. Differential lesion patterns in CADASIL and sporadic subcortical arteriosclerotic encephalopathy: MR imaging study with statistical parametric group comparison. Radiology 2001;218:443–451.
- Yousry TA, Seelos K, Mayer M, et al. Characteristic MR lesion pattern and correlation of T1 and T2 lesion volume with neurologic and neuropsychological findings in cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy (CADASIL). Am J Neuroradiol 1999;20:91–100.
- Di Donato I, Bianchi S, De Stefano N, et al. Cerebral Autosomal Dominant Arteriopathy with Subcortical Infarcts and Leukoencephalopathy (CADASIL) as a model of small vessel disease: update on clinical, diagnostic, and management aspects. BMC Med 2017;15:41. doi: 10.1186/s12916‑017‑0778‑8
- Dichgans M, Markus HS, Salloway S, et al. Donepezil in patients with subcortical vascular cognitive impairment: a randomised double‑blind trial in CADASIL. Lancet Neurol 2008;7:310–318. doi: 10.1016/S1474‑4422(08)70046‑2
- Chandoga J, Jungová P, Kolejáková K, et al. Molekulárno‑genetické a biochemické aspekty neurogenetických ochorení. Neurol praxi 2013;14:169–174.
- Opherk C, Peters N, Herzog J, et al. Long‑term prognosis and causes of death in CADASIL: a retrospective study in 411 patients. Brain 2004;127:2533–2539.
- Davous P. CADASIL: a review with proposed diagnostic criteria. Eur J Neurology 1998;5:219–233.
- Tomek A. Vaskulitidy centrálního nervového systému. Neurol praxi 2015;16:334–339.
- Bartoš A, Řípová D. Vaskulární demence a vaskulární kognitivní porucha. Neurol praxi 2012;13:72–77.
- Engelter ST, Rueegg S, Kirsch EC, et al. CADASIL Mimicking Primary Angiitis of the Central Nervous System. Arch Neurol 2002;59:1480–1483. doi:10.1001/archneur.59.9.1480
- Limaye K, Samaniego EA, Adams HP Jr. Diagnosis and Treatment of Primary Central Nervous System Angiitis. Curr Treat Options Neurol 2018;20:38. doi.org/10.1007/s11940‑018‑0522‑5