Co je nového v diagnostice a léčbě srdečního selhání na začátku roku 2021?
Souhrn
Od publikace posledních evropských i českých doporučení pro diagnostiku a léčbu srdečního selhání (SS) uplynulo již pět let. Za tu dobu se nahromadila spousta nových poznatků o epidemiologii, prognóze, diagnostice, prevenci a léčbě SS. Tento přehled přináší stručnou informaci o některých novinkách. Diskutuje např. problémy klasifikace SS podle hodnoty ejekční frakce (EF), zejména nedávno definovanou kategorii SS s EF ve středním pásmu (HFmrEF). Veškerá na důkazech založená léčba SS se týká takřka výhradně nemocných se sníženou EF (HFrEF), u nemocných se SS a zachovanou EF (HFpEF) zůstává léčba empirická a symptomatická. Do léčby HFrEF vstupuje na základě výsledků klinických studií nová skupina účinných léčiv – inhibitory SGLT2 (tzv. glifloziny), které byly dosud používány jen jako perorální antidiabetika. Na základě výsledků klinických studií se také rychle rozšiřují indikace pro duální inhibitor sacubitril/valsartan směrem k méně hemodynamicky stabilizovaným nemocným a tato látka se stále častěji nasazuje přímo, bez předchozí léčby inhibitorem ACE a/nebo sartanem. (Kap Kardiol 2021; 13: 9–15)
Klíčová slova
· srdeční selhání · inhibitory SGLT2 · sacubitril/valsartan
Prognóza kardiovaskulárních onemocnění (KVO) je do značné míry závislá na schopnosti zabránit vzniku a progresi chronického srdečního selhání (SS), nebo je alespoň oddálit. V poslední době se pozornost čím dál více zaměřuje na časnější diagnostiku a léčebné intervence. Nemocní s diabetes mellitus 2. typu (DMT2) a/nebo s chronickou ischemickou chorobou srdeční (ICHS) mají relativně dobrou prognózu, dokud u nich nezačne stoupat plazmatická koncentrace natriuretických peptidů (BNP nebo NT‑proBNP), což obvykle znamená, že došlo k renální nebo kardiální dysfunkci. Pokud by vznikla nějaká univerzální definice SS založená na natriuretických peptidech, značně by to zjednodušilo časnou diagnózu a léčbu, ale na druhé straně by to vedlo k mimořádnému nárůstu prevalence SS a současně i potřeby odpovídajících zdravotnických služeb.
V posledních několika letech přibyla spousta informací o přirozeném průběhu, epidemiologii, léčbě a měnící se prognóze srdečního selhání. Objevily se nové koncepty. Rychlost změn je taková, že v současnosti oficiálně platná doporučení (evropská i česká), která byla publikována v roce 2016,1,2 jsou již v mnoha ohledech překonaná a zastaralá a nutně vyžadují doporučení nová, resp. jejich důkladnou inovaci. Podle publikačního plánu Evropské kardiologické společnosti (ESC) se nových doporučení pro diagnostiku a léčbu srdečního selhání dočkáme v průběhu letošního roku. Pojďme si ve stručnosti shrnout, jaké nejdůležitější informace se v průběhu posledních pěti let objevily.
Epidemiologie a prevence
V kardiologii je termín „prevence“ často používán ve smyslu oddálení vzniku choroby, tedy jinými slovy prokrastinace. Chyba neuvědomit si rozdíl mezi prevencí a prokrastinací pak vede k problémům s projektováním budoucích potřeb a nákladů zdravotní péče. Starší lidé mají více komorbidit, které komplikují zdravotní péči, ale na druhé straně zase nabízejí více příležitostí pro intervence. Následně pak péče o starší nemocné se SS vyžaduje více času a více zdrojů.
Nedávná podrobná zpráva o nemocných se SS z Velké Británie ukazuje, že SS se objevuje ve věku s mediánem kolem 80 let, což je konzistentní se zlepšením léčby hypertenze a dalších ovlivnitelných rizikových faktorů aterosklerózy a je to také podmíněno lepší léčbou akutních kardiovaskulárních stavů, především akutních koronárních syndromů. Bohužel, v této zprávě nejsou k dispozici údaje o hodnotě ejekční frakce (EF) levé komory, protože v běžné klinické praxi nejsou často prováděna ani základní vyšetření (nejenom ve Velké Británii).
Blokátory mineralokortikoidních receptorů (MRA) spironolakton a eplerenon jsou účinná antihypertenziva a současně také léky, které zlepšují prognózu nemocných se srdečním selháním se sníženou ejekční frakcí (HFrEF) a možná i nemocných se srdečním selháním a zachovanou ejekční frakcí (HFpEF). V současnosti se intenzivně zkoumá, zda MRA mají také specifické účinky na další faktory vedoucí k progresi SS, jako je zánět a fibróza myokardu.
Vztahy mezi obezitou a SS jsou ne zcela jasné, resp. jsou rozporuplné. Například data z dlouhodobého sledování (22 let) obézních jedinců, kteří si po bariatrické operaci udrželi váhový úbytek o 25–35 kg, mají nižší výskyt SS (9 %) než ti, kteří takový váhový úbytek neudrželi (13 %). Když už se SS rozvine, pak se zdá, že obezita má ve vztahu ke vzniku a progresi SS dokonce účinek protektivní. Je proto naprosto nezbytné provést dostatečně velké a statisticky robustní randomizované klinické studie u obézních nemocných, aby se jednoznačně prokázalo, zda účinná redukce tělesné hmotnosti zlepší symptomy SS (což je pravděpodobné) a také klinické výsledky, tedy prognózu (což je pravděpodobné méně).
Výsledky studie ARIC (Atheroslerosis Risk in Communities) potvrdily vztah mezi chřipkovou epidemií a výskytem SS, což posiluje stávající doporučení pro vakcinaci nemocných s chronickým SS proti chřipce. V současnosti probíhá randomizovaná klinická studie, která to má potvrdit. O významu vakcinace proti COVID‑19 zatím nejsou žádné údaje, ale lze předpokládat, že vakcinace bude vysoce prospěšná.
Diagnostika
V diagnostice SS se v posledních letech příliš novinek neobjevilo. Asociace pro srdeční selhání ESC sice navrhla nový skórovací systém pro diagnostiku HFpEF. Jeho algoritmus je ale poměrně složitý a zatím čeká na potvrzení toho, že je klinicky skutečně užitečný.
Městnání tekutin je pro SS naprosto klíčové. Dilatace síní a žilního systému, k jejímuž průkazu se používají zobrazovací metody, se může nazývat „hemodynamickým městnáním“, jeho užitečným biomarkerem jsou natriuretické peptidy (NP). O něco později se zobrazovací metody začaly používat také k průkazu hromadění tekutiny v tkáních, to je tzv. tkáňové městnání, které může být spojeno se vzestupem jiného biomarkeru – adrenomedulinu. Zobrazovací metody, biomarkery a jejich kombinace jsou pro průkaz SS jak senzitivní, tak i specifické. Jsou také pomůckou pro stanovení závažnosti SS, jeho prognózy a také vhodným vodítkem pro účinnou léčbu. Má‑li tedy městnání v péči o nemocné se SS centrální roli, pak by lepší monitorování a účinnější léčba (diuretika, např. acetazolamid) měly zlepšit prognózu.
Věk a prognóza
Již výše zmíněná analýza velké databáze dat z primární péče ve Velké Británii ukázala, že prognóza nově manifestovaného SS se mezi roky 2002 až 2014 podstatně zlepšila (HR 0,73; CI 0,68–0,80) bez ohledu na věk. Nicméně u nemocných ve věku starším než 80 let byl pokles kardiovaskulární mortality úplně vymazán nekardiovaskulární mortalitou. Jinými slovy, úspěšná léčba SS změnila způsob, jakým nemocní umírají, ale nikoli celkovou mortalitu. Bohužel, z dat nemáme k dispozici hodnoty ejekční frakce (EF). Mnozí nemocní měli nepochybně HFpEF, a proto musíme být opatrní, abychom přičítali pokles kardiovaskulární mortality jenom léčbě SS. Systematický přehled dat z různých průzkumů a registrů také dokazuje, že se prognóza nemocných se SS zlepšila. Důležitými determinanty tohoto zlepšení jsou věk a podíl kardiologické léčby. Křehkost nemocných (frailty), která může být považována spíše za biologické než chronologické měřítko věku, může být také mohutným prediktorem invalidity a mortality. Doporučení pro léčbu nemocných s HFrEF nediskriminují podle věku. Švédský celonárodní registr nemocných se SS prokázal, že podávání inhibitorů ACE i beta‑blokátorů je u nemocných s HFrEF i ve věku nad 80 let spojeno s nižší mortalitou. Ovšem observační asociace mohou mít i jiná vysvětlení než jenom efekt léčby.
Diverzita fenotypů srdečního selhání
Cíleně a přesně prováděná medicína musí vycházet z klasifikace, na které je založen způsob léčby. Tak je tomu např. v onkologii, kde jsou nemocní přesně klasifikováni podle genetiky, lokalizace tumoru, jeho charakteru a jeho šíření. Srdeční selhání jako multisystémové postižení je však daleko komplexnější. Současná léčebně relevantní klasifikace SS zahrnuje tíži selhání (stupeň kongesce, posuzovaný podle příznaků, fyzikálních známek, biomarkerů a zobrazovacích metod), přítomnost ICHS, srdeční frekvenci, srdeční rytmus, šířku komplexu QRS, hodnotu krevního tlaku, kalemii, metabolismus železa, přítomnost mitrální regurgitace, event. infiltraci myokardu (např. amyloid) a komorový fenotyp. Optimální péče o nemocné se SS vyžaduje, s několika málo výjimkami, sice pouze nevelké množství informací, ale i to vytváří stovky různých podskupin pacientů nebo jejich clusterů, u kterých se léčba může i dosti podstatně lišit. Počet takovýchto podskupin se může exponenciálně zvyšovat se zavedením každého nového léčebného postupu. Při velké heterogenitě syndromu SS a široké paletě léčebných intervencí je přesně cílená léčba zatím v plenkách.
Jedna z možných léčebně relevantních a přitom jednoduchých klasifikací je podle hodnoty ejekční frakce levé komory, což je vlastně náhradní ukazatel dilatace levé komory. Až do roku 1980 bylo hodnocení srdeční funkce dostupné jenom ve specializovaných centrech. Diagnóza SS byla v té době založena spíše na skiagramu hrudníku než na echokardiografickém vyšetření. Výborné výsledky randomizovaných klinických studií u nemocných se SS a sníženou ejekční frakcí (HFrEF), např. ve studiích SOLVD, SAVE, MERIT, CHARM a dalších, vedly k tomu, že se podle ESC začala hodnota EF < 0,40 považovat za součást definice HFrEF. Srdeční selhání s hodnotou EF ≥ 0,40 se začalo označovat za srdeční selhání se zachovanou ejekční frakcí (HFpEF); tito nemocní pak byli dále děleni na HFmrEF (mr = mid‑range nebo mildly reduced) s EF = 0,40–0,50, HFnEF (normal) s EF > 0,50 a event. i HFsnEF (supranormal) s EF > 0,70. Analýza více než 350 000 rutinně získaných echokardiogramů, stratifikovaných podle věku a pohlaví, ukázala, že bez ohledu na to, zda nemocný má či nemá SS, je nejnižší riziko celkové mortality pro obě pohlaví mezi hodnotou EF 0,60–0,65. Zajímavé je, že hodnoty EF > 0,70 jsou spojeny s podobným rizikem jako hodnoty EF 0,30–0,40.3
Evropská doporučení pro diagnostiku a léčbu srdečního selhání zavedla v roce 2016 nově koncept HFmrEF hlavně ze dvou důvodů:
· Kvůli nepřesnosti echokardiografického měření EF, které nedokáže spolehlivě od sebe odlišit hodnoty EF v intervalu 10 %. Tím, že se mezi HFrEF a HFnEF vytvořila nárazníková zóna, ubylo špatných klasifikací. Tato inovace také znamená, že studie osob s HFpEF si nemohou nárokovat prospěch pro všechny nemocné s EF > 0,40, který je ve skutečnosti dán pouze nemocnými s hodnotou EF v rozmezí 0,40–0,49.
· Zavedení kategorie HFmrEF zpochybnilo dosavadní konvenci, že hodnota EF < 0,40 je tou správnou hranicí pro HFrEF. Některé analýzy, které byly provedeny až po publikaci ESC guidelines 2016, ukazují, že někteří nemocní s EF < 0,50 mohou na léčbu reagovat stejně jako ti s EF < 0,40. Nicméně takováto interpretace může být zkreslena nadšenými zastánci konceptu HFmrEF. Situace rozhodně není jednoznačná, zejména pokud jde o mortalitu. V budoucnosti by v klinických studiích měla být vedle hodnoty EF brána do úvahy rutinně také hodnota NP (BNP nebo NT‑proBNP) k přesnější stratifikaci rizika a event. vyloučení nízkorizikových nemocných, kteří by z užívání dalšího léku již nic nezískali.
Pokud budeme i v budoucnosti ke klasifikaci nemocných se SS používat hodnotu EF, což je velmi pravděpodobné, protože se od minulosti nemůžeme odstřihnout, pak je hlavním problémem, kde stanovit tu správnou hranici. V minulosti to pro HFrEF bylo v širokém rozmezí od < 0,25 (ve studii COPERNICUS) přes < 0,30 (ve studiích MADIT II a RAFT) do < 0,35–0,40 ve většině ostatních studií. Pro studie u nemocných s HFpEF byla obvykle dolní hranice EF > 0,40 nebo 0,45 bez stanovení horní hranice. Analýzy nedávných studií vedou některé výzkumníky k názoru, aby byl pro nemocné s HFmrEF se zvýšenou plazmatickou koncentrací NP zvýšen horní limit EF na hodnotu 0,55 a možná i na 0,60. To je ale předčasné, dokud se neprokáže konzistence takovéhoto konceptu při různých léčebných intervencích a s různými klinickými ukazateli, a také než se zpřesní stanovení hodnoty EF.
A to vůbec nediskutujeme význam stanovení (dys)funkce pravé komory u nemocných se srdečním selháním.
Fibrilace síní
Asi třetina nemocných se SS a více než polovina těch, kteří jsou pro SS hospitalizováni, má současně i fibrilaci síní. To je spojeno s horší prognózou, dokonce i po korekci na věk a další rizikové faktory. Stále pokračuje kontroverze, zda je pro nemocné se SS a fibrilací síní lepší léčebnou strategií obnovení a kontrola srdečního rytmu, nebo kontrola srdeční frekvence. V klinické praxi musí být nepochybně každému nemocnému optimální strategie „šita na míru“. Je‑li fibrilace síní zdrojem symptomů a zhoršení srdeční funkce, je vhodné obnovení a udržení sinusového rytmu. Když ale fibrilace síní odráží progresi základního onemocnění, pak nikoli. U nemocných s nově vzniklou nebo paroxysmální a výrazně symptomatickou fibrilací síní vede obvykle obnovení sinusového rytmu k vymizení nebo zlepšení symptomů. Při dlouhotrvající fibrilaci síní a SS s výrazně dilatovanými síněmi je obnovení a udržení sinusového rytmu málo pravděpodobné. Optimální farmakologická léčba pak zahrnuje antikoagulaci, vysazení toxických antiarytmik a opatrnou farmakologickou kontrolu srdeční frekvence. Pro kontrolu komorové frekvence jsou jednoznačně léky první volby beta‑blokátory s tím, že doporučená komorová frekvence je 70–90/min. K tomu obvykle stačí nízká dávka beta‑blokátoru. Digoxin by se měl používat jen výjimečně, pakliže vůbec.
Léčba
Nutno předeslat, že prakticky veškerá léčba SS založená na důkazech se týká nemocných s HFrEF. U nemocných s HFpEF byly výsledky všech dosud provedených klinických studií buď zcela neutrální, nebo rozporuplné. Pro nemocné s HFpEF tak zatím nemáme žádnou specifickou, na důkazech založenou léčbu k dispozici. Používáme proto léky symptomatické (diuretika) a léčíme pochopitelně všechny stavy a choroby, které mohou HFpEF vyvolávat, jako jsou hypertenze, ICHS a další.
Sacubitril/valsartan
Tak, jak narůstají zkušenosti s prvním duálním inhibitorem receptorů pro antiotenzin II a neprilysin (ARNI), sacubitril/valsartanem, nejen z každodenní klinické praxe, ale i z klinických studií, rychle přibývají silné argumenty pro podávání sacubitril/valsartanu jako léku první volby místo dosavadně schváleného a doporučovaného postupu záměny inhibitoru renin‑angiotenzinového systému (RAS) – inhibitoru ACE nebo sartanu – za účinnější ARNI u stabilizovaných nemocných s HFrEF. Studie prokázaly bezpečnost přímého nasazení sacubitril/valsartanu nebo převodu na něj u nemocných s akutně zhoršeným SS (studie PIONEER‑HF) za hospitalizace nebo při propuštění z hospitalizace pro SS nebo krátce po něm (studie TRANSITION). Takovéto přímé a/nebo časnější nasazení/převod na ARNI u méně hemodynamicky stabilizovaných nemocných není spojeno s horším klinickým průběhem, spíše naopak, a je velmi dobře tolerováno. Chystaná nová doporučení pro léčbu nemocných s HFrEF to již nepochybně budou reflektovat.
Další analýzy ze studie PARADIGM‑HF také naznačují, že sacubitril/valsartan může ve srovnání se samotným valsartanem zlepšit markery metabolismu kolagenu a fibrózy, zejména snížit syntézu kolagenu typu I. V souladu s tím jsou i výsledky některých studií, které prokazují, že ARNI mohou snížit tuhost aorty a vést k reverzní remodelaci levé srdeční komory (studie EVALUATE).
Zcela nedávno byly publikovány netrpělivě očekávané výsledky studie PARAGON u nemocných s HFpEF. Studie PARAGON srovnávala u 4 822 randomizovaných nemocných s HFpEF (EF > 0,45) sacubitril/valsartan se samotným valsartanem. Je to první velká randomizovaná klinická studie u nemocných s HFpEF, ve které se pro zařazení vyžadovala zvýšená plazmatická koncentrace NP jako nejmohutnějšího prognostického markeru. Všechny předcházející klinické studie se sartany u HFpEF měly neutrální výsledky (CHARM Preserved s candesartanem a I‑PRESERVE s irbesartanem). I výsledek studie PARAGON byl co do ovlivnění výskytu primárního kombinovaného ukazatele (kardiovaskulární úmrtí + celkový počet opakovaných hospitalizací pro SS) neutrální (obr. 1).4
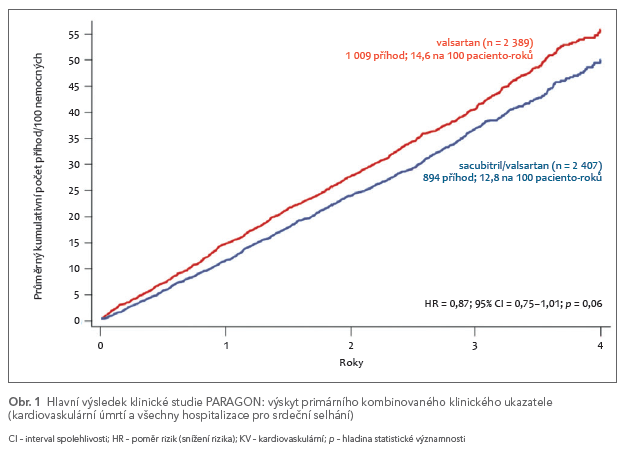
Někteří argumentují, že hodnota p = 0,06 je velmi blízko hranici pro statistickou významnost, a že se tedy jedná o skoro pozitivní studii. To je ale nesmyslná interpretace. Studie ukázala, že velikost potenciálního prospěchu z léčby sacubitril/valsartanem je u HFpEF velmi skromná bez ohledu na hodnotu p a že léčba by pravděpodobně nebyla nákladově efektivní. Musíme proto hledat léčbu účinnější nebo se pokusit alespoň najít podskupiny nemocných, u kterých by byl efekt větší. Podskupinová analýza naznačila, že sacubitril/valsartan je účinnější u nemocných s hodnotou EF nižší, než byl ve studii její medián (0,57), ale i u této podskupiny byl účinek dán převážně snížením počtu hospitalizací pro SS, a nikoli snížením kardiovaskulární mortality. Podobně byl sacubitril/valsartan bez ohledu na hodnotu EF účinnější u žen. Tento prospěch byl opět podmíněn výhradně snížením počtu hospitalizací pro srdeční selhání. Výsledky podskupinové analýzy však musejí být vždy interpretovány s nejvyšší opatrností a mohou se maximálně stát východiskem pro naplánování a provedení další studie. Co do ovlivnění výskytu primárního ukazatele byla studie PARAGON neutrální a mortalita v ní nebyla ovlivněna vůbec. V letošním roce bychom se měli dočkat výsledků studie PARALLAX, která analyzuje účinky sacubitril/valsartanu na kvalitu života nemocných s HFpEF.
Inhibitory SGLT2 (glifloziny)
Protein SGLT2 (sodno‑glukózový kotransportér typu 2) se nachází hlavně v proximálních tubulech ledvin, podstatně méně pak v jiných orgánech. Protein SGLT1 se nachází ve střevě a v myokardu. Inhibitory SGLT2 působí glykosurii a tím vedou ke snížení glykemie, což se stalo podkladem pro léčbu diabetes mellitus 2. typu. Současně působí osmotickou diurézu a tím snižují plazmatický objem. Inhibitory SGLT1 pak snižují absorpci glukózy ze střeva, což může působit průjem, a může mít také příznivý efekt na utilizaci energie v myokardu. Většina inhibitorů SGLT2 včetně dapagliflozinu a empagliflozinu je vysoce selektivních, sotagliflozin má selektivitu nižší.
Poté, co se v klinických studiích u nemocných s DMT2 ukázalo, že inhibitory SGLT2 nejenom významně zlepšují metabolismus glukózy, ale překvapivě významně zlepšují i kardiovaskulární prognózu (snižují KV morbiditu i mortalitu, zejména rozvoj SS), byly cíleně provedeny velké klinické studie s inhibitory SGLT2 u nemocných s HFrEF bez ohledu na to, zda současně mají DM, nebo nemají. Dnes již máme k dispozici výsledky dvou velkých klinických studií se dvěma různými inhibitory SGLT2 a jejich závěry jsou velmi podobné výsledkům předcházejících studií u diabetiků, tj. DECLARE‑TIMI 58 a EMPA‑REG OUTCOME.
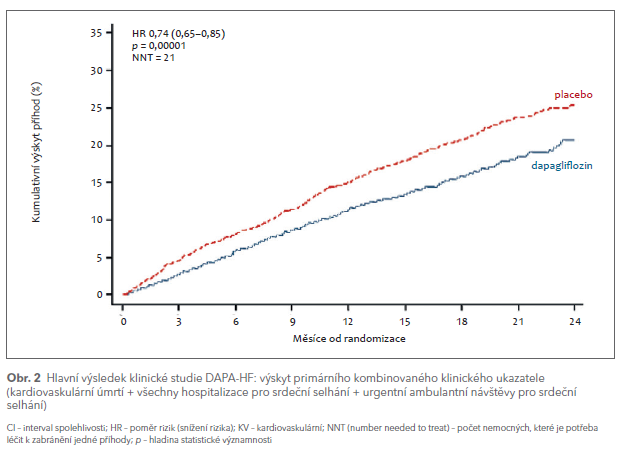
Klinická studie DAPA‑HF zařadila 4 744 nemocných a sledovala je po dobu 18,3 měsíce (medián). Prokázala, že přidání dapagliflozinu nemocným s HFrEF navíc ke standardní léčbě podle stávajících doporučení snížilo výskyt hospitalizací pro SS o 30 % a mortalitu (převážně kardiovaskulární) o 18 %, což odpovídá zabránění 3–5 hospitalizacím a 1–2 úmrtím/100 nemocných léčených po dobu jednoho roku (obr. 2).5 Nemocní na dapagliflozinu také měli proti placebu nižší výskyt nežádoucích účinků, zejména renálních. Prospěch z léčby dapagliflozinem byl konzistentní ve všech předem specifikovaných podskupinách, především u diabetiků stejně jako u nediabetiků, a to bez ohledu na věk. Dapagliflozin také zlepšoval kvalitu života, tento účinek byl potvrzen i v následné studii DEFINE.
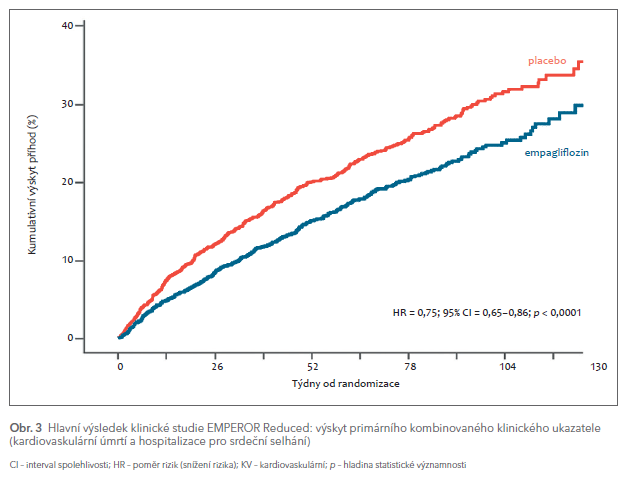
Studie EMPEROR Reduced zkoumala proti placebu, opět při standardní léčbě SS podle stávajících doporučení, účinek jiného inhibitoru SGLT2 – empagliflozinu. Bylo do ní zařazeno 3 730 nemocných s HFrEF (EF ≤ 0,40) bez ohledu na to, zda mají nebo nemají DM. V průběhu sledování po dobu 16 měsíců (medián) vedl empagliflozin k významnému snížení výskytu primárního kombinovaného klinického ukazatele (KV úmrtí a hospitalizace pro SS) o 25 % (HR 0,75; CI 0,65–0,86; p < 0,0001) (obr. 3).6 Empagliflozin také významně snížil o polovinu výskyt závažných renálních nežádoucích účinků (HR 0,50; CI 0,32–0,77; p < 0,01).
Do obou velkých klinických studií s inhibitory SGLT2 u nemocných s HFrEF, tj. DAPA‑HF a EMPEROR Reduced, byli zařazeni nemocní s HFrEF ve funkční třídě NYHA II–IV s etiologií ischemickou i neischemickou, kteří byli rutinně léčeni standardní léčbou založenou na důkazech, tedy inhibitory RAS, beta‑blokátory a u většiny nemocných také MRA. Zhruba polovina nemocných v obou studiích nebyli diabetici. Nemocní ve studii EMPEROR Reduced s empagliflozinem měli o něco těžší SS, měli nižší průměrnou EF a vyšší plazmatické koncentrace NT‑proBNP, měli nižší průměrnou hodnotu glomerulární filtrace a také byli častěji léčeni sacubitril/valsartanem. Přestože obě klinické studie zařadily překrývající se a komplementární populace, obě přinesly vysoce souhlasné výsledky. Výskyt průměrného kombinovaného klinického ukazatele byl v obou studiích snížen shodně o 25 %, vysoce statisticky významně a konzistentně ve všech definovaných podskupinách. V obou studiích byl klinický prospěch dán především poklesem hospitalizací pro SS přibližně o 30 %. Klinický prospěch byl podobný u diabetiků i nediabetiků, stejně jako u nemocných užívajících MRA nebo ARNI. Navíc, v obou studiích bylo dokumentováno zlepšení kvality života i vynikající tolerabilita obou inhibitorů SGLT2. Obě studie také dokumentovaly nižší riziko výskytu klinicky závažných renálních příhod (chronická dialýza, transplantace ledvin nebo vznik dlouhodobého těžkého zhoršení renálních funkcí), a to o 29 % ve studii DAPA‑HF, a dokonce o 50 % ve studii EMPEROR Reduced. Všechen tento skvělý prospěch byl dosažen za relativně krátkou dobu sledování 16–18 měsíců. Celková mortalita byla v metaanalýze studií u DMT2 snížena o 15 %, v metaanalýze studií u nemocných s HFrEF pak o 13 %. Takovéto vynikající úspěchy byly dosaženy léky, které se podávají jednou denně, nevyžadují up‑titraci a jejich užívání není doprovázeno hypotenzí, bradykardií, hyperkalemií ani hyperazotemií, tedy problémy, které často doprovázejí v současnosti doporučovanou farmakoterapii srdečního selhání. To vše podporuje roli obou gliflozinů jako nového standardu léčby HFrEF a pravděpodobně i chronických renálních onemocnění.
Jak by měla vypadat léčba srdečního selhání založená na důkazech v roce 2021?
V současnosti jsou pro diagnostiku a léčbu SS stále ještě platná oficiální doporučení ESC a potažmo ve zkrácené verzi ČKS z roku 2016.1,2 Podle nich jsou u symptomatických nemocných s HFrEF kromě diuretik jako symptomatické léčby indikovány také následující tři skupiny léčiv jako hlavní pilíře léčby ovlivňující příznivě prognózu. Jsou to inhibitory RAS (inhibitory ACE nebo sartany), beta‑blokátory a MRA (spironolakton nebo eplerenon). Všechny tyto tři skupiny léčiv založených na důkazech, určené pro nemocné s HFrEF, snižují dlouhodobou patologickou aktivaci hlavních neurohumorálních systémů renin‑angiotenzin‑aldosteronového (RAAS) a sympatoadrenálního (SAS). V roce 2016 vstoupila do doporučení nová skupina látek založená na duální inhibici receptorů pro angiotenzin II a neutrální endopeptidázy (neprilysinu) – ARNI (angiotensin receptor/neprilysin inhibitor) – v podobě zatím jediného přípravku sacubitril/valsartanu. Sacubitril/valsartan je v prevenci hospitalizací pro SS a KV úmrtí o 20 % účinnější než inhibitor ACE enalapril, a proto byl u stále symptomatických ambulantních nemocných v klinicky stabilizovaném stavu doporučen jako náhrada samotného inhibitoru RAS (inhibitoru ACE nebo sartanu). Od té doby však bylo provedeno a publikováno několik klinických studií, jejichž výsledky celkem přesvědčivě dokazují, že na sacubitril/valsartan lze nemocné s HFrEF bezpečně převést daleko časněji, již v průběhu hospitalizace pro zhoršení SS, při propuštění z hospitalizace nebo záhy po něm. Výsledky posledních studií pak jasně dokládají, že je naprosto bezpečné zahájit léčbu sacubitril/valsartanem přímo, bez nutnosti předchozího nasazení a titrace inhibitoru ACE/sartanu. Přestože je sacubitril/valsartan o 20 % účinnější než předchozí léčba inhibitorem ACE/sartanem, je jeho zavádění do klinické praxe překvapivě pomalé. Podle výsledků posledních klinických studií s glifloziny je jím léčeno jen 10–20 % nemocných s HFrEF.
Do armamentaria látek pro léčbu nemocných s HFrEF přibyla nedávno nová mocná zbraň – inhibitory SGLT2 (glifloziny) – dapagliflozin, empagliflozin a nepochybně vbrzku i další přípravky. Jejich účinek je mohutný (pokles KV mortality cca o 25 % navíc ke standardní léčbě), evidentně skupinový a jeho mechanismus není závislý na stavu neurohumorální aktivace. Nepochybuji vůbec o tom, že nová doporučení ESC, která mají být publikována v průběhu roku 2021, zahrnou inhibitory SGLT2 jako součást rutinní léčby HFrEF. Kromě toho že jejich příznivý účinek je dán zcela odlišným (byť ne zcela objasněným) mechanismem, mají i další neocenitelné vlastnosti. Mezi ně nepochybně patří jednoduchost dávkovacího režimu, daná stejnou dávkou pro každého nemocného, užívanou jednou denně, minimálním účinkem na krevní tlak a úplným chyběním nežádoucích renálních účinků. Naopak, inhibitory SGLT2 poskytují navíc významné renoprotektivní účinky. Představují tak ideální látky pro léčbu nemocných s HFrEF, které mohou být okamžitě přidány ke stávající trojici inhibitorů neurohumorální aktivace. V nových doporučených postupech tak bude figurovat již čtveřice léčiv, doporučených na základě důkazů, a to sacubitril/valsartan, beta‑blokátory, MRA a inhibitory SGLT2. Pořadí, v němž by jednotlivé látky měly být podány, je bezpředmětné, vznikalo historicky. Objevují se stále naléhavější argumenty pro současné nasazení léků ze všech čtyř základních tříd. Zdůvodněním takového postupu je, že každý z léků působí jiným mechanismem, příznivé účinky se objevují překvapivě brzy, proti kontrolním skupinám v klinických studiích v průběhu několika týdnů, kdy se může rychle zlepšovat klinický stav, velikost i funkce levé komory a začne se snižovat nutnost opakovaných hospitalizací pro zhoršení SS i KV mortalita. Po 30 dnech léčby všemi čtyřmi základními léky klesá nemocnému relativní riziko úmrtí o více než tři čtvrtiny. Současné nasazení všech čtyř základních léčiv ušetří až rok času ve srovnání s postupným podáváním a titrací optimální dávky.
Největším problémem v současné praxi léčby nemocných s HFrEF je, že podstatná část nemocných některé ze základních léčiv vůbec nedostane, a pokud je dostane, tak v nedostatečných denních dávkách. Tuto léčebnou netečnost dobře dokumentují průzkumy z různých částí světa. Například nedávno publikované výsledky průzkumu CHAMP‑HF (Change the Management of Patients with Heart Failure) u 3 500 nemocných s HFrEF ze 150 kardiologických ordinací v USA v letech 2015–2017 ukázaly, že jen 22 % nemocných skutečně dostávalo léky ze všech tří doporučených skupin, tj. inhibitory RAS (včetně ARNI), beta‑blokátory a MRA. A jen zanedbatelné 1 % indikovaných nemocných dostávalo všechny tři látky v doporučených dávkách.7 A vůbec si nedělejme iluze, že u nás je situace lepší.
Literatura
1. Ponikowski P, Voors AA, Anker S, et al. 2016 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure. The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special constribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016;37:1–17.
2. Špinar J, Hradec J, Špinarová L, Vítovec J. Souhrn Doporučených postupů ESC pro diagnostiku a léčbu akutního a chronického srdečního selhání z roku 2016. Připraven Českou kardiologickou společností. Cor Vasa 2016;58:597–636, event. Cor Vasa 2016;58:e530–e568.
3. Wehner GJ, Jing L, Haggerty CM, et al. Routinely reported ejection fraction and mortality in clinical practice: where does the nadir of risk lie? Eur Heart J 2020;41:1249–1257.
4. Solomon SD, McMurray JJV, Anand IS, et al. Angiotensin‑neprilysin inhibition in heart failure with preserved ejection fraction. N Engl J Med 2019;381:1609–1620.
5. McMurray JJV, Solomon SD, Inzucchi SE, et al. DAPA‑HF Trial Committees and Investigators. Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med 2019;381:1995–2008.
6. Packer M, Anker SD, Butler J, et al. Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med 2020;383:1413–1424.
7. Greene SJ, Butler J, Albert NM, et al. Medical therapy for heart failure with reduced ejection fraction: the CHAMP‑HF registry. J Am Coll Cardiol 2018;72:351–366.
Zdroj: MT