Generická léčiva – fakta a mýty
Článek shrnuje klíčové aspekty generických léčiv, včetně jejich definice, regulačních požadavků, bioekvivalence a ekonomického dopadu. Zdůrazňuje jejich rovnocennost s originálními přípravky a význam pro udržitelnost zdravotních systémů. Věnuje se i rozdílům mezi generiky a biosimilars.
Úvod
Farmaceutický průmysl se dlouhodobě řadí mezi nejdynamičtěji se rozvíjející odvětví lidské činnosti. Je zde vysoká poptávka po účinných a současně bezpečných lécích za přijatelnou cenu. Prostředí je vysoce kompetitivní, o čemž svědčí ostatně i množství držitelů rozhodnutí o registraci (MAH) – pouze na českém trhu jejich počet fluktuuje v řádech několika stovek. Jistě zdaleka nejde výhradně o tzv. originální společnosti, pro jejichž fungování jsou invence a inovace základním palivem. Současně však i u generických společností lze pozorovat snahu vymezit se vůči potenciální konkurenci kupř. inovacemi v podobě modifikací na úrovni lékové formy, velikosti tablety, zlepšení jejích vlastností (lepší chuť, vzhled, aroma atp.). Generické společnosti nicméně obvykle postrádají dostatečný potřebný kapitál, který by mohly alokovat do potřebného sektoru Research & Development (R&D, respektive jejich kapitál do tohoto sektoru vložený pokrývá pouze ony drobné dílčí modifikace již obchodovaného léčivého přípravku) ve smyslu vývoje nových a inovativně působících léčivých látek. Případně takovým kapitálem disponují, avšak investují jej do jiných oblastí, jako jsou např. vývoj komplexních generik, biosimilární expanze, environmentálně šetrnější výrobní postupy apod.
Podle definice Světové zdravotnické organizace (WHO) představuje generikum léčivo, které obsahuje stejnou účinnou látku, má stejnou sílu, lékovou formu i cestu podání jako referenční přípravek a je uvedeno na trh po vypršení jeho patentu.1 Národní regulační autority jako americký Úřad pro kontrolu potravin a léčiv (FDA) nebo Evropská agentura pro léčivé přípravky (EMA) navíc požadují prokazování vzájemné bioekvivalence tak, aby bylo zajištěno, že generika skutečně poskytují pacientům stejnou klinickou účinnost jako referenční přípravky.2,3
Farmakokinetické studie bioekvivalence prokazují, že u většiny generik se rozdíl klíčových parametrů, jako jsou maximální plazmatická koncentrace (Cmax) a plocha pod křivkou (AUC), pohybuje pouze kolem 3–4 %, což odpovídá běžným odchylkám mezi šaržemi u originálních výrobků.3,4 V reálném prostředí navíc rozsáhlé kohortové studie neodhalují žádné významné rozdíly v bezpečnosti ani účinnosti mezi originály a generiky, čímž podporují politiku substituce léků po vypršení patentu.5
V posledních dekádách co do významu i participace na trhu výrazně vzrůstá podíl farmaceutických společností generujících tzv. biologicky podobné léčivé přípravky (biosimilars). Připusťme, že tento termín ještě zcela spolehlivě nezakotvil v myslích odborné zdravotnické veřejnosti a nezřídka je zaměňován s označením pro generická léčiva. WHO definuje tyto přípravky jako bioterapeutické výrobky shodující se kvalitou, bezpečností a účinností s již licencovanými referenčními bioterapeutickými přípravky. Dle FDA jde o biologické přípravky velmi podobné referenčnímu přípravku s pouze zanedbatelnými odlišnostmi v klinicky neúčinných složkách, současně se vzájemně významně neliší v klinické účinnosti a není zřejmý ani rozdíl v bezpečnosti a čistotě.
Z perspektivy České republiky je bezesporu významný pohled evropské regulační autority, tedy EMA, která uvádí, že biosimilární léčiva nesplňují definici generického přípravku, a to především vzhledem k odlišnostem ve vstupních materiálech nebo výrobních procesech. Státní ústav pro kontrolu léčiv uvádí, že jde o léky, které jsou podobné biologickým přípravkům a originálním přípravkům se pouze podobají, přičemž na rozdíl od registrace generik musí být u těchto přípravků jasně doložena účinnost a bezpečnost vlastními klinickými studiemi. Nejsou tedy postačující pouze informace plynoucí z klinických studií prováděných s originálním léčivým přípravkem.
Porovnáme‑li generické, originální a biosimilární přípravky, je zřejmé, že poslední zmíněné se budou nacházet mezi dosud výhradně dostupnými referenčními léky a jejich generickými kopiemi při hodnocení pravděpodobnosti dosažení klinického úspěchu, potřebné délky přípravy na registraci (preklinické [farmakokinetické a farmakodynamické studie, studie toxicity, imunogenicity…] a klinické [účinnost a bezpečnost, včetně imunogenicity, ve srovnání s referenčním přípravkem] testování a proces registrace) i v nákladech, které jsou třeba na jejich vývoj. Vzhledem k současnému boomu nejrůznějších přípravků označovaných jako biologická léčiva (Pozn.: dle některých autorů spíše jako cílená léčiva), která již zdaleka nejsou výhradní doménou léčby onkologických onemocnění (Pozn.: uplatňují se v léčbě autoimunitních onemocnění, osteoporózy, asthma bronchiale atd.), se vzhledem k postupně končícím patentovým ochranám dílčích přípravků otevírá obrovský prostor právě pro biologicky podobná léčiva, tedy biosimilars, jež v sobě skrývají nemalý komerční potenciál.
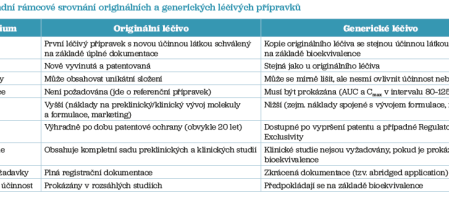 Základní rámcové porovnání generických a originálních léčivých přípravků shrnuje tabulka 1.
Základní rámcové porovnání generických a originálních léčivých přípravků shrnuje tabulka 1.
Důležitost investic
Podle Evropské federace farmaceutického průmyslu a asociací (EFPIA) je největší podíl z ročního obratu v rámci sledovaných odvětví průmyslu zpětně alokován do R&D na výzkum vzácných onemocnění (24,6 %), následován farmaceutiky (15,9 %) a vývojem softwaru a hardwaru (9,8 %).6
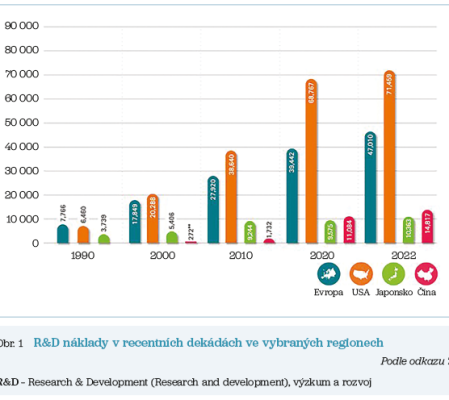 Objem finančních prostředků alokovaných na R&D přitom dlouhodobě roste (i po zohlednění inflace), a to v zemích Evropské unie (EU), ve Spojených státech amerických (USA) či Japonsku a recentně velmi výrazně též v Číně (obr. 1).7
Objem finančních prostředků alokovaných na R&D přitom dlouhodobě roste (i po zohlednění inflace), a to v zemích Evropské unie (EU), ve Spojených státech amerických (USA) či Japonsku a recentně velmi výrazně též v Číně (obr. 1).7
Regulační rámec
Zvyšující se náklady na zdravotní péči jsou do značné míry spojeny s vysokou cenou inovativních (syn. originálních) léčivých přípravků chráněných patentovou ochranou; zejména to platí pro léčivé přípravky určené k léčbě vzácných onemocnění (podle evropské legislativy jde o onemocnění s četností nižší než 5/10 tisíc obyvatel; odhaduje se, že takových chorob je okolo 6 tisíc a trpí jimi cca 30 milionů příslušníků evropské populace), tzv. sirotčí léky (orphan drugs).
Legislativní prostředí chrání inovátory po dobu obvykle dvaceti let od podání patentové přihlášky, čímž jim umožňuje získat zpět náklady na výzkum a tyto opět reinvestovat. Po uplynutí této doby mohou na trh vstoupit generická léčiva v případě, že jejich výrobce u nich prokáže shodu s referenčním přípravkem.
V EU jsou léčiva pro vzácná onemocnění chráněna kombinací patentové ochrany a tržní výhradnosti (Regulatory Data Exclusivity). Základní patentovou ochranu lze prodloužit o dodatečné ochranné osvědčení až o 5 let, aby se kompenzovala doba ztracená během vývoje a schvalovacího řízení léčiva.
Kromě toho získávají tato léčiva 10 let tržní výhradnosti od data udělení první registrace v EU pro konkrétní indikaci vzácného onemocnění, což brání konkurenci uvádět na trh obdobné přípravky pro tutéž indikaci během této doby. Pokud držitel registrace dokončí schválený pediatrický výzkumný plán pro danou vzácnou indikaci, může se doba tržní výhradnosti prodloužit dokonce až na 12 let. Tyto režimy běží současně se standardními obdobími výhradnosti dat.8,9
V Evropě centrální schvalovací postup EMA umožňuje jednorázové hodnocení pro všechny členské státy, zatímco systém evropské konvergence usnadňuje vzájemné uznávání mezi státy mimo centralizovaný režim.
Výroba a bioekvivalence
Výrobci originálních i generických léčivých přípravků musejí dodržovat zásady správné výrobní praxe (GMP), které pokrývají kontrolu surovin, čistotu účinné látky i excipientů, standardizaci výrobního prostředí a mapování rizik v jednotlivých výrobních krocích. Každá šarže prochází pečlivými testy, jako je obsahová uniformita, in vitro rozpustnost, kontroly sterility nebo stabilita při různých teplotách, aby byly dodrženy předepsané standardy.
Současná definice generických léčivých přípravků vychází ze směrnice Evropského parlamentu a Rady 2001/83/ES, čl. 10 odst. 2 písm. b). Podle ní se generickým léčivým přípravkem rozumí přípravek, jenž má kvalitativně i kvantitativně totožné složení účinných látek a stejnou farmaceutickou formu jako referenční léčivý přípravek a jehož bioekvivalence s referenčním přípravkem byla prokázána příslušnými studiemi biologické dostupnosti.
Různé soli, estery, ethery, izomery, směsi izomerů, komplexy či deriváty jedné účinné látky se považují za tutéž účinnou látku, pokud nejsou prokázány významné rozdíly z hlediska bezpečnosti nebo účinnosti. Dále se za jednu a tutéž farmaceutickou formu považují všechny perorální lékové formy s okamžitým uvolňováním účinné látky.
Při porovnávání dvou léčivých přípravků je standardně doporučována randomizovaná studie s překřížením zahrnující dvě periody a dvě sekvence s jednorázovou dávkou. Léčebné periody musejí být odděleny dostatečně dlouhým „vymývacím“ (wash‑out) obdobím tak, aby koncentrace léčiva na počátku druhé periody u všech subjektů klesly pod dolní mez kvantifikace zvolených bioanalytických metod. Obvykle k tomu stačí alespoň pět biologických poločasů.
Výběr populace účastníků studií bioekvivalence (BES) by měl být proveden s cílem umožnit detekci možných rozdílů mezi farmaceutickými přípravky. Aby se minimalizovala variabilita nesouvisející s rozdíly mezi přípravky, měly by být studie za normálních okolností prováděny u zdravých dospělých dobrovolníků (minimální počet probandů je 12), pokud profil bezpečnosti léčiva nečiní takové provedení neetickým.
Obecně se studie bioekvivalence provádí za lačných podmínek, neboť to představuje nejcitlivější režim pro odhalení případných rozdílů mezi hodnocenými přípravky. Tam, kde souhrn údajů o přípravku (SmPC) doporučuje užití referenčního léčivého přípravku nalačno nebo bez ohledu na příjem potravy, by se studie bioekvivalence měla realizovat za lačných podmínek. Naopak u přípravků, u nichž SmPC stanoví užívání referenčního přípravku pouze ve stavu po jídle, by se studie bioekvivalence zpravidla měla provádět za sytých podmínek. U přípravků se specifickými formulačními vlastnostmi (např. mikroemulze, disperzní systémy apod.) se požaduje provedení studií bioekvivalence jak za lačných, tak za sytých podmínek, není‑li předepsáno výhradní užívání na lačno nebo výhradně po jídle.
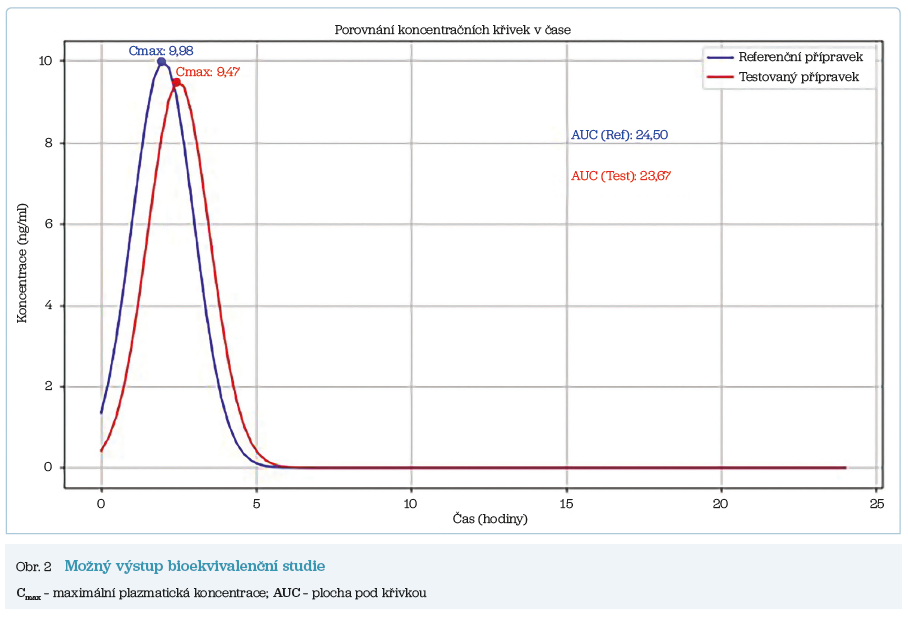 Odebranými vzorky krve se sleduje časový průběh koncentrace účinné látky s vypočtením klíčových farmakokinetických parametrů Cmax a AUC (obr. 2). Regulátoři standardně akceptují 90% interval spolehlivosti poměru Cmax i AUC v rozmezí 80–125 %, což odráží přirozené variace výroby. U léčiv s úzkým terapeutickým rozmezím je v odůvodněných případech nutné zpřísnit akceptační interval pro parametr AUC na 90,00–111,11 %. Pokud má parametr Cmax zásadní význam z hlediska bezpečnosti, účinnosti nebo terapeutického monitorování, měl by být stejný zpřísněný interval 90,00–111,11 % aplikován i na tento parametr.
Odebranými vzorky krve se sleduje časový průběh koncentrace účinné látky s vypočtením klíčových farmakokinetických parametrů Cmax a AUC (obr. 2). Regulátoři standardně akceptují 90% interval spolehlivosti poměru Cmax i AUC v rozmezí 80–125 %, což odráží přirozené variace výroby. U léčiv s úzkým terapeutickým rozmezím je v odůvodněných případech nutné zpřísnit akceptační interval pro parametr AUC na 90,00–111,11 %. Pokud má parametr Cmax zásadní význam z hlediska bezpečnosti, účinnosti nebo terapeutického monitorování, měl by být stejný zpřísněný interval 90,00–111,11 % aplikován i na tento parametr.
Využití renálních ukazatelů eliminace močí jako zástupce plazmatické koncentrace může být akceptováno pro stanovení rozsahu expozice v případech, kdy není možné spolehlivě měřit časový průběh plazmatických koncentrací mateřské sloučeniny. Na straně druhé se obvykle nedoporučuje hodnocení koncentrace metabolitů jako zástupný ukazatel systémové expozice.
Pokud je studovaná látka endogenního původu, měly by se při výpočtu farmakokinetických parametrů aplikovat korekce na bazální koncentraci tak, aby vypočtené parametry odrážely výhradně navýšené koncentrace způsobené podáním léčby.
V případě žádosti o registraci několika různých sil testovaného přípravku může v závislosti na poměrném složení mezi jednotlivými silami a na dalších charakteristikách přípravku (množství a typ excipientů) postačit prokázat bioekvivalenci pouze u jedné či dvou sil. Studii bioekvivalence je obecně vhodné provádět u nejvyšší síly přípravku.
V rámci posuzování bioekvivalence by žadatel měl prezentovat rovněž výsledky disolučních testů in vitro ve třech různých pufrech (obvykle pH 1,2, 4,5 a 6,8) a v médiích určených pro uvolňování léčivého přípravku (QC média) získaných se šaržemi testovaných a referenčních přípravků použitých v rámci BES. Pokud se během 15 minut rozpustí více než 85 % léčiva, lze profily rozpouštění akceptovat jako podobné bez dalšího matematického vyhodnocení.
Problematika realizace BES je zjevně velmi komplexní a cílem tohoto textu není podat kompletní výčet veškerých aspektů. Proto pouze okrajově zmiňme, že BES může být opominuta, tj. není vyžadována na základě fyzikálně‑chemických vlastností účinných látek podle Biofarmaceutického klasifikačního systému (BCS) léčivých látek v případě, že tyto vykazují vysokou rozpustnost a adekvátní permeabilitu.
BES se obecně nevyžadují v případě, že testovaný přípravek je podáván jako vodný intravenózní roztok obsahující stejnou léčivou látku jako již schválený referenční přípravek. Výjimku tvoří situace, kdy pomocné látky obsažené v přípravku interagují s léčivou látkou (například tvorbou komplexů) nebo jinak ovlivňují její farmakokinetické vlastnosti. V takových případech je bioekvivalenční studie nezbytná, pokud oba přípravky neobsahují stejné pomocné látky ve velmi podobném množství a nelze dostatečně prokázat, že rozdíly v jejich množství nemají vliv na farmakokinetiku léčivé látky.
U jiných parenterálních způsobů podání, jako je například intramuskulární nebo subkutánní aplikace, se bioekvivalenční studie rovněž nevyžadují, pokud testovaný přípravek představuje stejný typ roztoku (vodný nebo olejový), obsahuje stejnou koncentraci léčivé látky a stejné pomocné látky v obdobném množství jako referenční léčivý přípravek. Bioekvivalenční studie není dále nutná ani v případě vodného parenterálního roztoku s obdobnými pomocnými látkami ve srovnatelném množství, pokud je prokázáno, že tyto látky nemají vliv na viskozitu přípravku.
BES není rovněž požadována u plynných lékových forem a lokálně aplikovaných léčivých přípravků bez významné systémové expozice účinné látce. Kromě kvantitativně‑kvalitativního srovnání zde nicméně bývá požadavek na průkaz bioterapeutické ekvivalence.
Veškeré výše uvedené informace vycházejí z dokumentu CPMP/EWP/ QWP/1401/98 Rev. 1/ Corr s názvem Guideline on the Investigation of Bioequivalence. Je stále aktuální a platný. Jeho poslední revize (Rev. 1) byla přijata 20. ledna 2010 a vstoupila v platnost 1. srpna 2010.10 Nicméně, od 25. ledna 2025 začala v EU platit nová směrnice – ICH M13A, která částečně nahrazuje některé části tohoto dokumentu; analogicky byly aktualizovány též požadavky stran biowaiveru (≈ výjimka z povinnosti provádět BES) na podkladě BCS.11
Ekonomické a tržní aspekty
Originátoři často uplatňují hodnotově orientované ceny reflektující klinický přínos, náklady na vývoj a konkurenční benchmarking, zatímco generika po vstupu na trh začínají na úrovních o desítky procent nižších; cena referenčního přípravku po vstupu generik na trh se jim obvykle dorovnává, tj. adekvátně se ponižuje. Kupříkladu v USA v roce 2023 tvořila generika a biosimilární přípravky 90 % všech vydaných receptů, přičemž na celkové výdaje připadalo méně než 15 %, což přineslo plátcům a pacientům úsporu odhadovanou na 445 miliard dolarů ročně.14 V Evropě pokles výdajů na farmaceutika v rozvinutých trzích díky generikům dosahuje až 30 %, což umožňuje uvolnit prostředky pro nové terapie nebo jiné zdravotnické priority.12,13 Kolaterálním důsledkem může být i stažení originálního přípravku z trhu, jenž pro něj není dostatečně lukrativní, a dostupná jsou pouze generika – v České republice jde např. o molekuly simvastatinu, rosuvastatinu, sumatriptanu a řadu jiných.
Pohled zúčastněných subjektů
Lékaři se při předepisování rozhodují na základě důvěry v bioekvivalenční proces a vlastních zkušeností. V praxi někteří setrvávají u značkových názvů u léčiv s úzkým terapeutickým rozmezím, respektive nízkým terapeutickým indexem. Většinou jde o přípravky, jejichž plazmatické koncentrace jsou často předmětem terapeutického sledování – např. starší antiepileptika. Na dané nicméně musí pomýšlet i farmaceut v kontextu možné generické substituce v souladu se zákonnými předpisy. Při komunikaci s pacienty i předepisujícím lékařem musí pečlivě vyvažovat ekonomické i klinické aspekty výdeje léčivého přípravku, nezřídka na pozadí nejrůznějších pobídek, jako mohou být např. rozdílné výdejní marže, promoční akce apod.
Pacientům přináší substituce nižší doplatky, avšak zároveň může vyvolat otázky o účinnosti a bezpečnosti (pacient má vždy možnost generickou substituci odmítnout!). Namístě jsou proto třeba jasné a srozumitelné materiály, osobní poradenství a poukázání na rigorózní testování, jež mohou zmírnit případné obavy a zamezit efektu, kdy negativní očekávání ovlivní subjektivní vnímání léčby. Z pohledu pojišťoven a nemocničních rozpočtů generika představují klíčovou strategii kontroly nákladů.
Politiky a implementace
Účinné zákonné rámce pro substituci léků musejí vyvážit zájem na úsporách s právem pacienta na výběr a s klinickým úsudkem lékaře. Povinná substituce, doplněná možností odmítnutí v případech klinické potřeby, přináší okamžité úspory, ale vyžaduje přísnou evidenci změn, aby bylo možné sledovat možné odchylky v terapii. Referenční cenový model zase stanoví maximální náhradu pro příslušnou skupinu léčiv, přičemž rozdíl v ceně za dražší přípravek hradí pacient.
Finanční i nefinanční pobídky posilují ochotu lékařů, lékárníků i pacientů přijmout generika. Výkonově orientované odměny pro lékaře a různé marže či výdejní poplatky pro lékárníky vytvářejí ekonomickou motivaci, zatímco snížené doplatky pro pacienty zvyšují jejich angažovanost. Doplňující vzdělávací programy pro odbornou veřejnost, informační portály a mediální kampaně napomáhají objasnit regulační přísnost a výsledky reálných studií.
Reálná data z registrů a zdravotních záznamů potvrzují, že po přechodu na generikum nedochází ke zvýšení frekvence hospitalizací, ke změnám v kontrole onemocnění ani ke statisticky významnému nárůstu nežádoucích účinků. Tyto výsledky přispívají k posilování důvěry lékařů i pacientů v generická léčiva a podporují státní programy substituce a úsporná opatření.5
Závěr a doporučení
 Generická léčiva představují klíčový nástroj moderní farmakoterapie, který umožňuje širší dostupnost léčby při zachování vysokých standardů bezpečnosti a účinnosti. Na základě přísných regulačních požadavků zejména v oblasti bioekvivalence lze generika považovat za plnohodnotnou alternativu k originálním přípravkům ve většině terapeutických oblastí – určitou výjimkou jsou léčivé přípravky s nižším terapeutickým indexem, respektive užším terapeutickým rozmezím, u kterých je žádoucí zvýšená opatrnost v případě generické substituce.
Generická léčiva představují klíčový nástroj moderní farmakoterapie, který umožňuje širší dostupnost léčby při zachování vysokých standardů bezpečnosti a účinnosti. Na základě přísných regulačních požadavků zejména v oblasti bioekvivalence lze generika považovat za plnohodnotnou alternativu k originálním přípravkům ve většině terapeutických oblastí – určitou výjimkou jsou léčivé přípravky s nižším terapeutickým indexem, respektive užším terapeutickým rozmezím, u kterých je žádoucí zvýšená opatrnost v případě generické substituce.
 Přestože přetrvávají určité mýty a obavy zejména mezi pacienty, dostupná data z klinické praxe i rozsáhlých studií potvrzují, že generická substituce je bezpečná, efektivní a ekonomicky výhodná. Klíčovou roli v jejím úspěšném uplatnění hraje informovanost zdravotnických pracovníků i pacientů podpořená transparentními regulačními procesy a důvěrou ve vědecké důkazy.
Přestože přetrvávají určité mýty a obavy zejména mezi pacienty, dostupná data z klinické praxe i rozsáhlých studií potvrzují, že generická substituce je bezpečná, efektivní a ekonomicky výhodná. Klíčovou roli v jejím úspěšném uplatnění hraje informovanost zdravotnických pracovníků i pacientů podpořená transparentními regulačními procesy a důvěrou ve vědecké důkazy.
Závěrečné tabulky 2 a 3 shrnují nejčastěji zmiňovaná fakty a mýty stran generických léčivých přípravků.
Doc. MUDr. Jiří Slíva, Ph.D., MBA
Ústav farmakologie 3. LF UK, Praha
E‑mail: slivaj@seznam.cz
Literatura
- World Health Organization. WHO Model List of Essential Medicines — 22nd List (2021). Geneva: WHO; 2021.
- US Food and Drug Administration. Guidance for Industry: Bioavailability and Bioequivalence Studies Submitted in NDAs or INDs — General Considerations (May 2014).
- European Medicines Agency. Guideline on the Investigation of Bioequivalence (CPMP/EWP/QWP/1401/98 Rev. 1). London: EMA; 2010.
- IQVIA Institute for Human Data Science. Global Use of Medicines: Outlook through 2025 (June 2021).
- Generic Pharmaceutical Association. Generic Drug Facts — Industry Overview and Economic Impact (2019).
- Rollet P, Lemoine A, Dunoyer M. Sustainable rare diseases business and drug access: no time for misconceptions. Orphanet J Rare Dis 2013;8:109.
- Pharmaceutical R&D expenditure in Europe, USA, China and Japan. Available on: https://www.efpia.eu/publications/data‑center/the‑pharma‑industry‑in‑figures‑economy/rd‑expenditure‑in‑europe‑usa‑china‑and‑japan. (Last accessed in July 21, 2025).
- Orphan designation. Available on: https://www.ema.europa.eu/en/human‑regulatory‑overview/orphan‑designation‑overview. (Last accessed in July 21, 2025).
- Garattini L, Badinella Martini M, Mannucci PM. Pharmaceutical patenting in the European Union: reform or riddance. Intern Emerg Med 2022;17:937–939.
- CPMP/EWP/QWP/1401/98 Rev. 1/ Corr **. Available on: https://www.ema.europa.eu/en/documents/scientific‑guideline/guideline‑investigation‑bioequivalence‑rev1_en.pdf. (Last accessed in July 21, 2025).
- Investigation of bioequivalence – Scientific guideline. Available on: https://www.ema.europa.eu/en/investigation‑bioequivalence‑scientific‑guideline. (Last accessed in July 21, 2025).
- OECD. Pharmaceutical Spending — Trends, Drivers and Policy Responses (Health Policy Studies, 2020).
- IMS Health. Medicines Use and Spending in the US: A Review of 2023 and Outlook to 2027 (2024).
- Association for Accessible Medicines. The U.S. Generic & Biosimilar Medicines Savings Report. Washington, D.C.: AAM, září 2024. Dostupné z: https://accessiblemeds.org/…pdf.