Gliptiny v rukou praktických lékařů

Paralelně s letošní výroční konferencí praktických lékařů proběhlo i setkání zaměřené na léčbu diabetu 2. typu v primární péči. Prof. MUDr. Zdeněk Rušavý, Ph.D., z I. interní kliniky LF UK a FN Plzeň zde hovořil především o gliptinech a o tom, kde je místo této mimořádně bezpečné lékové skupiny v terapeutickém algoritmu. Tento seminář podpořila společnost STADA.
Profesor Rušavý nejprve připomněl, že diabetes mellitus 2. typu představuje komplexní metabolickou poruchu, při které není organismus schopen zpracovávat glukózu jako za fyziologických podmínek. Hlavní roli zde hrají inzulinová rezistence, nedostatek inzulinu a snížený inzulinotropní efekt inkretinů, které jsou zodpovědné zhruba ze 75 procent za normalizaci glykémie postprandiálně. V patogenezi se uplatňuje genetika, obezita, nízká fyzická aktivita, steatóza jater, vlivy zevního prostředí, gestační diabetes v anamnéze.
Následkem těchto mechanismů dochází k rychlému nárůstu hmotnosti, který ústí (mimo jiné) v rozvoj diabetu. „Dá se zjednodušeně říci, že inzulinová rezistence seřídí organismus na nižší spotřebu, ale jedinec jí stejně a jeho hmotnost roste. Toto probíhá zhruba čtyři až pět let před samotným vznikem onemocnění,“ podotkl prof. Rušavý. Pro diabetiky 2. typu je typické i to, že jsou rezistentní k léčbě a ntiobezitiky daleko více než zdraví jedinci. Dalším následkem těchto dějů bývá zvýšené riziko rozvoje steatohepatitidy.
Patofyziologické změny spojené s diabetem se shrnují do tzv. zlověstného oktetu (ominous octet). Podle tohoto konceptu je hyperglykémie výsledkem jednak inzulinové rezistence a jednak dysfunkce beta buněk a na tomto vývoji se podílí osm hlavních činitelů: zvýšený příjem potravy, snížený odběr glukózy, zvýšená lipolýza, zvýšená jaterní produkce glukózy, snížená sekrece inzulinu, snížený inkretinový účinek, zvýšená sekrece glukagonu a zvýšená reabsorpce glukózy (autorem široce citovaného paradigmatu je profesor Ralph DeFronzo z University of Texas, USA).
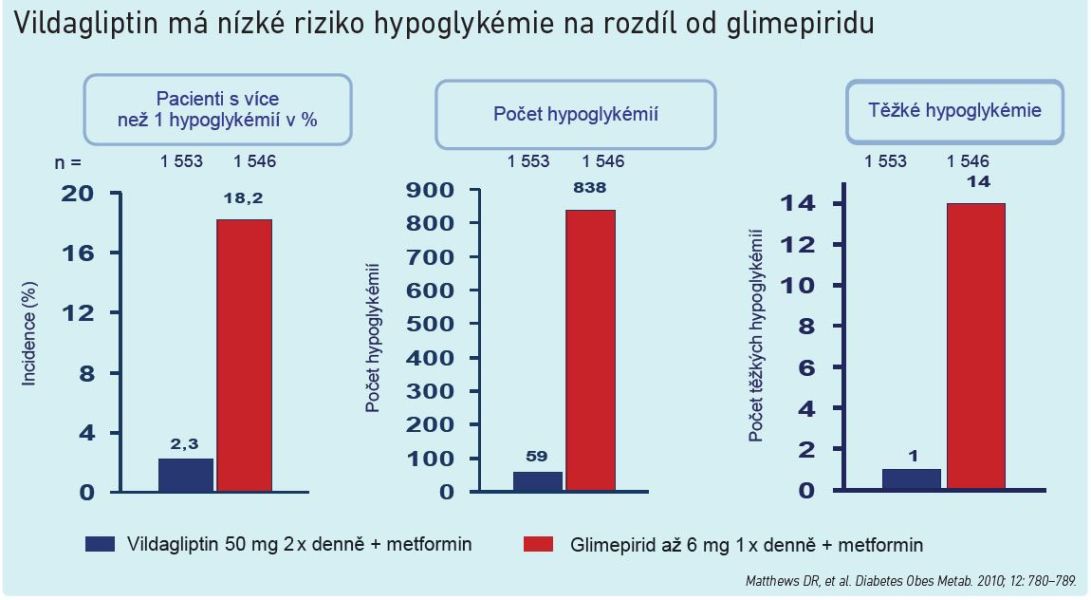
Graf 1
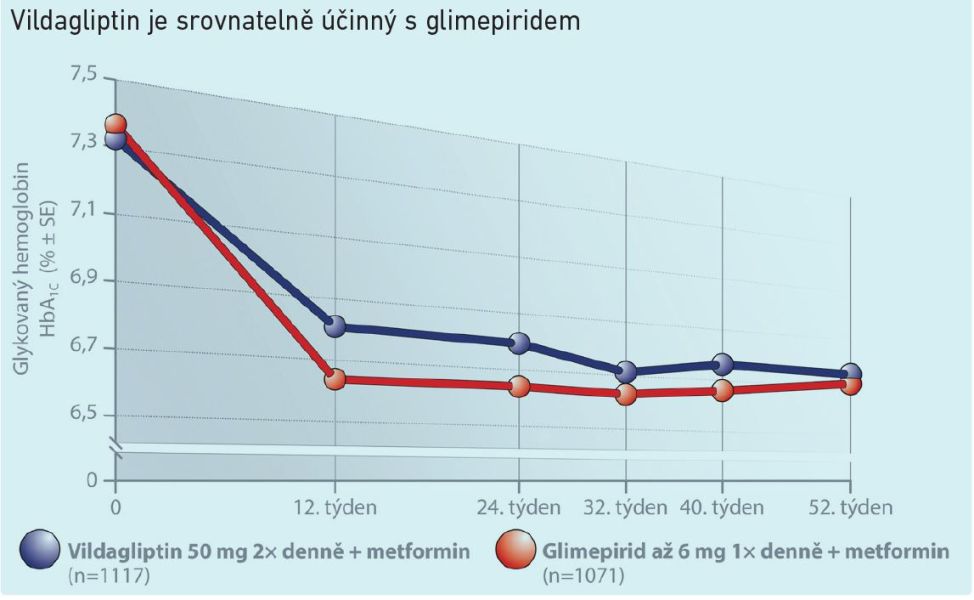
Graf 2
Diabetes 2. typu je součástí metabolického syndromu
Diabetes 2. typu je spolu s arteriální hypertenzí, dyslipidémií, hypercholesterolémií a obezitou součástí metabolického syndromu. Jde přitom o mimořádně silný rizikový faktor.
Cílem léčby diabetu je dosáhnout individuálně stanovených hodnot HbA1c (záleží na věku, očekávané délce života, přítomnosti komorbidit – nádorová onemocnění, stavy po prodělání infarktu myokardu, přítomnosti prokázaných cévních komplikací), neboť s dlouhodobě zvýšenou glykémií jsou spojeny závažné mikrovaskulární i makrovaskulární komplikace. Dalším cílem léčby je eliminace vzniku hypoglykémie, protože hypoglykémie významně zvyšuje kardiovaskulární mortalitu u pacientů s diabetem 2. typu (nejvíce u starších pacientů). V léčbě se snažíme dosáhnout ideálních hodnot plazmatické koncentrace glukózy a zároveň předcházet vzniku hypoglykémie. Také je snaha o co největší snížení LDL cholesterolu (cíl v rozmezí 1,4–1,8 mmol/l), je nutná kontrola a korekce hypertenze (snaha udržet krevní tlak v hodnotách pod 140/90 mm Hg) a dbá se na redukci hmotnosti.
Nefarmakologická terapie spočívá v úpravě diety, pravidelné fyzické aktivitě (aerobního typu alespoň 4× týdně po 30 minut) a s tím spojené redukci hmotnosti, ev. bariatrické operaci (u obézních diabetiků se špatně korigovaným diabetem s BMI nad 35 kg/m2).
Léčba diabetu je velice komplexní záležitost a v posledních letech došlo k významným průlomům v léčbě s příchodem nových, účinnějších léčiv. Jedním ze zásadních zlomů je nástup léků, které ovlivňují inkretiny – hormony produkované střevními buňkami, jejichž tvorba je stimulována příjmem potravy. Tyto působky zvyšují citlivost beta buněk pankreatu k sekrečním podnětům a snižují sekreci glukagonu, čímž snižují výdej glukózy hepatocyty. Zhruba 60 procent sekrece inzulinu postprandiálně je způsobena inkretiny. Rozlišujeme dva základní inkretiny – GLP‑1 (= glucagon‑like peptide 1) a GIP (= glucose‑dependent insulinotropic polypeptide nebo také gastric inhibitory polypeptide).
GLP‑1 je produkován L buňkami střev. Jeho koncentrace je za bazálních podmínek nízká, ale roste postprandiálně. Jeho poločas je krátký, zhruba mezi 2 až 7 minutami, jeho degradace probíhá pomocí enzymu dipeptidyl‑peptidázy IV (DPP‑IV). GLP‑1 zvyšuje produkci inzulinu a snižuje sekreci glukagonu, jeho prostřednictvím dochází ke zlepšení inzulinové senzitivity v příčně pruhovaném svalstvu a snižuje uvolňování glukózy z jater (u diabetiků 2. typu je zvýšená produkce glukózy v játrech). Další pozitivní vliv má na zvýšení srdečního výdeje, působí kardioprotektivně a neuroprotektivně. Dochází i ke snížení chuti k jídlu, zpomaluje vyprazdňování žaludku, zvyšuje proliferaci beta buněk pankreatu a snižuje jejich apoptózu, čímž zasahuje do negativního vývoje diabetu 2. typu. Právě pro tento efekt se odlišují od ostatních PAD, neboť právě úbytek účinných beta buněk pankreatu je důvodem postupné progrese tohoto onemocnění.
U diabetiků 2. typu je prokázán snížený inkretinový efekt (postprandiální vzestup GLP‑1 je nižší a je zde snížená citlivost beta buněk pankreatu na účinky GLP‑1 i GIP), proto se hledal způsob, jak tento deficit nahradit. V diabetologii jsou nyní široce využívány dvě lékové skupiny, které na inktreti ny cílí. První z nich jsou agonisté GLP‑1 (např. liraglutid, exenatid, nověji pak semaglutid, exenatid) a inkretinová analoga.
Druhou takto zaměřenou skupinou jsou gliptiny. Jedná se o kompetitivní antagonisty DPP‑IV, které se váží na aktivní místo molekuly DPP‑IV, tím dochází k jejich deaktivaci a prodloužení poločasu rozpadu inkretinů. Vazba je reverzibilní. Tímto mechanismem dochází k restituci fyziologické koncentrace inkretinů – inhibují degradaci GLP‑1 a prodlužují dobu jeho účinku – dochází k restituci fyziologického stavu. Výsledkem je zvýšení sekrece inzulinu a snížení sekrece glukagonu. Tento mechanismus ovlivňuje glykémii nalačno i postprandiálně. Gliptiny jako první perorální antidiabetika mají vliv na postupné zhoršování funkce beta buněk pankreatu – dochází ke zpomalení poklesu aktivity těchto buněk. Známe a aktivně používáme pět molekul gliptinů – sitagliptin, vildagliptin, saxagliptin, linagliptin, alogliptin. Gliptiny se používají jako druhé antidiabetikum při intenzifikaci léčby (při nedostatečné kompenzaci diabetu samotným metforminem) či jako lék první volby při nesnášenlivosti metforminu. Kombinovat je však lze i se všemi ostatními antidiabetiky (včetně inzulinu).
Efekt léčby gliptiny se projeví u pacientů se zvýšenou glykémií již zmíněným navýšením sekrece inzulinu a snížením sekrece glukagonu. V okamžiku, kdy se hodnoty glykémie dostávají na úroveň blízkou normě, se ale situace obrátí a začne se zvyšovat sekrece glukagonu a snižovat sekrece inzulinu. Právě to do značné míry vymezuje gliptiny oproti ostatním antidiabetikům. „Tento mechanismus snižuje koncentraci glukózy na normu a dále již ne. Riziko vzniku hypoglykémie je při podávání inhibitorů DPP‑IV stejné jako při podávání placeba a výrazně nižší než u derivátů sulfonylurey,“ uvedl prof. Rušavý (viz graf 1).
Osvědčené gliptiny
Gliptiny jsou lety osvědčené léky – sitagliptin byl v Evropě schválen v roce 2007, vildagliptin v roce 2008 (vývoj vildagliptinu probíhal již od roku 1998).
Primoterapie vildagliptinem byla hodnocena v prospektivní, randomizované, placebem kontrolované studii probíhající v roce 2006. Jednalo se o monoterapii u pacientů s diabetem 2. typu, kteří byli nedostatečně kompenzováni režimovými opatřeními. Pokud jde o kontrolu glykémie, byl výsledek srovnatelný s pacienty užívajícími deriváty sulfonylurey (viz graf 2). S využitím gliptinu je to ale mnohem fyziologičtější a bezpečnější způsob, jak se normoglykémii přiblížit.
Mezi přednosti podávání sitagliptinu a vildagliptinu patří minimum nežádoucích účinků – jejich incidence je zhruba srovnatelná s placebem. Nemají téměř žádné lékové interakce, proto se hodí do kombinační terapie. Riziko rozvoje vzniku hypoglykémie mají shodné s placebem. Efekt léčby je závislý na glykémii = jsou glukózodependentní. V porovnání s glimepiridem nepodporují přírůstek tělesné hmotnosti, jsou k hmotnosti indiferentní. Jejich doporučené podávání je 1× či 2× denně (v kombinaci s metforminem), což napomáhá adherenci pacientů k léčbě. Doporučená denní dávka je 100 mg sitagliptinu či vildagliptinu, při renální insuficienci je doporučena redukce dávky na 50 mg za den. Sitagliptin je nejdéle používaný lék s možností podávat perorálně 1× denně. Všechny tyto vlastnosti výrazně přispívají ke compliance pacientů k léčbě. Kombinace s metforminem je výhodná u pacientů, kteří nemají kontraindikaci k podávání těchto léčiv, neboť vede k velmi dobré korekci vysoké plazmatické koncentrace glukózy bez většího rizika vzniku hypoglykémie a s tím spojených komplikací. Do dvojkombinace jsou indikovány všechny inhibitory DPP‑IV.
Vildagliptin musí být užíván 2× denně, ideálně ve fixní kombinaci s metforminem. Fixní kombinace nezvyšuje počet podávaných tablet a má synergický a komplementární efekt – výsledný efekt na kompenzaci diabetu je vyšší než pouhý součet efektů v monoterapii. Gliptiny jsou indikovány jako první antidiabetikum při manifestaci diabetu 2. typu a současné nesnášenlivosti na metformin. Dále jsou indikovány jako druhé antidiabetikum po metforminu – dvojkombinaci je nejlepší zahájit co nejdříve, neboť se tím prodlouží doba, po kterou není potřeba nasadit novou léčbu.