Glomerulární onemocnění v klinické praxi: nemoc minimálních změn, ANCA asociovaná vaskulitida a membranózní nefropatie
Glomerulární onemocnění tvoří skupinu chorob, které postihují převážně glomeruly ledvin a nejčastěji se manifestují buď nefrotickým syndromem (NS), nebo různě rychlým poklesem glomerulární filtrace a (někdy náhodně zjištěným) smíšeným močovým nálezem s variabilně vysokou proteinurií a mikroskopickou hematurií. Typické klinické projevy zahrnují otoky, proteinurii a často hypertenzi. Porucha renálních funkcí může být dlouhou dobu asymptomatická, ale glomerulonefritida může vést i k akutnímu (někdy oligoanurickému) renálnímu selhání. V praxi je zásadní na tyto příznaky pomýšlet a včas pacienta odeslat k podrobnému nefrologickému vyšetření, nefrolog pak případně indikuje renální biopsii. Správná a včasná diagnóza glomerulárního onemocnění umožňuje zahájit cílenou léčbu, která může zabránit rozvoji život ohrožujících komplikací a/nebo selhání ledvin.
Následující článek přibližuje problematiku glomerulárních nemocí formou tří kazuistik z klinické praxe. Jedná se o pacienty s různými typy glomerulárního postižení: (1) nemoc minimálních změn (minimal change disease, MCD) manifestující se kortikodependentním nefrotickým syndromem (NS), (2) ANCA asociovaná vaskulitida – konkrétně mikroskopická polyangiitida (ANCA jsou autoprotilátky namířené proti cytoplazmatickým antigenům neutrofilů) s těžkým renálním i plicním postižením a (3) primární membranózní nefropatie provázená těžkým nefrotickým syndromem. U každé kazuistiky je stručně popsán klinický průběh s léčbou a následně připojen komentář shrnující doporučený postup a hlavní poznatky.
Kazuistika 1: Pacientka s nemocí minimálních změn a kortikodependentním nefrotickým syndromem – úspěšná léčba rituximabem
Pacientka byla odeslána poprvé k nefrologickému vyšetření ve svých 19 letech pro několik týdnů narůstající otoky kolem očí a dolních končetin. Laboratorně byla zjištěna těžká proteinurie (8 g/24 h), hypoalbuminemie (20 g/l) a elevace hodnot cholesterolu, což splňovalo definici nefrotického syndromu. Renální funkce byly v normě (kreatinin 70 µmol/l). Byla provedena renální biopsie s prakticky normálním nálezem ve světelné mikroskopii a kombinací klinicko‑patologického nálezu byla u pacientky diagnostikována nemoc minimálních změn. Byla zahájena kortikoterapie prednisonem v dávce 60 mg denně (1 mg/kg/den). Již po třech týdnech došlo k vymizení otoků a úpravě proteinurie (kompletní remise). Kortikoterapie byla postupně redukována. Při poklesu dávky prednisonu pod 10 mg denně však došlo k relapsu – pacientka opět vykazovala výraznou (nefrotickou) proteinurii a otoky. Dávka kortikoidů musela být opět navýšena pro dosažení remise. V následujících 12 měsících prodělala celkem 2 relapsy nefrotického syndromu při pokusu o snížení dávek či vysazení kortikoidů. Tento průběh odpovídal kortikodependentnímu nefrotickému syndromu. Proto bylo přistoupeno k nasazení rituximabu (RTX). Pacientka absolvovala dvě infuze RTX (dávka 1 g) v odstupu 14 dnů. Léčba byla dobře tolerována, bez závažných nežádoucích účinků. Během několika týdnů od podání RTX se podařilo vysadit kortikosteroidy a pacientka zůstala v kompletní remisi, zcela bez proteinurie. Při roční kontrolní návštěvě byla nadále v remisi, bez nutnosti užívání kortikoidů či jiných imunosupresiv.
Komentář: Nemoc minimálních změn je nejčastější příčinou nefrotického syndromu u dětí, vyskytuje se ale i u dospělých pacientů. Pro MCD je typický rychlý nástup těžkého nefrotického syndromu a velmi dobrá odpověď na kortikosteroidy – většina nemocných dosáhne rychlé remise, jako tomu bylo u naší pacientky. Problémem však mohou být relapsy při pokusu o snížení dávky či vysazení kortikoterapie (kortikodependence). Opakované cykly vysokých dávek kortikoidů s sebou nesou riziko závažných nežádoucích účinků (cushingoidní habitus, obezita, hypertenze, osteoporóza apod.). U pacientů s častými relapsy či kortikodependencí se proto využívá tzv. steroid‑šetřící imunosupresivní léčba. Mezi možnosti patří podání kalcineurinových inhibitorů (cyklosporin, takrolimus), eventuálně mykofenolát mofetilu či dnes již zcela výjimečně alkylačních cytostatik (cyklofosfamid). V současnosti se stále častěji u těchto pacientů využívá také RTX. Rituximab je chimérická monoklonální protilátka proti CD20 antigenům B lymfocytů, která deplecí B buněk tlumí patologickou autoimunitu. Představuje účinnou a poměrně bezpečnou léčbu, která výrazně snižuje nutnost opakovaného či protrahovaného užívání kortikoterapie, a tím omezuje její nežádoucí účinky u pacientů s MCD. V nedávné době byly u MCD objeveny nové protilátky namířené proti nefrinu (součást podocytů v glomerulech), které zřejmě hrají roli v patogenezi tohoto onemocnění a vysvětlují dříve popsaný dobrý efekt RTX u této diagnózy.
Kazuistika 2: Pacient s ANCA asociovanou vaskulitidou (mikroskopická polyangiitida) s renálním a plicním postižením, dialyzovaný
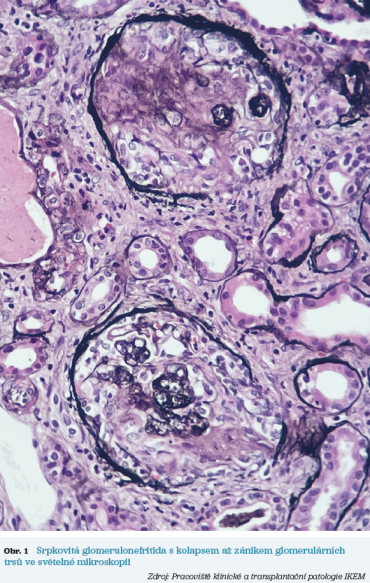 Pacient, 65 let, byl přijat na interní oddělení pro subakutně vzniklou dušnost a opakované vykašlávání krve. V posledních dvou měsících pozoroval únavu, hubnutí a zvýšené teploty. Při přijetí měl známky respirační insuficience (nativní saturace O2 88 %) a současně výrazné periferní otoky. Laboratorně byla zjištěna pokročilá renální insuficience (kreatinin 620 µmol/l, urea 30 mmol/l) s aktivním močovým nálezem (proteinurie 1,5 g/24 h, mikroskopická hematurie) a zvýšené hodnoty zánětlivých parametrů (CRP 113 mg/l, leukocyty 12 × 109/l). Na rentgenu plic byly patrné infiltráty oboustranně. Pacient byl zajištěn oxygenoterapií, empiricky antibiotiky a byla indikována akutní hemodialýza. Následné nativní CT (výpočetní tomografie) vyšetření plic doložilo obraz difuzní alveolární hemoragie. Pro velmi suspektní pulmorenální syndrom byla odebrána imunologie (ANCA a anti‑GBM protilátky) a v séru byly průkazné ANCA protilátky (anti‑neutrophil cytoplasmatic antibodies) typu anti‑MPO (protilátky proti myeloperoxidáze) ve vysokém titru, což vedlo ke stanovení diagnózy ANCA asociované vaskulitidy s plicním a renálním postižením – podtyp mikroskopická polyangiitida. Byla proto zahájena intenzivní imunosupresivní léčba: intravenózní methylprednisolon (3 pulzní dávky 1 g, 500 mg a 500 mg) s následným převodem na perorální prednison a intravenózní cyklofosfamid (pulz 10 mg/kg – dávka byla redukována s ohledem na věk a renální funkce). Současně bylo provedeno 7 cyklů terapeutické plazmaferézy (výměnných výměn plazmy) vzhledem k renálnímu selhání i závažné plicní manifestaci s hyposaturací. Později byla doplněna i renální biopsie, která potvrdila srpkovitou pauci‑imunitní glomerulonefritidu, typickou pro ANCA asociovanou vaskulitidu (obr. 1). Zároveň byla ale přítomna již pokročilá fibróza intersticia, svědčící pro déletrvající proces. U pacienta postupně došlo k ústupu hemoptýzy a k úpravě respirační insuficience; zobrazovací nález na plicích se prakticky znormalizoval. Renální funkce se však ani po několika týdnech nezlepšily a pacient zůstal závislý na chronické hemodialýze. V dalším průběhu byl převeden na udržovací terapii nízkou dávkou kortikoidů a azathioprinem k prevenci relapsu vaskulitidy, zůstává však dependentní na chronické hemodialýze a v současnosti se připravuje na čekací listinu k transplantaci ledviny od zemřelého dárce.
Pacient, 65 let, byl přijat na interní oddělení pro subakutně vzniklou dušnost a opakované vykašlávání krve. V posledních dvou měsících pozoroval únavu, hubnutí a zvýšené teploty. Při přijetí měl známky respirační insuficience (nativní saturace O2 88 %) a současně výrazné periferní otoky. Laboratorně byla zjištěna pokročilá renální insuficience (kreatinin 620 µmol/l, urea 30 mmol/l) s aktivním močovým nálezem (proteinurie 1,5 g/24 h, mikroskopická hematurie) a zvýšené hodnoty zánětlivých parametrů (CRP 113 mg/l, leukocyty 12 × 109/l). Na rentgenu plic byly patrné infiltráty oboustranně. Pacient byl zajištěn oxygenoterapií, empiricky antibiotiky a byla indikována akutní hemodialýza. Následné nativní CT (výpočetní tomografie) vyšetření plic doložilo obraz difuzní alveolární hemoragie. Pro velmi suspektní pulmorenální syndrom byla odebrána imunologie (ANCA a anti‑GBM protilátky) a v séru byly průkazné ANCA protilátky (anti‑neutrophil cytoplasmatic antibodies) typu anti‑MPO (protilátky proti myeloperoxidáze) ve vysokém titru, což vedlo ke stanovení diagnózy ANCA asociované vaskulitidy s plicním a renálním postižením – podtyp mikroskopická polyangiitida. Byla proto zahájena intenzivní imunosupresivní léčba: intravenózní methylprednisolon (3 pulzní dávky 1 g, 500 mg a 500 mg) s následným převodem na perorální prednison a intravenózní cyklofosfamid (pulz 10 mg/kg – dávka byla redukována s ohledem na věk a renální funkce). Současně bylo provedeno 7 cyklů terapeutické plazmaferézy (výměnných výměn plazmy) vzhledem k renálnímu selhání i závažné plicní manifestaci s hyposaturací. Později byla doplněna i renální biopsie, která potvrdila srpkovitou pauci‑imunitní glomerulonefritidu, typickou pro ANCA asociovanou vaskulitidu (obr. 1). Zároveň byla ale přítomna již pokročilá fibróza intersticia, svědčící pro déletrvající proces. U pacienta postupně došlo k ústupu hemoptýzy a k úpravě respirační insuficience; zobrazovací nález na plicích se prakticky znormalizoval. Renální funkce se však ani po několika týdnech nezlepšily a pacient zůstal závislý na chronické hemodialýze. V dalším průběhu byl převeden na udržovací terapii nízkou dávkou kortikoidů a azathioprinem k prevenci relapsu vaskulitidy, zůstává však dependentní na chronické hemodialýze a v současnosti se připravuje na čekací listinu k transplantaci ledviny od zemřelého dárce.
 Komentář: ANCA asociované vaskulitidy (včetně mikroskopické polyangiitidy) patří mezi vzácná závažná systémová zánětlivá onemocnění malých cév, která často způsobují rychle progredující glomerulonefritidu a mohou postihovat i plíce (alveolitida s krvácením, ale i plicní fibróza). Prognóza neléčené nemoci historicky byla velmi špatná, avšak při včasné diagnostice a agresivní imunosupresivní léčbě lze dnes dosáhnout klinické remise u většiny pacientů. Základem indukční terapie je kombinace vysokých dávek kortikosteroidů a buď cytotoxické léčby – cyklofosfamidu, nebo léčby biologické v podobě rituximabu. Cyklofosfamid byl standardem léčby po desítky let, RTX byl do praxe nově zaveden na základě studií prokazujících jeho minimálně srovnatelnou účinnost v navození remise ANCA vaskulitidy zejména v posledních 10 letech. Podání RTX je preferováno například u opakovaných relapsů nebo u mladších pacientů (šetrnější z hlediska fertility apod.), či naopak u starších fragilních pacientů. Dříve se u pacientů s těžkým renálním postižením či plicním krvácením často přistupovalo k terapeutické plazmaferéze. Podle výsledků nedávné velké studie PEXIVAS však přidání plazmaferéz u pacientů s ANCA asociovanou vaskulitidou nevedlo ke zlepšení renálních ani celkových výsledků nemocných, dle současných doporučení proto není použití plazmaferézy u ANCA asociované vaskulitidy doporučováno tak široce jako dříve, výjimkou jsou případy současného výskytu anti‑GBM protilátek (tedy při překryvném syndromu s anti‑GBM neboli Goodpastureovou nemocí), ale stále se doporučuje zvážit přidání plazmaferéz u rychle progredující glomerulonefritidy a také u pacientů se závažným plicním krvácením s hypoxemií. Po dosažení remise aktivního onemocnění (vymizení příznaků, stabilizace renálních funkcí, negativizace ANCA protilátek) je obvykle nasazována dlouhodobá udržovací léčba k prevenci relapsů. Standardem je pokračování v podávání nízkých dávek kortikoidů a přidání azathioprinu nebo pravidelné podávání RTX (v intervalu obvykle à 6 měsíců) po dobu alespoň 18–24 měsíců. I po ukončení udržovací několikaleté léčby je relaps onemocnění možný a u pacientů s trvale postiženou funkcí ledvin (dialyzovaných) může komplikovat případnou transplantaci ledviny.
Komentář: ANCA asociované vaskulitidy (včetně mikroskopické polyangiitidy) patří mezi vzácná závažná systémová zánětlivá onemocnění malých cév, která často způsobují rychle progredující glomerulonefritidu a mohou postihovat i plíce (alveolitida s krvácením, ale i plicní fibróza). Prognóza neléčené nemoci historicky byla velmi špatná, avšak při včasné diagnostice a agresivní imunosupresivní léčbě lze dnes dosáhnout klinické remise u většiny pacientů. Základem indukční terapie je kombinace vysokých dávek kortikosteroidů a buď cytotoxické léčby – cyklofosfamidu, nebo léčby biologické v podobě rituximabu. Cyklofosfamid byl standardem léčby po desítky let, RTX byl do praxe nově zaveden na základě studií prokazujících jeho minimálně srovnatelnou účinnost v navození remise ANCA vaskulitidy zejména v posledních 10 letech. Podání RTX je preferováno například u opakovaných relapsů nebo u mladších pacientů (šetrnější z hlediska fertility apod.), či naopak u starších fragilních pacientů. Dříve se u pacientů s těžkým renálním postižením či plicním krvácením často přistupovalo k terapeutické plazmaferéze. Podle výsledků nedávné velké studie PEXIVAS však přidání plazmaferéz u pacientů s ANCA asociovanou vaskulitidou nevedlo ke zlepšení renálních ani celkových výsledků nemocných, dle současných doporučení proto není použití plazmaferézy u ANCA asociované vaskulitidy doporučováno tak široce jako dříve, výjimkou jsou případy současného výskytu anti‑GBM protilátek (tedy při překryvném syndromu s anti‑GBM neboli Goodpastureovou nemocí), ale stále se doporučuje zvážit přidání plazmaferéz u rychle progredující glomerulonefritidy a také u pacientů se závažným plicním krvácením s hypoxemií. Po dosažení remise aktivního onemocnění (vymizení příznaků, stabilizace renálních funkcí, negativizace ANCA protilátek) je obvykle nasazována dlouhodobá udržovací léčba k prevenci relapsů. Standardem je pokračování v podávání nízkých dávek kortikoidů a přidání azathioprinu nebo pravidelné podávání RTX (v intervalu obvykle à 6 měsíců) po dobu alespoň 18–24 měsíců. I po ukončení udržovací několikaleté léčby je relaps onemocnění možný a u pacientů s trvale postiženou funkcí ledvin (dialyzovaných) může komplikovat případnou transplantaci ledviny.
Kazuistika 3: Pacient s těžkým nefrotickým syndromem při membranózní nefropatii, selhání léčby alkylačními cytostatiky, dosažení remise léčbou rituximabem
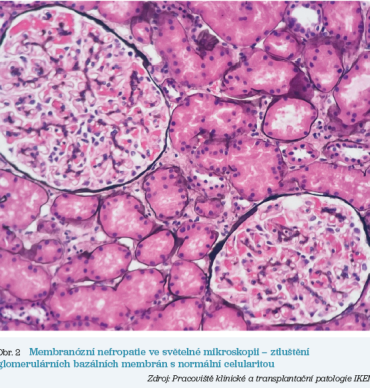
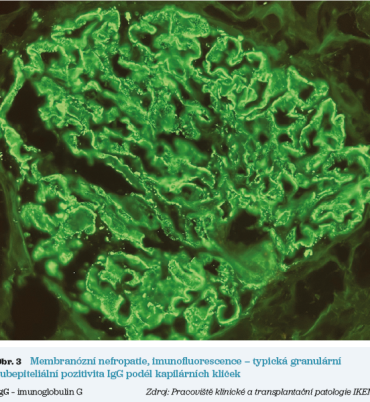 Pacient, 54 let, byl odeslán k nefrologovi pro několik měsíců trvající rozsáhlé otoky dolních končetin, výpotky a hmotnostní přírůstek cca 10 kg. V laboratorních odběrech byla zjištěna výrazná proteinurie (15 g/24 h), hypoalbuminemie (18 g/l), hypercholesterolemie a také elevace hodnot kreatininu na (130 µmol/l) s odhadovanou glomerulární filtrací 0,8 ml/s/1,73 m²). S tímto nálezem byl pacient indikován k renální biopsii, kde byl ve světelné mikroskopii obraz membranózní glomerulopatie (obr. 2) a v imunofluorescenci byla prokázána depozita imunoglobulinu G (IgG) a C3 a PLA2R (receptor fosfolipázy A2) v subepiteliu (obr. 3). V séru byly zároveň přítomny vysoce pozitivní protilátky proti PLA2R. Tento obraz je typický pro primární (autoimunitně podmíněnou) membranózní nefropatii. U pacienta byla zahájena intenzivní diuretická terapie a profylaktická antikoagulace. Současně byl po základním screeningovém vyloučení možné sekundarity (zejm. sérologie hepatitid, ANAb protilátky a onkoscreening: zobrazovací vyšetření břicha a hrudníku, PSA, …) pro vysoké riziko progrese onemocnění indikován k imunosupresivní terapii. V první linii byla zvolena kombinovaná imunosuprese kortikosteroidy a alkylačním cytostatikem chlorambucilem v měsíčních cyklech. Tento režim však nevedl ani po šesti měsících k remisi nefrotického syndromu, a i v séru trvala pozitivita aPLA2R, proto byla shoda na nutnosti změny terapie. Pacient absolvoval dvě infuze rituximabu (po 1 g) v intervalu 14 dnů. Léčba byla bez komplikací. Postupně v průběhu dalších šesti měsíců došlo k poklesu proteinurie na 3 g/24 h (částečná remise), po půlroce byla podána ještě udržovací dávka RTX (1 g) a po jednom roce od podání RTX dosáhl pacient kompletní remise nefrotického syndromu (proteinurie < 0,3 g/24 h, normalizace hodnot albuminu). Koncentrace anti‑PLA2R protilátek v séru poklesla na negativní hodnoty. Nyní je pacient bez klinických známek nefrotického syndromu, pokračuje v renoprotektivní terapii inhibitory renin‑angiotenzin‑aldosteronového systému (RAAS) a gliflozinem, přičemž je dlouhodobě sledován.
Pacient, 54 let, byl odeslán k nefrologovi pro několik měsíců trvající rozsáhlé otoky dolních končetin, výpotky a hmotnostní přírůstek cca 10 kg. V laboratorních odběrech byla zjištěna výrazná proteinurie (15 g/24 h), hypoalbuminemie (18 g/l), hypercholesterolemie a také elevace hodnot kreatininu na (130 µmol/l) s odhadovanou glomerulární filtrací 0,8 ml/s/1,73 m²). S tímto nálezem byl pacient indikován k renální biopsii, kde byl ve světelné mikroskopii obraz membranózní glomerulopatie (obr. 2) a v imunofluorescenci byla prokázána depozita imunoglobulinu G (IgG) a C3 a PLA2R (receptor fosfolipázy A2) v subepiteliu (obr. 3). V séru byly zároveň přítomny vysoce pozitivní protilátky proti PLA2R. Tento obraz je typický pro primární (autoimunitně podmíněnou) membranózní nefropatii. U pacienta byla zahájena intenzivní diuretická terapie a profylaktická antikoagulace. Současně byl po základním screeningovém vyloučení možné sekundarity (zejm. sérologie hepatitid, ANAb protilátky a onkoscreening: zobrazovací vyšetření břicha a hrudníku, PSA, …) pro vysoké riziko progrese onemocnění indikován k imunosupresivní terapii. V první linii byla zvolena kombinovaná imunosuprese kortikosteroidy a alkylačním cytostatikem chlorambucilem v měsíčních cyklech. Tento režim však nevedl ani po šesti měsících k remisi nefrotického syndromu, a i v séru trvala pozitivita aPLA2R, proto byla shoda na nutnosti změny terapie. Pacient absolvoval dvě infuze rituximabu (po 1 g) v intervalu 14 dnů. Léčba byla bez komplikací. Postupně v průběhu dalších šesti měsíců došlo k poklesu proteinurie na 3 g/24 h (částečná remise), po půlroce byla podána ještě udržovací dávka RTX (1 g) a po jednom roce od podání RTX dosáhl pacient kompletní remise nefrotického syndromu (proteinurie < 0,3 g/24 h, normalizace hodnot albuminu). Koncentrace anti‑PLA2R protilátek v séru poklesla na negativní hodnoty. Nyní je pacient bez klinických známek nefrotického syndromu, pokračuje v renoprotektivní terapii inhibitory renin‑angiotenzin‑aldosteronového systému (RAAS) a gliflozinem, přičemž je dlouhodobě sledován.
Komentář: Membranózní nefropatie je jednou z nejčastějších příčin nefrotického syndromu u dospělých. Ve většině případů jde o primární (idiopatické) onemocnění spojené s autoprotilátkami proti podocytárním antigenům (nejčastěji receptoru fosfolipázy A2 – PLA2R), méně často je sekundární při jiné chorobě (SLE, hepatitida B, nádorová onemocnění aj.). Zásadní je kromě imunosupresivní terapie také léčba podpůrná – dieta s omezením příjmu soli, podávání diuretik), blokáda systému RAAS ke snížení proteinurie a krevního tlaku, antikoagulační profylaxe u těžkého nefrotického syndromu k prevenci tromboembolických a případně i renoprotekce glifloziny. Indikace specifické imunosupresivní léčby závisí na odhadovaném riziku progrese (zejména dle množství proteinurie a poklesu glomerulární filtrace). U pacientů s vysokým rizikem (přetrvávající nefrotická proteinurie, pokles renálních funkcí) je doporučena aktivní léčba. Tradiční léčebný protokol u primární membranózní nefropatie představuje střídavé podávání vysokých dávek kortikoidů a alkylačních cytostatik po dobu šesti měsíců. Tento režim (původně s chlorambucilem, v současnosti spíše s cyklofosfamidem) může dosáhnout remise u značné části nemocných, avšak je zatížen významnou toxicitou (myelosuprese, infekce, riziko sekundárních malignit). U našeho pacienta nevedla léčba alkylačním cytostatikem ke zlepšení, což se v praxi stává zejména u případů s velmi vysokou proteinurií. Léčebnou variantou u pacientů s touto diagnózou jsou také inhibitory kalcineurinu (cyklosporin, takrolimus). Novější terapeutickou možností v léčbě membranózní nefropatie je rituximab. Studie MENTOR publikovaná v New England Journal of Medicine v roce 2019 prokázala, že RTX není méně účinný než kalcineurinový inhibitor cyklosporin v dosažení alespoň částečné remise, a navíc byl superiorní v udržení dlouhodobé remise proteinurie. Rituximab má zároveň příznivější profil nežádoucích účinků než klasická cytostatika a v aktuálních doporučeních KDIGO (Kidney Disease: Improving Global Outcomes) je uváděn jako lék první volby u membranózní nefropatie se středním a vysokým rizikem progrese. U našeho pacienta vedlo podání RTX k postupné normalizaci laboratorních parametrů a ke kompletní úpravě nefrotického syndromu. Při hodnocení aktivity onemocnění lze využít i sledování titru anti‑PLA2R protilátek, jejichž vymizení (jako v našem případě) obvykle předchází klinické remisi. Tato kazuistika ilustruje význam rituximabu jako účinné a bezpečné léčby u nemocných s membranózní nefropatií, zvláště pokud selžou nebo nejsou vhodné konvenční postupy.
Závěr
Glomerulární onemocnění patří k důležitým příčinám závažných renálních syndromů (nefrotického syndromu, rychle progredující glomerulonefritidy) v klinické praxi. Klíčové je na ně včas pomýšlet při nálezu proteinurie, hematurie, nevysvětlitelných otoků či zhoršení renálních funkcí a pacienta odeslat ke specialistovi. Glomerulární onemocnění může být i příčinou rozvoje hypertenze u jinak zdravých mladých nemocných. Včasná diagnostika (nejčastěji pomocí renální biopsie) a nasazení cílené léčby mohou významně zlepšit prognózu pacientů.
Kazuistiky ukázaly tři různé typy glomerulárních chorob a jejich léčbu. U pacientky s nemocí minimálních změn vedlo podání rituximabu k dlouhodobé remisi a umožnilo vysazení kortikoidů u kortikodependentního průběhu. V případě ANCA asociované vaskulitidy s postižením ledvin a plic byla nutná rychlá agresivní imunosuprese. Ačkoliv k reparaci renální funkce bohužel nakonec nedošlo, podařilo se zvládnout život ohrožující plicní projevy. U pacienta s membranózní nefropatií těžký nefrotický syndrom nereagoval na klasickou terapii alkylačním cytostatikem, avšak rituximab přinesl kompletní remisi onemocnění v souladu s aktuálními doporučeními.
Tyto případy demonstrují přínos nových léčebných možností v nefrologii, zvláště využití biologické terapie u vybraných glomerulárních onemocnění. Z pohledu lékaře se specializací v jiném oboru je podstatné na tato onemocnění pomýšlet, zajistit včasný odborný management a uvědomit si, že i těžké glomerulární choroby lze dnes účinně léčit a dosáhnout u pacientů plné remise.
MUDr. Marek Mysliveček,
doc. MUDr. Zdenka Hrušková, Ph.D.,
prof. MUDr. Vladimír Tesař, DrSc., MBA, FERA, FASN
Klinika nefrologie 1. LF UK a VFN v Praze
MUDr. Marek Kollár, Ph.D.
Pracoviště klinické a transplantační patologie, Institut klinické a experimentální medicíny, Praha
Korespondenční adresa: marek.myslivecek@vfn.cz
Literatura
- Fervenza FC, Appel GB, Barbour SJ, et al. Rituximab or Cyclosporine in the Treatment of Membranous Nephropathy. N Engl J Med 2019;381:36–46.
- Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney Int 2021;100(Suppl 4):S1–S276.
- Stone JH, Merkel PA, Spiera R, et al. Rituximab versus Cyclophosphamide in ANCA‑Associated Vasculitis. N Engl J Med 2010;363:221–232.
- Walsh M, Merkel PA, Peh CA, et al. Plasma Exchange and Glucocorticoids in Severe ANCA‑Associated Vasculitis. N Engl J Med 2020;382:622–631.