Guselkumab potvrdil bezpečnost a dlouhodobou účinnost
Inhibitory interleukinu 23 patří k molekulám, kterým byla na letošním 30. kongresu EADV (European Academy of Dermatology and Venereology), uskutečněném virtuálně od 29. září do 2. října, věnována velká pozornost. Mezi látky, jež se ukazují být klíčové nejen v léčbě psoriázy, ale např. i psoriatické artritidy, patří i guselkumab (GUS), kterému bylo věnováno 22 samostatných posterových sdělení. Evropským i americkým regulačním úřadem (EMA, FDA) byl GUS schválen k léčbě dospělých pacientů se středně těžkou až těžkou psoriázou (PsO) a aktivní psoriatickou artritidou (PsA).
Interleukin IL‑23 hraje u obou těchto onemocnění velmi důležitou úlohu. Jedná se o heterodimerní prozánětlivý cytokin, který je tvořen dvěma podjednotkami, p40 (sdílena s IL‑12) a p19. Na druhou jmenovanou podjednotku se specificky váže plně humanizovaná monoklonální protilátka guselkumab, která tak blokuje interakci IL‑23 s cílovým receptorem na povrchu buňky, čímž narušuje signalizaci a aktivaci prozánětlivé cytokinové kaskády.
Účinnost a bezpečnost GUS byla hodnocena v randomizovaných klinických studiích fáze III VOYAGE 1 a VOYAGE 2, na jejichž základě se guselkumab stal prvním registrovaným inhibitorem IL‑23 pro léčbu dospělých pacientů se středně těžkou až těžkou plakovou psoriázou. Vedle pětiletých dat z těchto studií vycházeli autoři na kongresu prezentovaných abstrakt také z analýzy dat klinických hodnocení fáze III DISCOVER‑1 a DISCOVER‑2, kde studie DISCOVER‑1 byla randomizovaná, do týdne 24 placebem kontrolovaná, dvojitě zaslepená studie, která hodnotila podávání guselkumabu pacientům s aktivní psoriatickou artritidou, a to včetně nemocných, kteří byli již v minulosti léčeni inhibitorem TNFα. V prezentovaných datech se pozornost investigátorů zaměřila např. na dlouhodobé udržení dosažených cílů léčby a na bezpečnostní profil guselkumabu.
Guselkumab v léčbě psoriatické artritidy
Účinnost guselkumabu v léčbě axiálních symptomů psoriatické artritidy byla sledována pomocí komponenty BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) a skóre ASDAS (Ankylosing Spondylitis Disease Activity Score). Post hoc analýza studie DISCOVER‑1 & ‑2 naznačila, že GUS může být účinný při zlepšování symptomů axiálních projevů PsA. Proto autoři této práce vyhodnotili účinnost GUS napříč složkami BASDAI a ASDAS pro zlepšení symptomů axiálních projevů u pacientů s aktivní PsA pomocí souhrnných údajů z fáze III. těchto randomizovaných, placebem kontrolovaných studií.
Do studie DISCOVER‑1 & ‑2 byli zapojeni pacienti s aktivní PsA a randomizováni na skupiny se subkutánním GUS 100 mg každé 4 týdny (q4w); GUS 100 mg v týdnu 0, 4 a q8w; nebo PBO q4w w0–20, pak GUS 100 mg q4w od w24. Tyto post hoc analýzy zahrnovaly pacienty identifikované vyšetřovatelem jako pacienty s axiálními příznaky a sakroiliitidou (na základě předchozího rentgenového snímku nebo výsledku magnetické rezonance nebo screeningového rentgenu). skóre BASDAI bylo u těchto pacientů hodnoceno v týdnu 0, 8, 16, 24 a 52. Průměrné skóre BASDAI (0 – „žádné“; 10 – „velmi závažné“) bylo analyzováno pomocí pozorovaných dat. Stanoven byl podíl pacientů dosahujících ≥ 50procentního zlepšení v BASDAI (BASDAI 50) a nízké aktivity onemocnění ASDAS (LDA; < 2,1); pacienti s chybějícími údaji nebo ti, kteří splňovali kritéria selhání léčby (ukončili užívání studovaného léku nebo užívali zakázané léky), byli ve všech následujících hodnoceních považováni za nereagující na léčbu. Navíc axiální cíle byly shrnuty podle výchozího stavu (BL) HLA‑B*27.
Analýzy zahrnovaly celkem 312 pacientů s axiální nemocí (103 GUS q4w, 91 GUS q8w, 118 PBO); celkový poměr skóre BASDAI v týdnu 0 byl 6,4; 6,5, respektive 6,6. Demografické údaje a průměrné skóre komponent BL BASDAI (tj. únava, bolest páteře, bolest kloubů, entezitida, úroveň ranní ztuhlosti) byly podobné napříč léčebnými skupinami. Ve srovnání s celkovou studijní populací měla tato podskupina pacientů vyšší průměrnou koncentraci C‑reaktivního proteinu na BL a vyšší podíl bodů s entezitidou a zahrnovala mírně vyšší podíl mužů. Průměrná výchozí hodnota skóre BASDAI v souboru byla 6,5. Po 24 týdnech došlo u nemocných na guselkumabu k signifikantně výraznějšímu poklesu oproti placebu (–2,7 vs. –1,3), tento efekt přetrvával až do konce sledování v 52. týdnu a nebyl závislý na genotypu HLA‑B27. Zároveň došlo k vylepšení skóre i ve všech subkomponentách BASDAI.
Průměrné skóre pro všech šest složek BASDAI, včetně bolesti páteře, se snížilo v týdnu 24 u pacientů léčených GUS, přičemž rozdíl od PBO byl pozorován již v týdnu 8 a následně docházelo k dalšímu zlepšení nebo udržení až do w52. V týdnu 24 bylo skóre BASDAI 50 (38 % a 40 % vs. 19 %) a ASDAS LDA (35 % a 40 % vs. 16 %) vyšší ve skupinách q4w a q8w vs. PBO. V týdnu 52 bylo průměrné skóre BASDAI u pacientů na PBO, kteří přešli na GUS q4w ve 24. týdnu, podobné pacientům, kteří byli ve skupině s GUS. Podobné trendy byly pozorovány jak u HLA‑B*27+, tak HLA‑B*27 pacientů.
Mezi pacienty s PsA s axiálními symptomy a sakroiliitidou (potvrzeno pomocí zobrazovacích technik vyšetřovatelem) vedla léčba guselkumabem ve studii DISCOVER‑1 & ‑2 k nižším průměrným skóre pro všech šest složek BASDAI a k většímu vylepšení skóre ASDAS ve srovnání s placebem během 24 týdnů léčby, přičemž zlepšení bylo pozorováno již od osmého týdne a bylo udrženo až do týdne 52. Bez ohledu na status HLA‑B*27 došlo díky léčbě guselkumabem k poklesu komponent BASDAI a dosažení ASDAS LDA.
Nízké riziko závažných infekcí
Autoři jednoho z prezentovaných abstrakt potvrdili nízké riziko závažných infekcí a infekcí, které jsou předmětem zájmu, u pacientů s psoriázou léčených guselkumabem po dobu až pěti let. Jak připomínají, některé typy infekcí (např. kandidóza, herpes zoster) jsou častější právě u pacientů s psoriázou než v obecné populaci a léčba středně těžké až těžké formy psoriázy imunomodulační biologickou terapií může riziko závažných infekcí dále zvyšovat. Ve fázi III studií VOYAGE byla porovnávána léčba GUS s placebem (PBO) a adalimumabem (ADA) u pacientů se středně těžkou až těžkou psoriázou. Prezentovaná analýza se zaměřila na riziko specifických nežádoucích účinků (NÚ) souvisejících s infekcí u pacientů léčených GUS po dobu až pěti let (týden 264).
V obou studiích byli pacienti randomizováni na GUS 100 mg v týdnu w0, w4 a q8w; placebo w0, w4 a w12, poté GUS 100 mg w16 a w20, poté q8w; nebo ADA 80 mg w0, 40 mg w1, pak 40 mg q2w. Ve VOYAGE 1 dostávali pacienti ADA q2w až do w47, poté GUS 100 mg w52 a q8w. Ve studii VOYAGE 2 byla u všech pacientů vysazena léčba GUS od w28 do w72; od w76 do konce studie dostali všichni pacienti open‑label GUS q8w. V obou studiích byla poslední dávka GUS podána v týdnu 252 a následně byla v týdnu 264 hodnocena bezpečnost léčby. Souhrnné údaje o bezpečnosti byly analyzovány ve skupině GUS (včetně crossoveru w16 PBO, n = 1 221), skupině ADA → GUS (n = 500) a kombinované skupině GUS (GUS a ADA → GUS, n = 1 721). Výsledky týkající se infekcí zahrnovaly přepočet na 100 pacientoroků (PY) celkově, u závažných a oportunních infekcí (včetně aktivní tuberkulózy) spolu s léčenými nežádoucími účinky (TEAE) infekcí Candida a herpes zoster (viz tabulku).
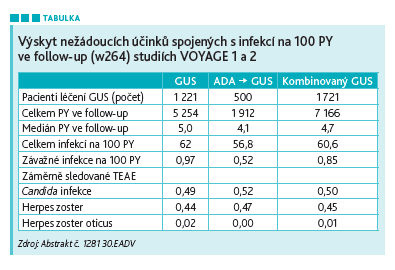
Z celkem 1 721 pacientů léčených GUS dokončilo 78,4 procenta (1 349/1 721) léčbu do 252. týdne (7 166 pacientoroků). Od w0 do w264 byla celková míra infekcí na 100 PY sledování 60,6 v kombinované skupině s GUS. Nejčastěji hlášenými infekcemi zde byly nazofaryngitida (18,5/100 PY) a infekce horních cest dýchacích (11,9/100 PY). Do 264. týdne bylo v této kombinované skupině zaznamenáno na 100 PY 0,85 závažné infekce. Nejčastěji hlášenou závažnou infekcí zde byla celulitida (0,13/100 PY), apendicitida (0,11/100 PY) a pneumonie (0,10/100 PY). Nízká incidence byla u TEAE: Candida a herpes zoster. Žádný pacient nepřerušil studii kvůli výskytu Candida nebo herpes zoster; všechny případy byly vyřešeny v průběhu léčby. Mezi pacienty léčenými GUS nebyly od týdne 0 do týdně 264 hlášeny žádné oportunní infekce ani případy aktivní tuberkulózy.
Bezpečnost guselkumabu byla mezi prvním a pátým rokem sledování konzistentní. Ukázalo se, že guselkumab je tak nejenom účinným, ale i bezpečným nástrojem pro dosažení čisté kůže a zvládnutí projevů aktivní psoriázy. Jak se autoři práce shodli, u pacientů s psoriázou léčených GUS po dobu pěti let byly závažné infekce a infekce související s TEAE, které jsou předmětem zvláštního zájmu, málo časté a jejich výskyt byl podobný nebo nižší než výskyt hlášený u pacientů, kteří dostávali jiné biologické terapie k léčbě středně těžké až těžké psoriázy.
Imunogenicita guselkumabu u pacientů s psoriázou
Rozvoj protilátek proti léku (anti drug antibodies – ADA) může ovlivnit jak účinnost léčby, tak i četnost nežádoucích účinků. Autoři tohoto sdělení se proto zaměřili na posouzení vztahu mezi vývojem ADA v případě guselkumabu a rozsahem klinické odpovědi nebo výskytem reakcí na injekční aplikaci léku (injection‑site reaction – ISR) po dobu pěti let ve studiích VOYAGE 1 a VOYAGE 2 u pacientů se středně těžkou až těžkou psoriázou.
Ve studiích fáze III VOYAGE 1 a 2 byli pacienti randomizováni na GUS, placebo + GUS nebo adalimumab (viz výše). Studie VOYAGE 1 hodnotila kontinuální terapii s přechodem adalimumabu na GUS v 52. týdnu, zatímco VOYAGE 2 hodnotila přerušení léčby během randomizovaného období vysazení/opětovné nasazení (28.–76. týden). Všichni pacienti obdrželi GUS (open‑label) do 252. týdne, počínaje 52. týdnem u VOYAGE 1 a 76. týdnem u VOYAGE 2. Sledován byl výskyt a titry ADA po dobu 265 týdnů u všech pacientů, kteří byli léčeni alespoň jednou dávkou GUS a kteří měli po léčbě hodnotitelné vzorky séra. Sumarizován byl výskyt neutralizačních protilátek (neutralizing antibodies – NAb) proti GUS u pacientů s pozitivní ADA. Podíl pacientů, kteří dosáhli klinické odezvy na léčbu v týdnu 252 nebo u nichž došlo k ISR v týdnu 264, byl hodnocen podle pozitivního/negativního statusu ADA. Klinická odpověď byla definována jako dosažení alespoň 90procentního zlepšení nebo 100procentního zlepšení (PASI 90, respektive PASI 100) a skóre 0/1 (čistá nebo téměř čistá kůže) nebo 0 (kompletně čistá kůže), tedy IGA 0/1, respektive IGA 0.
Ze všech pacientů léčených GUS s hodnotitelnými vzorky bylo v průběhu 264 týdnů ADA pozitivních 14,4 procenta (111/770) pacientů ve studii VOYAGE 1 a 15,5 procenta (146/943) ve VOYAGE 2. V obou studiích byly titry ADA převážně nízké, v 82 procentech ve VOYAGE 1 a 82,2 procenta ve VOYAGE 2 dosahovaly titry ≤ 1 : 160. Pouze u pěti (4,5 %) pacientů s pozitivní ADA ve studii VOYAGE 1 a u osmi (5,5 %) ve VOYAGE 2 došlo k výskytu neutralizačních protilátek. Podíl pacientů, kteří dosáhli téměř čisté (PASI 90 nebo IGA 0/1) nebo zcela čisté kůže (PASI 100 nebo IGA 0), nebyl do 252. týdne ovlivněn vývojem ADA nebo přítomností NAb. Podobně po celé toto období nebyla zaznamenána žádná zjevná souvislost mezi vývojem ADA a vývojem ISR.
Na konci pětiletých studií VOYAGE 1 a VOYAGE 2 s GUS u pacientů s psoriázou byl výskyt ADA zaznamenán u 15 procent pacientů. Z toho jich pět procent mělo protilátky, které byly klasifikovány jako neutralizační, což odpovídá 0,8 procenta všech pacientů léčených guselkumabem. Jak autoři práce zdůraznili, vývoj ADA nebyl spojen se sníženou klinickou účinností nebo zvýšenými ISR. Tyto údaje by ale podle nich měly být interpretovány s opatrností s ohledem na omezený počet pacientů, u nichž do pěti let od zahájení léčby k rozvoji protilátek proti GUS došlo.
Udržení dosaženého PASI po dobu pěti let
Udržení PASI (Psoriasis Area Severity Index) jako výsledek léčby GUS po dobu pěti let u pacientů, kteří dosáhli v terapii absolutní PASI ≤ 2 v 16. týdnu léčby, bylo předmětem dalšího sdělení, jehož data vycházela z fáze III klinické studie VOYAGE 1.
Ve studii VOYAGE 1 bylo randomizováno 837 pacientů (2 : 1 : 2), aby v týdnu 0 a 4 obdrželi 100 mg GUS a pak každých 8 týdnů (q8w; n = 329); PBO v týdnech 0, 4 a 12, poté GUS 100 mg v týdnech 16 a 20, potom q8w (n = 174); nebo adalimumab 80 mg v týdnu 0, 40 mg v týdnu 1 a 40 mg každé dva týdny až do týdne 47, následuje GUS 100 mg v 52. týdnu, poté q8w (n = 334). Pacienti vstoupili do otevřené léčby GUS během týdnů 52 až 252. Absolutní prahové hodnoty PASI 0, ≤ 1, ≤ 2, ≤ 3 a ≤ 5 byly hodnoceny po 252 týdnů u pacientů užívajících GUS, kteří dosáhli absolutního PASI ≤ 2 v 16. týdnu. Účinnost byla hodnocena pomocí NRI (nonresponder imputation) v týdnu 48 (pacienti s chybějícími údaji o účinnosti, bez ohledu na důvod, byli považováni za nereagující na léčbu, stejně jako ti, kteří přerušili klinický program z důvodu nedostatečné účinnosti nebo zhoršení psoriázy nebo užívání léčby psoriázy zakázané protokolem). Počínaje 52. týdnem byla provedena analýza na základě pozorovaných údajů.
Mezi pacienty léčenými GUS, kteří dosáhli absolutního PASI ≤ 2 v 16. týdnu, si 84 procent nebo více udržovalo PASI ≤ 2 do 252. týdne a 54 procent mělo v tomto období PASI 0. V průběhu celého tohoto sledování nebyly zaznamenány žádné obavy ohledně bezpečnosti léčby. Podle autorů této post hoc analýzy lze tedy shrnout, že ve studii VOYAGE 1 mezi pacienty, kteří dosáhli absolutního PASI ≤ 2 v 16. týdnu, bylo při léčbě guselkumabem pozorováno trvalé udržení absolutní odpovědi PASI až do 252. týdne, tedy po dobu pěti let.