Inhibitory protonové pumpy – jsou skutečně tak bezpečné?
Souhrn
Inhibitory protonové pumpy (IPP) jsou jednou z nejčastěji užívaných lékových skupin, je jimi chronicky léčeno více než 10 % dospělé populace, populace zpravidla starší s vysokým rizikem cévního či renálního postižení. Vedle nezpochybnitelné účinnosti v léčbě a v profylaxi gastroenterologických onemocnění spojených s hyperaciditou se prosadily v komedikaci s antitrombotiky ke snížení krvácení do trávicího traktu. V obou těchto indikacích jde o chronickou léčbu, často po dobu více let, registrační studie však prověřovaly bezpečnost IPP pouze při krátkodobém, několikatýdenním podávání. Data získaná v posledních letech při dlouhodobé léčbě IPP však bezpečnost zpochybňují a lékové regulační agentury (EMA či FDA) před neodůvodněným chronickým užíváním IPP varují. Stále častěji se totiž objevují práce, které nacházejí při chronické léčbě IPP vyšší výskyt kardiovaskulárních příhod, renálního selhání, asthma bronchiale i nervového a smyslového postižení. Toto riziko je doloženo nejen při srovnání aplikace IPP proti stavu bez jejich podávání, ale i proti užití blokátorů H2 receptorů. Tedy i v situaci, kdy obě srovnávané skupiny mají podobné postižení trávicího traktu. Příčin nepříznivého dopadu IPP na prognózu je pravděpodobně více, od ovlivnění protonových pump na úrovni buněčných organel po lékové interakce s některými antikoagulancii či s protidestičkovými léky. (Kap Kardiol 2022; 14: 20–29)
Klíčová slova
· inhibitory protonové pumpy · blokátory H2 receptorů · nežádoucí účinky · aterotrombotická onemocnění · kardiovaskulární mortalita · renální selhání
Inhibitory protonové pumpy (IPP) jsou jednou z nejčastěji indikovaných lékových skupin. V České republice je ročně předepsáno asi 300 milionů denních dávek, jedná se zpravidla o chronickou léčbu asi 10 % populace. Vedle klasické indikace, tj. léčby vředové či refluxní gastroduodenální choroby, jsou IPP stále častěji indikovány v profylaxi krvácení při antitrombotické léčbě. Zatímco v gastroenterologické indikaci léčíme převážně populaci s nízkým kardiovaskulárním rizikem, pak při užití IPP jako komedikace k protidestičkové či antikoagulační léčbě léčíme převážně populaci již s významným kardiovaskulárním rizikem. Plošné rozšíření IPP je dáno jejich nepochybnou účinností, snadnou dostupností (v indikaci pyrózy je volný prodej), nízkou cenou a deklarací vysoké bezpečnosti. Jak SPC jednotlivých molekul, tak „velké učebnice farmakologie“ uvádějí dobrou snášenlivost a nízké riziko nežádoucích účinků. Bezpečnost IPP byla dokumentována v „registrační“ dokumentaci, bohužel, tyto práce sledovaly bezpečnost a snášenlivost v průběhu několikatýdenní léčby, nikoli léčby chronické. V posledních letech však přibývá důkazů o vyšší kardiovaskulární morbiditě i mortalitě, o vyšším výskytu klinicky významných nefropatií a renálního selhání či o postižení neurologickém. Tato pozorování by nebyla alarmující, kdyby šlo pouze o srovnání IPP se stavem bez léčby, kdy nepříznivý dopad na prognózu by se dal vysvětlit přítomností postižení trávicího traktu, tedy diagnózy indikující léčbu IPP. Daleko podstatnější však je nález významně vyšší incidence uvedeného postižení v porovnání s alternativní „protivředovou“ léčbou, tj. s blokátory histaminových receptorů H2 (H2R), kdy základní choroba je stejná.
Vlastnosti inhibitorů protonové pumpy
Pro pochopení souvislostí rekapitulujme základní vlastnosti IPP: mechanismus účinku, farmakokinetické a farmakodynamické vlastnosti.
Podmínkou působení IPP, podávaných jako proléčiva, je jejich aktivace v kyselém prostředí, kdy se vytvoří volná sulfhydrilová skupina vážící se přímo na protein žaludeční H+/K+ ATPázy (protonové pumpy), čímž ji ireverzibilně inaktivují. K vlastní aktivaci musí dojít až v sekrečním acinu parietální buňky, kam se dostává IPP z cirkulace. Proto jsou IPP podávány v acidorezistentní formě. K tomu, aby došlo k inaktivaci žaludeční H+/K+ ATPázy, je nutné, aby byla pumpa v aktivním stavu, což je zejména po jídle. Potřebná koncentrace IPP v plazmě, resp. v acinu je krátká, jen 1–2 hodiny. K dosažení optimálního účinku je tak třeba podat léčivo 30–60 minut před jídlem, požití potravy protonové pumpy aktivuje. Tak je zajištěno, že vrcholová koncentrace IPP se kryje s obdobím maximální stimulace pumpy a je umožněna ireverzibilní blokáda co největšího počtu pump. Při podání IPP mimo toto „optimální“ období, např. ad hoc při potížích, je efekt snížen.
Protonová pumpa, čili H+/K+ ATPáza, je transportérem aktivně směňujícím protony za draslíkové kationy. Souhrou s paralelním transportérem (K+/Cl‑ symportem), pumpujícím kationty kalia zpět do buňky a chloridové anionty naopak do acinu, vzniká kyselina chlorovodíková. Po stimulaci protonové pumpy klesá pH v žaludku na hodnoty 1–2. Protonové pumpy nejsou pouze v parietálních buňkách žaludku, ale též v tubulárních buňkách nefronu, v osteoklastech, epiteliích nadvarlete a v lyzosomech všech buněk. Tento typ protonových pump označujeme jako vakuolární H+ ATPázy (V‑ATPázy). Podstatné je, že IPP blokují též funkci pump tohoto typu a řada nežádoucích účinků vyplývá právě z této vlastnosti, tj. působení na úrovni dalších orgánů (tab. 1).
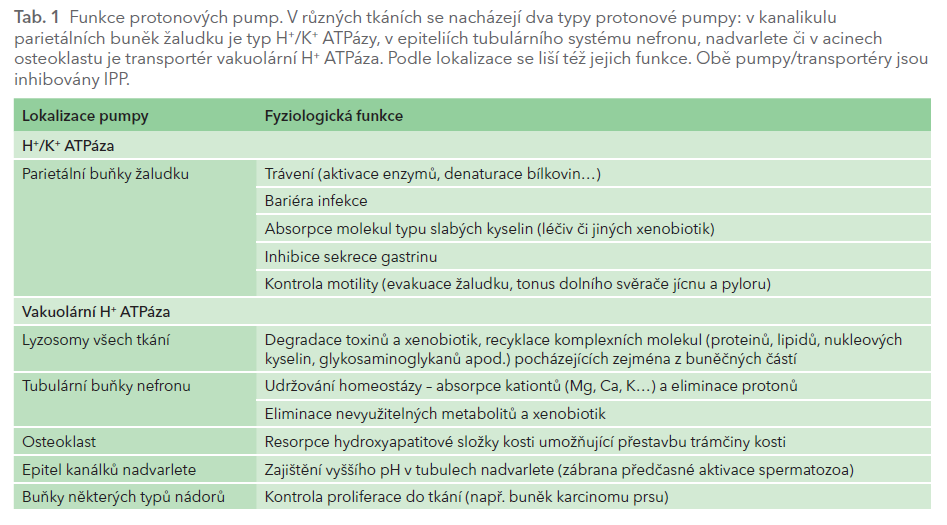
V žaludku má kyselina solná řadu biologických funkcí. Kyselé pH denaturuje proteiny a usnadňuje jejich degradaci, aktivuje trávicí enzymy (zejména pepsinogenu na pepsin), umožňuje absorpci léčiv typu slabých hydrofilních kyselin v neionizovaném stavu (např. kyseliny acetylsalicylové či dabigatran etexilátu) a v neposlední řadě je důležitou obranou před invazí řady patogenních organismů do střev. Vzestup pH (např. při léčbě IPP) má malý efekt na vlastní trávení, snížení aktivity žaludečních enzymů je dostatečně kompenzováno enzymy v nižších etážích traktu. Naopak ztráta prvé bariéry infekce se uplatňuje, riziko infekčních chorob přestupujících do organismu trávicím traktem (např. „cestovatelských průjmů“) je zvýšeno. Stejně tak má význam změna (zpravidla snížení) dostupnosti řady léčiv, minerálů či vitaminů.
Nižší koncentrace protonů v žaludeční šťávě má vliv i na kinetiku žaludku. Vzestup sekrece gastrinu v antrálních G‑buňkách žaludku významně zvýší nejen motilitu žaludku, ale i tonus dolního svěrače jícnu, naopak napětí pyloru klesá. Léčebně využíváme tento účinek v léčbě gastroezofageální refluxní choroby (GERD).
Protonová pumpa typu V‑ATPázy se účastní degradace řady látek v lyzosomech všech buněk organismu. Významná je především v buňkách defenzivních systémů kontrolujících mimo jiné onkogenezi či obranyschopnost proti infekci. V poslední době se stále více zdůrazňuje význam V‑ATPázy v endoteliálních lyzosomech cév. Inhibice její funkce je provázena řadou negativních dějů – akumulací agregátů proteinů, zvýšením oxidačního stresu, endoteliální dysfunkcí, porušenou neoangiogenezí a fibrotizací cévní stěny. Předpokládá se akcelerace aterogeneze, aktivace hemostázy či vývoj nefrosklerózy. Obdobně je V‑ATPáza též v resorpční kavitě osteoklastu, kyselé prostředí pomáhá rozpouštět hydroxyapatit kostní matrix a je podmínkou fyziologické přestavby. Vzhledem k tomu, že přestavba je velmi pomalá, projeví se efekt, tj. degenerace trámčiny s nižší odolností kosti, až po více než pěti letech expozice IPP. Podobně je protonová pumpa typu V‑ATPázy součástí tubulárních transportních kanálů nefronu. Zde ovlivňuje aciditu moči a tím i vylučování celé řady léčiv. Dalším místem, kde má přítomnost protonové pumpy typu V‑ATPázy význam, je epitel hlavy nadvarlete. Ke konečné maturaci spermatozoa je potřeba kyselé prostředí. Jen tak nedojde k předčasné aktivaci ještě nezralé spermie. Vzestup pH v nadvarleti při léčbě IPP může vést k omezení pohyblivosti spermie po ejakulaci a jejich nízké aktivitě při pronikání spermie do oocytu.
Zatím blíže neobjasněným mechanismem inhibují IPP transportní kanál bivalentních kationtů TRPM6/7 v tubulu nefronu a v epiteliích tračníku, při chronické léčbě se tak objevuje deplece magnezia a kalcia. Tyto kationty se pak omezeně vstřebávají a více eliminují. Popsány jsou arytmie při takto navozené depleci, častěji pouze v rámci současné léčbě diuretiky, kdy se efekt na pokles koncentrace zejména magnezia sčítá. Vedle transportéru bivalentních kationtů inhibují IPP též významný biodegradační enzym – oxidázu CYP 2C19, doloženy jsou významné rozdíly mezi molekulami. To vede ke snížené bioaktivaci clopidogrelu (snížení protidestičkového účinku), či naopak ke zpomalené biodegradaci řady antidepresiv s případným toxickým účinkem.
Jak je nastíněno, IPP nejsou jen gastroprotektivy, jejich vliv je širší a jak bude dále ukázáno, jejich nežádoucí účinky vycházejí nejen z trávicího traktu, nejsou omezeny jen na farmakodynamický účinek, ale i na lékové interakce (tab. 2). Ty mají zpravidla charakter omezené absorpce při vzestupu pH v žaludku či interakce na úrovni izoenzymu CYP 2C19.

Klinický význam IPP v jednotlivých indikacích
V indikaci léčby a prevence vředové gastroduodenální či refluxní gastroezofageální choroby není o přínosu IPP pochyb. Stejně tak je tomu v indikaci eradikace helicobacterové infekce. Zde je aplikace IPP omezena na dobu týdnů či měsíců. Navíc populace s tímto typem onemocnění bývá zatížena nižším kardiovaskulárním rizikem, než je tomu u populace s indikací IPP v rámci prevence krvácení při léčbě antitrombotiky. Právě v této situaci, kdy je aplikace IPP dlouhodobá, trvající často roky, je nutno zvážit přínos (redukce hemoragických komplikací) versus riziko (zejména negativní ovlivnění prognózy). Právě tato indikace je v posledním desetiletí dominantní.
V tomto kontextu je významná otázka, jaké jsou důkazy o snížení rizika gastrointestinálního krvácení při komedikaci IPP s antitrombotiky, tj. s duální protidestičkovou léčbou a s antikoagulancii? V této oblasti máme data na úrovni observačních studií i studie randomizované. Pozorovaný pokles rizika krvácení v metaanalýze observačních studií asi o třetinu byl významný. Doložen byl příznivý účinek IPP při komedikaci s duální protidestičkovou léčbou i s antikoagulancii.1,2 Nicméně, při relativně nízkém výskytu krvácení do trávicího traktu je absolutní pokles rizika malý, pohybuje se na úrovni 0,3 %. Pozorovaná hodnota NNT (number need to treat), tedy potřebný počet léčených k dosažení efektu u jednoho z nich, se pohybuje kolem 250, tedy na každých 250 léčených IPP zabráníme jednomu krvácení (zpravidla nikoli kritickému).
Jediná studie – pantoprazolová větev studie COMPASS – byla kontrolovaná, randomizovaná.3 Pacienti léčení v rámci sekundární prevence byli zařazeni do tří větví léčených a) rivaroxabanem (v nižší dávce 2× 5 mg), b) kyselinou acetylsalicylovou aplikovanou v enterosolventní lékové formě v dávce 100 mg (ecASA) a c) kombinací rivaroxabanu (2× 2,5 mg) s ecASA. Polovina ze 17 000 probandů byla léčena též pantoprazolem (40 mg) a polovina dostávala placebo. Během tří až čtyř let trvání studie nebyl nalezen rozdíl ve výskytu gastrointestinálních příhod (primární ukazatel) ve větvi pantroprazolové a placebové (HR 0,88; CI 0,67–1,15). Celkový počet gastrointestinálních příhod byl 1,16 % ve větvi pantoprazolové a 1,32 % ve větvi placebové, rozdíl nebyl významný ani statisticky, ani klinicky. Komedikace IPP s protidestičkovou léčbou, s antikoagulační léčbou či s kombinací obou strategií nevedla ke snížení rizika krvácení, ani k poklesu klinicky významných gastrointestinálních příhod. Z praktického hlediska však nejsou závěry této jediné randomizované studie zobecnitelné a jejich význam je malý. Předně, dávky rivaroxabanu užívané ve studii k sekundární prevenci byly nízké, jen 2× 5 mg, resp. při kombinaci s ASA jen 2× 2,5 mg. Rovněž „protektivní“ enterosolventní léková forma ASA s nedostatečnou dostupností nereprezentovala účinnou léčbu klasickou formou ASA s doloženým efektem. Z tohoto hlediska nelze výsledky přeceňovat. Věrohodnější jsou v tomto případě dvě velké metaanalýzy studií observačních, s daty od více než dvou milionů paciento‑roků. Ta přesvědčivě dokládají, že IPP mírně snižují výskyt významných krvácení do trávicího traktu při léčbě antitrombotiky.
Nežádoucí účinky IPP, které jsou skutečně významné?
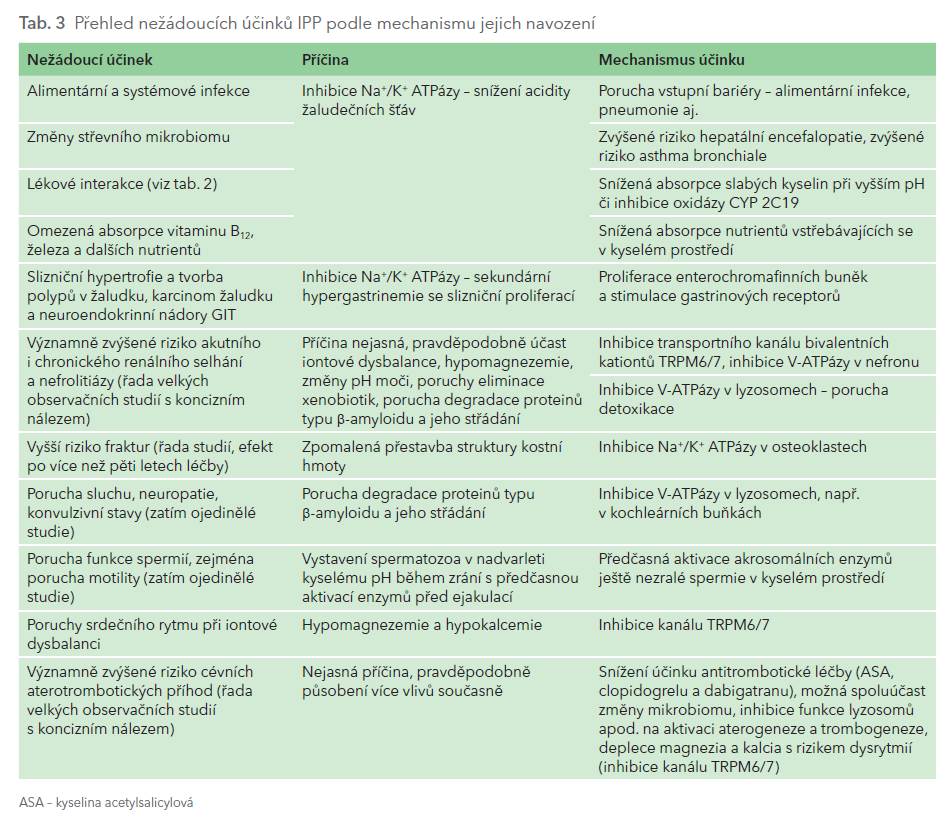
Postupný a sofistikovaný vývoj vedl k určité „dokonalosti“ vyšších forem života. Zásah do integrity fyziologických procesů, např. farmaky, je většinou provázen nežádoucími účinky, často účinky zcela neočekávanými. Jako u ostatních biologicky aktivních léčiv jsou nežádoucí účinky přítomny i při léčbě IPP, významné zejména při léčbě dlouhodobé. Tím, že pokládáme IPP za bezpečná léčiva a řada nežádoucích účinků se objevuje až po více letech, vztah k léčbě nepředpokládáme. Jejich souvislost vyplyne až po analýze desítek tisíc jednotlivých pozorování. Pokud se nám dostane do rukou článek o negativním působení IPP, pokládáme jej za zbytečné „plašení“, resp. za senzacechtivou poplašnou zprávu. A nadále se nerozpakujeme IPP předepsat i v případech, kdy dyspeptického pacienta léčíme jaksi „z rozpaků“, či v případě antitrombotické léčby je podáme i při nižším riziku krvácení. Ač „renomované“ učebnice stále pokládají IPP za skupinu velmi bezpečnou, skutečností je, že se stále častěji objevují práce o významném negativním ovlivnění výskytu kardiovaskulárních, nefrologických a neurologických onemocnění (tab. 3). Položme si tedy nosnou otázku tohoto sdělení: Je profylaxe krvácení IPP bezpečná?
Bezpečnost IPP – trávicí trakt
„Klasické“ nežádoucí účinky IPP vycházející ze základního farmakodynamického účinku, tedy snížení acidity žaludečních šťáv a ztráty první bariéry pro vstup infekce, jsou naštěstí vzácné (viz tab. 3). Prakticky se výrazně častěji setkáváme s alimentárními nákazami typu „cestovatelských“ průjmů či s klostridiovými infekcemi. Aktuálně je zajímavé též zvýšené riziko infekce SARS‑CoV‑2 v analýze registru USA: dvojnásobně zvýšené riziko infekce SARS‑CoV‑2 při aplikaci IPP méně než 1× denně (HR 2,15; 1,9–2,44), resp. téměř čtyřnásobně zvýšené riziko při pravidelném denním podávání (HR 3,67; 2,93–4,60),4 stejná data jsou z korejského národního registru.
Druhým typem nežádoucích účinků vycházejících z hypergastrinemie a následné slizniční proliferace je polypoidní degenerace žaludeční sliznice. Proto je chronická léčba IPP spojena s vyšším rizikem karcinomu žaludku a neuroendokrinních nádorů. Tento vztah dokládají experimentální data i epidemiologické studie, přehled je dán v recentní práci.5 Vzhledem k tomu, že infekce Helicobacter pylori příznivě ovlivňuje výskyt karcinomu žaludku, jsou nejcennější studie u pacientů po eradikaci helicobacterové infekce. Taková studie s dlouhodobým sledováním dokládá více než dvojnásobnou četnost karcinomu žaludku (HR 2,44; CI 1,42–4,20) při léčbě IPP, naopak terapie blokátory H2R riziko nezvýšila (HR 0,72; CI 0,48–1,07).6
Bezpečnost IPP – kardiovaskulární systém
Se vzrůstající indikací IPP u nemocných léčených antitrombotiky se stále častěji setkáváme s rizikovější populací. Antitrombotika (antikoagulancia či protidestičkové látky) jsou indikována zejména při fibrilaci síní či při akutní cévní příhodě, tedy u stavů postihujících převážně seniory s rizikovými faktory aterogeneze a trombogeneze. Při relativně vysoké incidenci příhody (např. mozkové při trombembolii u fibrilace síní či infarktu myokardu, event. iktu u aterotrombotické okluze tepny), kdy se riziko pohybuje v rozmezí 2–20 % ročně, má relativně nevelký vzestup rizika velký populační dopad. Například při riziku příhody kolem 10 % ročně se třicetiprocentní nárůst (medián hodnoty, se kterou se u IPP setkáváme) projeví třemi závažnými příhodami ročně na každých 100 pacientů léčených IPP. Na straně druhé, podáváním IPP zabráníme vzniku gastrointestinálního krvácení provázejícího antitrombotickou léčbu. Incidence velkého a klinicky významného krvácení se při antikoagulační léčbě perorálními antikoagulancii pohybuje kolem 1–2 % ročně, léčba IPP toto riziko sníží asi o 30 %. Absolutní riziko významných krvácení tak klesne o jednu příhodu na každých 200–300 léčených. Z tohoto pohledu jsou nežádoucí účinky v oblasti kardiovaskulární nejvýznamnější. V povědomí většiny lékařů není léčba IPP spojována se zvýšeným cévním rizikem. Podívejme se tedy, jaká jsou fakta.
V posledních letech se objevují práce dokládající vyšší výskyt vaskulárních příhod – jak kardiovaskulárních, tak cerebrovaskulárních – při léčbě IPP. Část studií srovnává výskyt těchto příhod při léčbě IPP proti stavu bez IPP, cennější však je srovnání proti jinému „gastroprotektivu“, tedy blokátorům H2 receptorů.
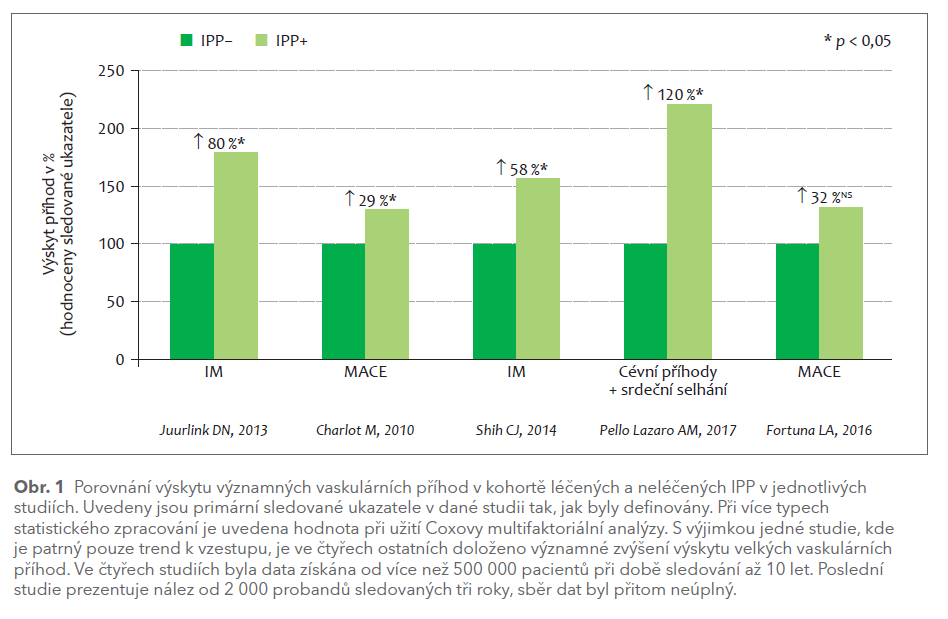
Jaká jsou data při srovnání IPP proti stavu bez léčby? Nejprve uveďme práce srovnávající incidenci velkých vaskulárních příhod (MACE) při léčbě IPP proti stavu bez léčby. Máme k dispozici pět studií – analýz registrů – se stovkami tisíc probandů sledovaných od tří týdnů až po deset let. Při srovnání byla užita analýza adjustovaných dat či metoda statistického párování.
Jedna z prvých retrospektivních analýz poukazujících na možný negativní dopad léčby IPP na výskyt kardiovaskulárních onemocnění byla studie z roku 2013.7 Během více než 10 let autoři sledovali v populaci provincie Ontaria výskyt infarktu myokardu a srdečního selhání během prvních 12 týdnů léčby IPP. Kontrolou byl výskyt sledovaných příhod v období bez podávání IPP. V období léčby IPP byl zaznamenán 80% vzestup výskytu infarktu myokardu (HR 1,8; CI 1,7–1,9), v absolutních číslech 2 595 příhod proti 1 439 příhodám.
Další velkou studií z Národního dánského registru byla studie 55 000 nemocných po infarktu myokardu.8 Část nemocných byla léčena kyselinou acetylsalicylovou (ASA), část clopidogrelem. Byl sledován krátkodobý (třítýdenní) účinek komedikace IPP na prognózu pacientů léčených protidestičkovou léčbou. V clopidogrelové větvi byl zvýšen výskyt velkých vaskulárních příhod téměř o třetinu (o 29 % při Coxově regresní analýze: HR 1,29; CI 1,17–1,42; o 35 % při analýze statistického párování: HR 1,35; CI 1,22–1,45). Ve druhé větvi léčené ASA bylo zvýšení stejné (o 29 % dle regresní analýzy, HR 1,29; CI 1,21–1,37, resp. o 45 % dle párové analýzy, HR 1,43; CI 1,34–1,53). Rozdíl patrný v obou větvích nezávisel na typu protidestičkové léčby, což je v souladu s tím, co bylo již řečeno o interakcích, tedy se skutečností, že IPP snižují účinek jak kyseliny acetylsalicylové, tak clopidogrelu.
Největší studie na dané téma zahrnující 250 000 probandů, tentokrát v populaci bez vaskulární anamnézy, tj. s nízkým rizikovým skóre, sledovala výskyt infarktu myokardu.9 Zařazeni byli probandi nově užívající IPP, kontrolní skupina bez IPP odpovídala věkem, rizikem, pohlavím apod. Po čtyřech měsících od zahájení léčby IPP vzrostlo riziko infarktu myokardu téměř o 60 % (HR 1,58; CI 1,11–2,25), přitom v prvním týdnu léčby bylo riziko dokonce čtyřnásobné (HR 4,61; CI 1,76–12,1). V absolutních číslech však bylo riziko velmi malé, jedna až dvě koronární příhody na každých 4 000 léčených v prvních dnech podávání IPP.
Shrneme‑li data srovnávající prognózu osob léčených IPP a bez léčby IPP, pak máme tři velké studie provedené na desítkách tisíc až stovkách tisíc probandů, které dokládají významně vyšší kardiovaskulární riziko při léčbě IPP (obr. 1). Relativní vzestup rizika příhody se pohyboval v rozmezí 30–80 %. Absolutní vzestup byl v nízkorizikové populaci malý, NNH (number need to harm, tedy počet léčených, u nichž se objeví příhoda) se pohyboval v tisících/rok. Naopak v populaci s pozitivní kardiovaskulární anamnézou se NNH pohyboval mezi 20–50/rok léčby, tedy na každých 20–50 léčených IPP v rámci komedikace s antitrombotickou léčbou se objevila jedna aterotrombotická příhoda ročně navíc.
Při hodnocení efektu IPP proti stavu bez léčby máme jedno významné omezení – vlastní výběr nemocného pro léčbu „gastroprotektivem“ při antitrombotické léčbě může být ovlivněn jeho rizikem krvácení, souběžnou medikací, věkem apod. Riziko v obou srovnávaných skupinách proto nemusí být stejné. Z tohoto důvodů jsou velmi důležité studie srovnávající IPP s blokátory histaminových receptorů H2 (s famotidinem či s ranitidinem). Takto je minimalizována chyba vzniklá odlišným výskytem vředové choroby, refluxní choroby apod. v obou skupinách.
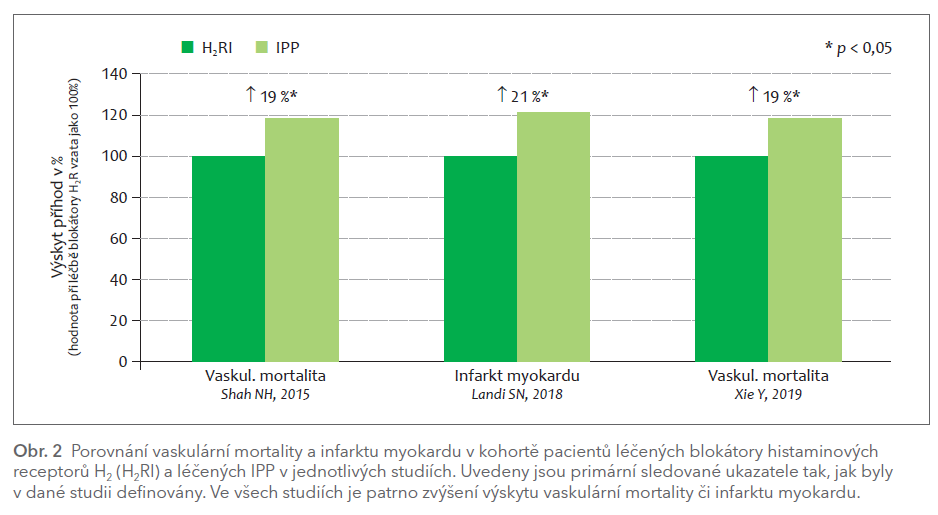
První studií srovnávající oba typy gastroprotektiv byla studie prospektivní, provedená z důvodů sledování farmakovigilance.10 Zařazeni byli nemocní z obecné americké populace (téměř 300 000 nemocných bez pozitivní kardiovaskulární anamnézy, či s ní), kteří byli indikováni k léčbě IPP pro gastroezofageální refluxní chorobu, tedy populace nízkoriziková i vysokoriziková, léčená zejména famotidinem či ranitidinem. Prognóza byla porovnávána ve skupině osob léčených buď IPP, nebo blokátory H2 receptorů. Ve skupině léčené IPP bylo pětileté riziko kardiovaskulární mortality o pětinu vyšší v porovnání s léčbou blokátory histaminových receptorů (HR 1,19; CI 1,09–1,30). Obdobné výsledky přinesla dosud nejmohutnější analýza registru pojištěnců USA čítající 4,5 mil. osob.11 Opět byly srovnány dvě gastroprotektivní strategie – IPP (3,7 mil. probandů, kterým byl předepsán jeden ze šesti IPP) s blokátory H2 receptorů (0,8 mil. probandů, kterým byl předepsán jeden z blokátorů H2R). Vstupní data určující kardiovaskulární riziko byla v obou skupinách srovnatelná. Také tato observační studie ukázala významné zvýšení četnosti infarktu myokardu o jednu pětinu (HR 1,21; CI 1,07–1,37) při léčbě IPP. Efekt byl významný pouze v prvních třech měsících léčby. V dalších měsících, až do doby tří let, byla incidence infarktu myokardu v obou kohortách prakticky stejná. Výskyt dalších vaskulárních příhod nebyl sledován. Tato robustní data ukazují jen rozdíl v incidenci infarktu myokardu mezi oběma skupinami pouze v prvých měsících léčby. Bohužel nejsou údaje o tom, jak pravidelně a jak dlouho byla léčiva užívána v měsících následujících. Je pravděpodobné, že zpočátku, tedy v inkriminovaném prvém tříměsíčním období, byla adherence k léčbě nejvyšší a s odstupem od iniciální preskripce mohla s ústupem potíží klesat.
Třetí, byť stran počtu sledovaných pacientů, již menší studie opět srovnávala obě skupiny gastroprotektiv.12 Ve skupině PPI bylo více než 150 000 nemocných s nově předepsaným IPP, ve skupině blokátorů H2R více než 50 000 nově užívajících. Nižší počet vynahradila dlouhá doba sledování po celou dobu užívání trvající až 10 let. Předností této studie bylo jak dlouhodobé sledování, přesné sledování preskripce, vysoká kvalita registru (US Department of Veterans Affairs), tak i rozdělení mortality podle příčin. Demografická charakteristika, tj. prevalence rizikových faktorů aterogeneze, indikace léčby (vředová choroba či gastroezofageální reflux), byla ve všech těchto bodech srovnatelná. Stejně jako v předchozí studii byla sledována mortalita při léčbě IPP a blokátory H2 receptorů. Analýza dat byla provedena s aspektem získání informací o mortalitě (celkové i podle příčin) v obou větvích. Je patrna mírná, ale významně vyšší celková mortalita (zvýšení o 17 %), v absolutních číslech 45 úmrtí na tisíc léčených pacientů. Podobně stoupla kardiovaskulární mortalita o 19 %, resp. o 17 úmrtí na tisíc léčených. Úmrtí na onkologická onemocnění rovněž významně stoupla o 18 % (o 13 úmrtí/1 000), na infekční a parazitární onemocnění o 66 % (o 4/1 000) či na onemocnění urogenitální o 94 % (o 6/1 000). V případě nádorů byl vzestup na vrub karcinomu žaludku, v případě urogenitálním se jednalo o úmrtí na renální selhání.
Z analýzy předložených dat tří studií vyplývá, že léčba IPP je v porovnání s léčbou blokátory histaminových receptorů H2 zatížena mírným (asi 20%), nicméně významným vzestupem úmrtnosti i rizika koronárních příhod (obr. 2). Toto zjištění má větší váhu nežli porovnání s absencí léčby, neboť je zachována zásada porovnatelného výskytu komorbidit i srovnatelného kardiovaskulárního rizika v obou větvích. Ve studiích porovnávajících léčbu IPP proti její absenci byla indikace gastroprotektiva jak z důvodu léčby a prevence recidivy vředové či refluxní choroby, tak z důvodu profylaxe gastrointestinálního krvácení. Naopak při srovnání IPP s blokátory receptorů H2 byla indikace jednotná, tedy pozitivní anamnéza onemocnění horní části trávicího traktu. V prvém případě je pravděpodobná spoluúčast lékových interakcí na úrovni IPP a protidestičkové léčby, při srovnání s blokátory receptorů H2 je významný podíl lékových interakcí méně pravděpodobný. Předložené studie sice nejsou randomizované, nicméně homogenní nález 20% zvýšení vaskulární mortality či infarktu myokardu je podán ve třech nezávislých registrech a analyzována byla populace stovek tisíc až milionů pacientů. Tato fakta není možno jen tak znevěrohodnit.
Bezpečnost IPP – ledviny
Spojitost IPP s onemocněním ledvin se zdá být vzdálená, nicméně protonová pumpa významně ovlivňuje fyziologické děje na úrovni nefronu. Její inhibice mění pH moči, tím dochází ke změně disociace a rozpustnosti s následnou poruchou eliminace celé plejády látek (zplodin metabolismu, léčiv apod.). Paralelně IPP inhibují transportní kanál bivalentních kationtů TRPM6/7, snižují reabsorpci bivalentních kationtů z primární moči v nefronu. Mechanismus vývoje intersticiální nefritidy není jasný, obviňována je inhibice funkce transportních kanálů v epiteliích nefronu, alergická reakce či porucha detoxikační funkce lyzosomu v renálních epiteliích.
Opět zde nemáme žádné randomizované studie, jen studie observační, ty jsou však, stejně jako u kardiovaskulárních, založeny na masivních datech. Kohortová studie z Nového Zélandu předkládá data od více než půl milionu nemocných léčených IPP.13 Léčba IPP vedla k pětinásobnému zvýšení rizika akutní intersticiální nefritidy (HR 5,16; CI 2,21–12,05), u seniorů bylo riziko dokonce o řád vyšší. Nález častější incidence akutní intersticiální nefritidy byl potvrzen též v kohortové studii u téměř 300 000 seniorů užívajících IPP.14 Riziko intersticiální nefritidy vzrostlo trojnásobně (HR 3,0; CI 1,47–6,14) a riziko akutního renálního selhání jen o něco méně (RR 2,52; CI 2,27–2,79). V absolutních číslech se riziko pohybovalo kolem 8 případů na 1 000 paciento‑roků, tedy 13,5 při léčbě IPP vs. 5,5 příhod bez léčby. Nebyl zjištěn rozdíl mezi jednotlivými IPP. Podobná analýza (opět typu case‑control) sledovala riziko akutního renálního selhání.15 V souboru více než 180 000 nemocných stoupla incidence při léčbě o 70 % (HR 1,72; CI 1,27–2,32).
Poslední analýza z roku 2019 sledovala nikoli incidenci renálního selhání při léčbě IPP, ale naopak zjišťovala, jak častá byla léčba IPP u nemocných s akutním (n 93 000), resp. chronickým renálním selháním (n 85 000).16 Při léčbě IPP byla incidence akutního renálního selhání 36,4 na každých 1 000 paciento‑roků, bez léčby pouze 3,5, tedy desetinásobný rozdíl. Podobně pro chronické renální selhání byla incidence 34,3 příhody při léčbě IPP oproti 8,8 bez léčby na každých 1 000 paciento‑roků. Opět významné zvýšení: léčba IPP je zatížena více než třemi případy akutního renálního selhání na každých 100 léčených, resp. 2–3 případy selhání chronického (přehled obr. 3).
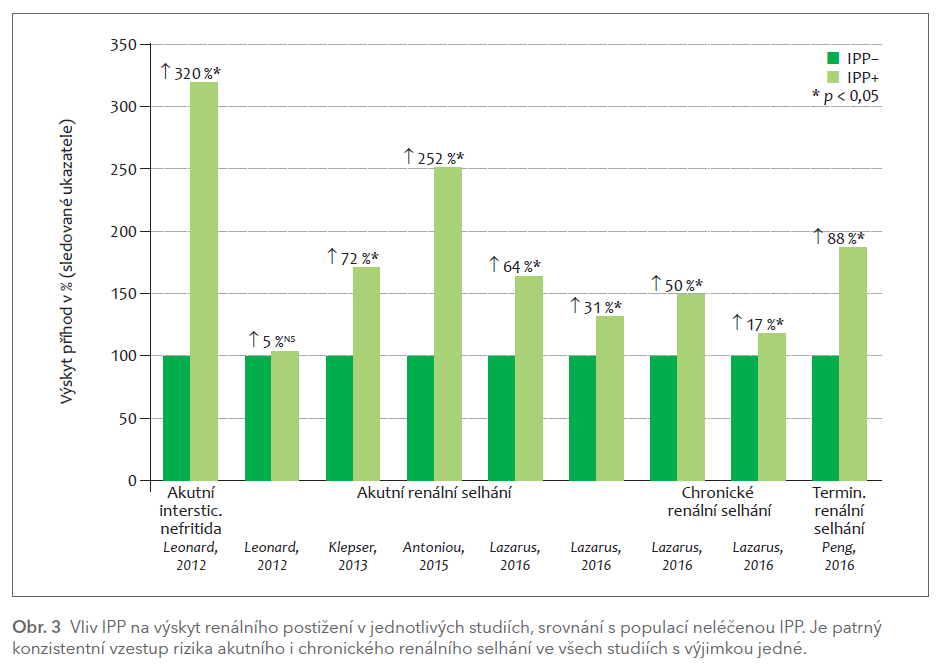
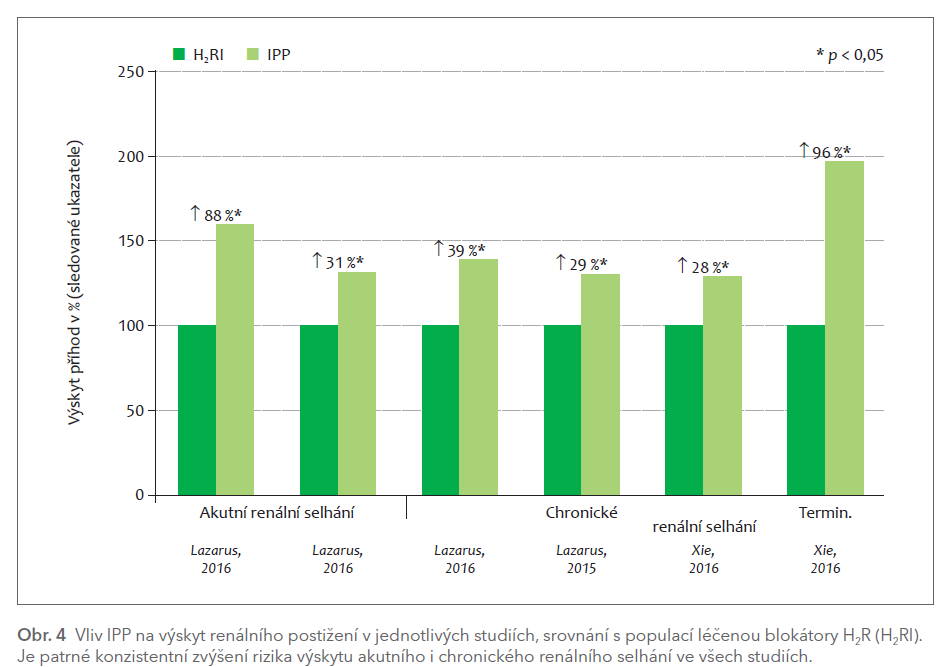
Stejně, jako jsou pro posouzení jak kardiovaskulárního rizika, tak i nefrotoxického rizika IPP důležité studie srovnávající účinnost dvou různých „gastroprotektiv“, odpadá případný vliv onemocnění, pro něž je léčba indikována. Optimálním komparátorem jsou tedy blokátory H2 receptorů. I zde máme několik observačních studií. V kohortě 170 000 nemocných databáze Veteran’s Affairs léčených IPP a 20 000 léčených blokátory H2R vzrostla během více než pětiletého sledování incidence chronické renální insuficience (ClCr < 60 ml/min) o pětinu (HR 1,22; CI 1,18–1,26) a incidence terminálního selhání se zdvojnásobila (HR 1,96; CI 1,23–3,18).17 Dobře sledovatelná a klinicky významná hodnota – dvojnásobný vzestup koncentrace kreatininu – byla o 50 % častější při léčbě IPP (HR 1,53; CI 1,42–1,65). V absolutních číslech činil rozdíl 2,5 příhod (6,2 při léčbě IPP vs. 3,7 při léčbě blokátory H2R) na každých 100 léčených. Chronická renální insuficience či terminální selhání se objevily v 7,5 % při léčbě IPP proti 4,7 % při léčbě blokátory H2R, absolutní nárůst činil téměř 3 %. Tedy na každých 35–40 pacientů léčených IPP se u jednoho nemocného objevilo během pěti let významné zhoršení renálních funkcí.
Podobné zvýšení rizika chronického renálního selhání při léčbě IPP ve srovnání s léčbou blokátory H2R či proti populaci neléčené „gastroprotektivy“ bylo doloženo v dalších dvou nekomerčních databázích.18 Podskupinová analýza neukázala rozdíly podle věku, pohlaví, přítomnosti diabetu či konkomitantní léčby. Ve skupině nemocných léčených blokátory H2R nebyl zjištěn rozdíl v incidenci chronického renálního selhání proti populaci neléčené. Přehled výskytu různých typů nefropatií při léčbě IPP v porovnání s léčbou blokátory H2 receptorů je dán v obr. 4.
Posledním způsobem porovnání rizika léčby IPP je analýza databáze hlášení nežádoucích účinků léčiv vedené FDA.19 Analýza zahrnující více než 700 000 nemocných léčených IPP a přes 160 000 léčených blokátory H2 receptorů dokládá více než třicetinásobně častější hlášení výskytu terminálního renálního selhání (HR 35,5; CI 5–250), téměř třicetinásobné riziko chronického renálního selhání či insuficience (HR 28,4; CI 12,7–63,5) a čtyřnásobné riziko akutního renálního selhání (HR 4,2; CI 2,8–6,3) při léčbě IPP proti léčbě blokátory H2R. Nefrologické riziko vynikne zvláště při procentuálním vyjádření, kdy se renální selhání, nefrolitiáza či závažná elektrolytová dysbalance objevila v 5,6 % při léčbě IPP proti 0,7 % při léčbě blokátory H2 receptorů. Rozdíl rizika mezi jednotlivými IPP nebyl zásadní, jedná se o „class effect“. V téže práci bylo sledováno i riziko iontové dysbalance: hypomagnezemie byla hlášena téměř osmdesátkrát častěji než při léčbě blokátory H2R, hypokalcemie byla pětadvacetkrát, hypokalemie šestkrát a hyponatremie dvakrát častější. Vysoké riziko deplece bivalentních kationtů (magnezia a kalcia) doložila i řada jiných studií (jejich přehled viz citace 20). Četnost záležela na délce léčby, konkomitantní léčbě (zejména diuretiky) či dietních návycích.
Shrneme‑li dosavadní poznatky, pak i nefrotoxické riziko IPP je vysoce pravděpodobné. Jak studie sledující výskyt závažných nefropatií při léčbě či studie sledující frekvenci podávání IPP u nemocných s již doloženou nefropatií, tak i analýza hlášení nežádoucích účinků dokládají významné riziko akutního i chronického renálního selhání při léčbě IPP. Platí to jak proti stavu bez léčby, tak ve srovnání s blokátory H2 receptorů.
Obdobně by bylo možno doložit celou řadu méně závažných nežádoucích účinků na úrovni jiných systémů, které byly uvedeny v tab. 3, tj. dopad na nervový a smyslový systém, kostní metabolismus, reprodukční systém či na systém respirační. Pro omezení rozsahu tohoto sdělení musím odkázat na širší přehled věnovaný gastroenterologům.21
Možná pro řadu kolegů bude zpochybnění bezpečnosti IPP překvapením, nicméně i národní lékové agentury jsou „bdělé“ a opakovaně varují před rizikem např. nefropatií tím nejvýznamnějším způsobem, tj. uvedením nežádoucího účinku na úrovni „black box“.
Zdůrazňuji, že tento přehled rozhodně nemá být „poplašnou zprávou“ kompromitující IPP. Nicméně ukazuje se, že bezpečnost této velmi rozšířené lékové skupiny není taková, za jakou ji většina lékařů pokládá. Jak rozbor vlastností, lékových interakcí, tak klinická data jsou ve shodě. Na straně jedné máme doporučené postupy řady odborných společností, které široké užívání IPP v různých indikacích (gastroenterologických, kardiologických aj.) upřednostňují, nicméně o případných nežádoucích účincích se nezmiňují. Zamysleme se proto vždy, než předepíšeme nový lék. Převáží přínos případné riziko? Převáží přínos u tohoto konkrétního nemocného?
Literatura
1. Khan SU, Lone AN, Asad ZUA, et al. Meta‑analysis of efficacy and safety of proton pump inhibitors with dual antiplatelet therapy for coronary artery disease. Cardiovasc Revasc Med 2019;20:1125–1133.
2. Ray WA, Chung CP, Murray KT, et al. Association of oral anticoagulants and proton pump inhibitor cotherapy with hospitalization for upper gastrointestinal tract bleeding, J Am Med Assoc 2018;320:2221–2230.
3. Moayyedi P, Eikelboom JW, Bosch J, et al. Pantoprazole to prevents gastroduodenal events in patients receiving rivaroxaban and/or aspirin in a randomized, double‑blind, placebo‑controlled trial. Gastroenterology 2019;157:E403–E412.
4. Lacy B. Editor’s note. [to article] Almario CV, Chey WD, Spiegel BMR. Increased risk of COVID‑19 among users od proton pump inhibitors and Author’s note. [online] https://journals.lww.com/ajg/Documents/AJG‑20‑1811_R1(PUBLISH%20AS%20WEBPART).pdf
5. Joo MK, Park JJ, Chun HJ. Proton pump inhibitor: the dual role in gastric cancer. World J Gastroenterol 2019;25:2058–2070.
6. Suissa S, Suissa A. Proton‑pump inhibitors and increased gastric cancer risk: time‑related biases. Gut 2018;67:2228–2229.
7. Juurlink DN, Dormuth CR, Huang A, et al. Proton pump inhibitors and the risk of adverse cardiac events. PLoS ONE 2013;8:e84890.
8. Charlot M, Ahlehoff O, Norgard ML, et al. Proton‑pump inhibitors are associated with increased cardiovascular risk independent of clopidogrel use. Ann Int Med 2010;153:378–386.
9. Shih CJ, Chen YT, Ou SM, et al. Proton pump inhibitor use represents an independent risk factor for myocardial infarction. Int J Cardiol 2014;177:292–297.
- Shah NH, LePendu P, Bauer‑Mehren A, et al. Proton pump inhibitor usage and the risk of myocardial infarction in the general population. PLoS ONE 2015;10:e0124653.
- Landi SN, Sandler RS, Pate V, et al. No increase in risk of acute myocardial infarction in privately insured adults prescribed proton pump inhibitors vs histamine‑2 receptor antagonists (2002–2014). Gastroenterol 2018;154:861–873.
- Xie Y, Bowe B, Yan Y, et al. Estimates of all cause mortality and cause specific mortality associated with proton pump inhibitors among US veterans: cohort study. Br Med J 2019;365:1580.
- Blank ML, Parkin L, Paul C, Herbison P. A nationwide nested case control study indicates an increased risk of acute interstitial nephritis with proton pump inhibitor use. Kidney Int 2014;86:837–844.
- Antoniou T, Macdonald EM, Hollands S, et al. Proton pump inhibitors and the risk of acute kidney injury in older patients: a population‑based cohort study. CMAJ Open 2015;3:E166–E171.
- Klepser DG, Collier DS, Cochran GL. Proton pump inhibitors and acute kidney injury: a nested case‑control study. BMC Nephrol 2013;14:150.
- Hart E, Dunn TE, Feuerstein S, Jacobs DM. Proton pump inhibitors and risk of acute and chronic kidney disease: a retrospective cohort study. Pharmacother 2019;39:443–453.
- Xie Y, Bowe B, Li T, et al. Proton pump inhibitors and risk of incident CKD and progression to ESRD. J Am Soc Nephrol 2016;27:3153–3163.
- Lazarus B, Chen Y, Wilson FP, et al. Proton pump inhibitor use and the risk of chronic kidney disease. JAMA Intern Med 2016;176:238–246.
- Makunts T, Cohen IV, Awdishu L, et al. Analysis of postmarketing safety data for proton‑pump inhibitors reveals increased propensity for renal injury, electrolyte abnormalities, and nephrolithiasis. Sci Rep 2019;9:2282.
- Cheungpasitporn W, Thongprayoon C, Kittanamongkolchai W, et al. Proton pump inhibitors linked to hypomagnesemia: a systematic review and meta‑analysis of observational studies. Ren Fail 2015;37:1237–1241.
- Bultas J. Inhibitory protonové pumpy – známe je dobře? Jsou skutečně tak bezpečné? – část 2. Gastroent Hepatol 2020;7:547–551.