Intersticiální plicní procesy – základy pro praktického lékaře
Souhrn
Intersticiální plicní procesy tvoří širokou skupinu mnohdy vzácných chorob, jejichž projevy zahrnují obvykle dušnost a/nebo kašel. Praktický lékař by měl být informován o riziku souběhu některých nemocí s intersticiálním plicním postižením (např. revmatoidní artritida) nebo o riziku pneumotoxického působení pacientovy medikace (amiodaron). Na fibrotické postižení plicního intersticia upozorní krepitus nebo paličkovité prsty. Pozornost je třeba věnovat i nemocným v riziku kontaktu s fibrogenním nebo organickým prachem, ale ani v této skupině pacientů by neměly být příznaky onemocnění respiračního traktu bagatelizovány. Management komorbidit, některých symptomů nebo vedlejších účinků léčby vyžaduje vždy dobrou spolupráci s praktickým lékařem a komplexní pojetí pacientovy choroby přispívá ke zlepšení kvality života nemocných s intersticiálními plicními procesy.
Klíčová slova: intersticiální plicní proces • praktický lékař • idiopatická plicní fibróza • exogenní alergická alveolitida • sarkoidóza
Summary
Interstitial lung diseases form a broad group of often rare disorders, the manifestations of which usually include dyspnea and / or cough. The general practitioner should be informed of the risk of coincidence of certain diseases with interstitial lung disease (eg rheumatoid arthritis) or of the risk of pneumotoxic effects of the patient‘s medication (amiodarone). Crepitus or finger clubbing indicate fibrotic involvement of the pulmonary interstitium. Attention should also be paid to patients at risk of contact with fibrogenic dust or organic dust, and even in this group of patients, the symptoms of respiratory tract disease should not be downplayed. The management of comorbidities, some symptoms or side effects of medication always requires good cooperation with a general practitioner and a comprehensive concept of the patient‘s disease contributes to improving the quality of life of patients with interstitial lung diseases.
Key words: interstitial lung disease • general practitioner • idiopathic pulmonary fibrosis • extrinsic allergic alveolitis • sarcoidosis
Rozdělení intersticiálních plicních procesů
Diferenciální diagnostika dušnosti a kašle není doménou pneumologů, ve své každodenní praxi se s těmito stesky svých pacientů setkávají i praktičtí lékaři. Ve většině případů je sice vysvětlení jiné než postižení plicního intersticia, na druhé straně pro řadu intersticiálních plicních procesů je charakteristický nepříznivý průběh, který může vést k rozvoji respirační insuficience a k úmrtí. Většina z těchto chorob není preventabilních, nicméně časná diagnostika a správná léčba mohou dramaticky ovlivnit prognózu postiženého jedince.
Intersticiální plicní procesy (IPP) lze zjednodušeně rozdělit do několika skupin:1
- IPP vyvolané dominantně vlivem zevně působících faktorů,
- IPP vyvolané dominantně vnitřními faktory,
- IPP neznámé etiologie,
- IPP provázené granulomatózní reakcí plicní tkáně,
- vzácné IPP.
Zevně působícími faktory pro skupinu jedna mohou být organické a anorganické prachy a páry (exogenní alergická alveolitida, pneumokoniózy), polékové poškození, poradiační poškození, prodělané infekce (včetně COVID‑19), prodělaný syndrom dechové tísně dospělých (ARDS) jakékoliv etiologie a podobně.2–4 Působí‑li praktický lékař zároveň jako poskytovatel pracovnělékařských služeb, minimálně s problematikou exogenních alergických alveolitid (EAA) a pneumokonióz by měl být obeznámen.
Skupina dvě zahrnuje především pacienty se systémovými chorobami pojiva a s jinými patologiemi imunitního systému. Z této skupiny nemocí vystupuje do popředí především revmatoidní artritida, kterou nelze považovat za vzácné onemocnění a která může být provázena postižením plicního parenchymu až v 70 % případů.5 U nemocných s jinými patologiemi, např. s imunodeficity, bývá vstupní diagnóza stanovena na podkladě jiných příznaků a většina z nich se nemanifestuje IPP.
Třetí skupina je mnohem obsáhlejší, než bychom si přáli. Navzdory nespornému pokroku u řady IPP neumíme jejich etiologii přesně vysvětlit, i když obecně se má za to, že je nejspíše multifaktoriální a podílejí se na ní jak faktory vnitřní (genetická predispozice jedince), tak vnější (kouření, vlivy prostředí). Patří sem idiopatické intersticiální pneumonie včetně prognosticky nejzávažnější idiopatické plicní fibrózy (IPF).
Typickým zástupcem nemocí provázených granulomatózním plicním postižením je sarkoidóza. Lze namítnout, že etiologii sarkoidózy neznáme, tudíž proč ji nezmínit v rámci skupiny předchozí, odlišnost sarkoidózy ale spočívá v jejím potenciálu postihovat i jiné orgány než jen plíce. I když u některých nemocných může mít sebelimitující průběh (Löfgrenův syndrom – erythema nodosum, subfebrilie, bilaterální hilová lymfadenopatie), postihne‑li mozek nebo srdce, nejenže sama nezmizí, ale může být pro postiženého jedince fatální.
To, co je vzácné, mívá v řadě případů sběratelskou hodnotu. Podobně je to v případě vzácných IPP, kde diferenciální diagnostika patří do rukou specializovaného pracoviště. Jedná se například o lymfangioleiomyomatózu, plicní histiocytózu z Langerhansových buněk, plicní alveolární proteinózu apod.
Žádná klasifikace není ideální a tak je tomu i s tou výše uvedenou. EAA se může manifestovat jako granulomatózní plicní postižení, stejně tak plicní postižení při běžném variabilním imunodeficitu mívá granulomatózní charakter. Respirační bronchiolitida asociovaná s intersticiálním plicním postižením (RB‑ILD) se vyskytuje prakticky pouze u kuřáků a po zanechání kouření spontánně mizí, přesto je řazena historicky mezi idiopatické intersticiální pneumonie.6 Eozinofilní pneumonie v klasifikaci též běžně uváděny nejsou a jejich etiologie může být různorodá, od polékového postižení po idiopatické eozinofilní pneumonie.7
Když slyšíte za Plzní dusot kopyt, nebývá to stádo zeber
Nejčastěji se v klinické praxi setkáváme se sarkoidózou, EAA a IPF. Je ale určitě potřeba mít na paměti možnou asociaci mezi systémovou chorobou pojiva a plicním postižením nebo medikací pacienta a plicním postižením. Zvlášť u nemocných léčených amiodaronem bývá někdy možnost polékového postižení dlouho opomíjena, a protože amiodaron slouží k léčbě arytmií, bývá pacient pro dechové obtíže odesílán častěji na kardiologii než na skiagram hrudníku.
Roční incidence sarkoidózy v ČR je udávána 3,1/100 000 obyvatel, prevalence světově 6–23,1/100 000 obyvatel.8 Pro srovnání, prevalence chronické obstrukční plicní nemoci (CHOPN) v roce 2017 v ČR byla 21,6/1 000 obyvatel.9 Zatímco pacientů s CHOPN je tedy v ČR zhruba čtvrt milionu, nemocných se sarkoidózou může být 600–2 300. V případě akutního rozvoje sarkoidózy v podobě výše uvedeného Löfgrenova syndromu je velmi pravděpodobné, že onemocnění vymizí samo, bez nutnosti systematické léčby (obr. 1). Dominantním problémem u této skupiny nemocných bývá erythema nodosum v oblasti bérců a velmi často otoky a bolest kotníků. Nezřídka bývají nemocní léčeni antibiotiky (záměna s poštípáním hmyzem), odesíláni na kožní oddělení nebo k revmatologovi. Charakteristický nález bilaterální hilové lymfadenopatie společně s erythema nodosum pro diagnózu postačí, a je‑li propuknutí nemoci provázeno i systémovými příznaky (subfebrilie, febrilie), není pro stanovení diagnózy požadována histologická verifikace. Jsou‑li nemocnému v této fázi podány symptomaticky systémové kortikosteroidy, zvyšuje se riziko jak recidiv, tak přechodu do chronické formy.10
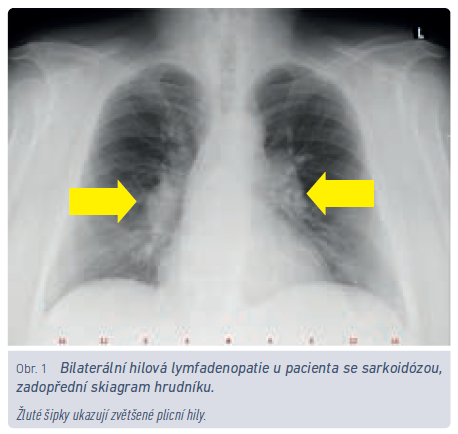
S problematikou EAA by měli být obeznámeni nepochybně lékaři, kteří poskytují pracovnělékařské služby. Vyvine‑li nemocný v riziku kontaktu s inhalačními antigeny dechové obtíže, zejména pokud existuje časová a místní souvislost mezi vznikem obtíží a expozicí, je namístě uvažovat o EAA (obr. 2). Nemocný by měl být odeslán k plicnímu vyšetření, a je‑li diagnóza potvrzena, znamená to obvykle nutnost přeřazení z rizikového provozu. Inhalačních antigenů, které byly popsány v souvislosti s rozvojem EAA, je několik stovek.11 Obecně největší riziko představuje opakovaný kontakt s plísněmi a bakteriemi (farmáři, pracovníci v zemědělství, chovatelé hospodářských zvířat, ale i vlhké stavby, bazény apod.) anebo s ptačím peřím (rizikem jsou ohroženi též chovatelé holubů a okrasného ptactva a riziko představují i péřové lůžkoviny). Zatímco zjišťovat preventivně povahu lůžkovin nemocného je spíše bizarní, představu o zaměstnání pacienta by praktický lékař mít měl. Občas se setkáváme v kolonce pracovní anamnéza s údajem osoba samostatně výdělečně činná. Tento údaj je z hlediska možných zdravotních rizik spojených s povoláním zcela nedostatečný a nevypovídá o tom, zda pacient vede někomu účetnictví, nebo chová hovězí dobytek.
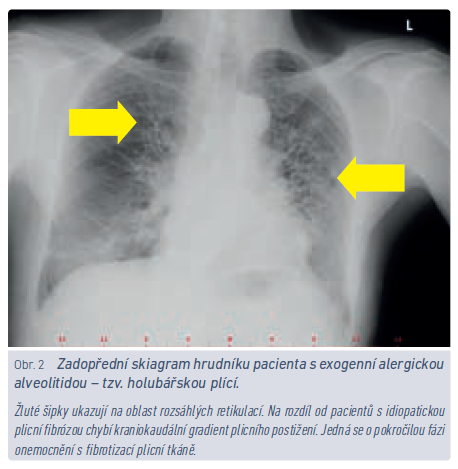
U nefibrotických forem EAA se můžeme setkat s časovou vazbou mezi expozicí inhalačnímu antigenu a příznaky. Typickým vodítkem k diagnóze jsou opakované epizody dušnosti, kašle, subfebrilií, bolestí svalů a kloubů, které se rozvinou po kontaktu s inhalačním antigenem. U značné části pacientů ale tato souvztažnost chybí, a tak je třeba, aby měl lékař potenciální zdravotní rizika vyplývající z pacientova zaměstnání/koníčků na mysli a v případě rozvíjející se námahové dušnosti, dlouhodobějšího kašle nebo abnormálního poslechového nálezu nemocného aktivně odeslal k plicnímu vyšetření.12 Základem léčby EAA je zabránění dalšímu kontaktu s vyvolávajícím agens a opakování této mantry nemocným není nikdy dost.13
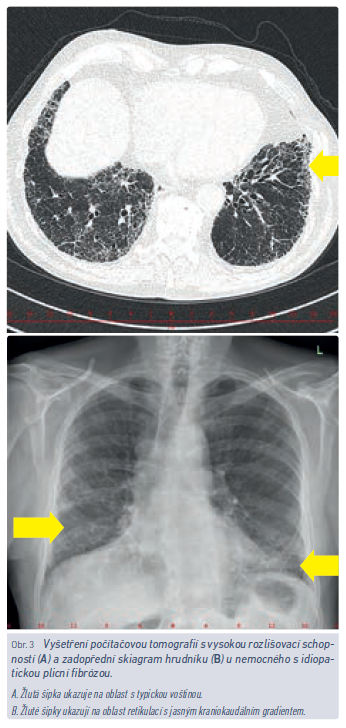
Nemocní s IPF jsou obvykle starší než pacienti se sarkoidózou a EAA. Je pravda, že typickým pacientem s IPF je bývalý kuřák, muž ve věku kolem 70 let, nejedná se ale o podmínku sine qua non (obr. 3). Polymorbidita není výjimkou, dosti typickým pro chorobu však bývá poslechový nález krepitu nad plicními bázemi.14 Někteří pacienti mají paličkovité prsty, které obvykle sami jako znak možného onemocnění nehodnotí, lékař by ale jejich přítomnost přehlédnout neměl. I když subjektivní obtíže v počátku onemocnění bývají pacientem bagatelizovány a přičítány věku, přidruženým onemocněním či nadváze a dekondici, časné stanovení diagnózy, především však časné zahájení antifibrotické léčby dramaticky mění prognózu těchto nemocných. Krepitus je velmi senzitivním ukazatelem fibrotického plicního postižení, proto i v době moderních technologií hraje fyzikální vyšetření pacienta nezbytnou úlohu a v rámci preventivních prohlídek by nemělo být opomíjeno.
Pacient s diagnostikovaným intersticiálním plicním procesem v ambulanci praktického lékaře
To, že je u pacienta diagnostikován IPP, neznamená, že nemocný tím u svého praktického lékaře skončil a péče o něj se přesouvá kompletně na specializované pracoviště. Jedná se o velmi zranitelnou skupinu pacientů, v případě fibrotizujícího IPP vždy s velmi vážnou prognózou.15 Nutnost proaktivního přístupu v některých oblastech s sebou nese nejenom jejich onemocnění, ale nezřídka i léčba a její možné vedlejší účinky.
Při každé návštěvě ordinace by měl padnout dotaz na nikotinismus (samozřejmě u pacientů, kteří v době stanovení diagnózy kouřili) a měla by být provedena krátká intervence o škodlivosti kouření. Nemocný by nikdy neměl slyšet spekulaci o tom, zda se „ještě vyplatí“ zanechat kouření, nebo slova, že „přestat kouřit najednou by pro vás bylo nebezpečné“. Jediná „dobrá“ cigareta je ta, kterou nemocný nevykouří, a protože většina nemocných nemá problém s tím, aby přestali kouřit, ale s tím, aby znovu nezačali, je třeba je v jejich snahách podpořit. Stejně tak je zejména u nemocných s EAA vhodné cíleně se ptát, zda bylo zamezeno expozici vyvolávajícímu agens.
Pacienti s IPP by měli být každoročně očkováni proti chřipce, jednorázově proti pneumokokům a také proti COVID‑19. Infekční onemocnění může spustit exacerbaci zejména IPP s fibrotickým plicním postižením a mortalita této komplikace dosahuje 80 %. Pacient by neměl přecházet respirační infekty a bakteriální infekce dýchacích cest by měly být přeléčeny antibiotiky.
Systémová kortikoterapie a některá imunosupresiva s sebou nesou vyšší riziko rozvoje metabolických a kardiovaskulárních komplikací.16 Nejčastěji jde o rozvoj steroidního diabetu/dekompenzace stávajícího onemocnění, akceleraci arteriální hypertenze, dyslipidemie s aterogenním potenciálem a osteoporózy. I v tomto ohledu je nutné zaměřit se především na prevenci, pacienta důsledně edukovat a kontrolovat dodržování režimu.
Prognóza nemocných, u kterých v rámci IPP dojde k fibrotizaci plicní tkáně, je vážná. Nemoc dokáže v čase kompletně změnit život nemocnému i jeho rodině. V pokročilých fázích onemocnění bývá potřeba dlouhodobé domácí kyslíkové léčby. Mobilita nemocných v čase klesá, pacienti mohou být dušní při malé námaze, charakteristickým rysem pokročilejšího IPP je také únava. Pacient by měl být informován o možnostech pomoci – jedná se především o možnosti žádat o průkaz osoby se zdravotním postižením, příspěvek na péči, ošetřovné a dlouhodobé ošetřovné.17 Tato pomoc může umožnit setrvání pacienta v domácím prostředí, zejména má‑li funkční rodinu. Domácí zdravotní péče nutná nebývá, ale zajištění pečovatelské služby zejména u starších nemocných může nemocnému výrazně usnadnit život. Velká část pacientů s IPP onemocní v produktivním věku, i zde je třeba spolupráce s poskytovatelem pracovnělékařských služeb (pacient v pracovní neschopnosti pro EAA, který pracuje v drůbežárně a jehož nemoc se zřejmě rozvinula na podkladě dosavadní expozice v práci, by se nikdy neměl vrátit do téhož provozu). U některých profesí nemá pacient závodního lékaře a je třeba s nemocným diskutovat o dalším pracovním zařazení, případně o žádosti týkající se přiznání invalidního důchodu. V rozporu s představami některých pacientů nemůže pneumolog nemocnému výkon dosavadního povolání „zakázat“ nebo „dovolit“. Může se ale vyjádřit k závažnosti plicního postižení a k míře rizika souvisejícího s vykonáváním některých činností a toto vyjádření by mělo sloužit společně s ostatními zprávami posuzujícími případná další zdravotní rizika pacienta jako podklad pro další jednání s českou správou sociálního zabezpečení.
Závěr
Praktický lékař zajišťuje preventivní i léčebnou péči včetně poradenské činnosti. Provádí pravidelné lékařské prohlídky, očkování a další základní zdravotní úkony, případně pacienty doporučuje k jiným lékařům, specialistům. Intersticiálním plicním procesům bohužel předcházet nelze, onemocnění však lze odhalit v rámci preventivních prohlídek (krepitus při poslechovém vyšetření plic) a podle obtíží referovaných pacientem. U některých IPP se setkáme s řadou mimoplicních projevů (systémové choroby pojiva, sarkoidóza), EAA nebo idiopatické intersticiální pneumonie postihují výlučně plíce, a obtíže nemocného tak budou odpovídat příznakům postižení dýchacího traktu.
Pacienti s IPP mají obecně větší potřebu lékařské péče, což může být dáno jak onemocněním, tak jeho léčbou a vedlejšími účinky této léčby. Každý případ nemocného s IPP by měl být řešen komplexně, nejen s ohledem na plicní problematiku, ale i v širším kontextu včetně potřeby sociálních služeb a pomoci. Řadě komplikací těchto procesů (např. infekcím) lze účinně předcházet (očkováním). Úloha praktického lékaře v péči o nemocné s IPP je zcela nezastupitelná a neměla by být opomíjena.
Literatura
- Jones MG, Richeldi L. Recent Advances and Future Needs in Interstitial Lung Diseases. Semin Respir Crit Care Med 2016;37:477–484.
- Jacobs RL, Andrews CP, Coalson JJ. Hypersensitivity pneumonitis: beyond classic occupational disease‑changing concepts of diagnosis and management. Ann Allergy Asthma Immunol 2005;95:115–128.
- Ambardar SR, Hightower SL, Huprikar NA, et al. Post‑COVID‑19 Pulmonary Fibrosis: Novel Sequelae of the Current Pandemic. J Clin Med 2021;10:2452. doi: 10.3390/jcm10112452.
- Singh N, Singh S. Interstitial Lung Diseases and Air Pollution: Narrative Review of Literature. Pulm Ther 2021;7:89–100.
- Shao T, Shi X, Yang S, et al. Interstitial Lung Disease in Connective Tissue Disease: A Common Lesion With Heterogeneous Mechanisms and Treatment Considerations. Front Immunol 2021;12:684699.
- Margaritopoulos GA, Harari S, Caminati A, Antoniou KM. Smoking‑related idiopathic interstitial pneumonia: A review. Respirology 2016;21:57–64.
- Rosenberg CE, Khoury P. Approach to Eosinophilia Presenting With Pulmonary Symptoms. Chest 2021;159:507–516.
- Lošťáková V, Kolek V, Vašáková M. Sarkoidóza – doporučený postup diagnostiky, terapie a sledování vývoje onemocnění. Sekce intersticiálních plicních procesů České pneumologické a ftizeologické společnosti. Dostupné na: www.pneumologie.cz.
- 6.2.22 Prevalence CHOPN (J40–J44, J47) – Regionální zpravodajství NZIS – Česká republika (uzis.cz), navštíveno 12. 8. 2021.
- Šterclová M. Současná diagnostika a terapie sarkoidózy. Vnitř Lék 2020;66:409–413.
- Ojanguren I, Ferraro V, Morisset J, et al. Assessment and Management of Occupational Hypersensitivity Pneumonitis. J Allergy Clin Immunol Pract 2020;8:3295–3309.
- Vasakova M, Selman M, Morell F, et al. Hypersensitivity Pneumonitis: Current Concepts of Pathogenesis and Potential Targets for Treatment. Am J Respir Crit Care Med 2019;200:301–308.
- Šterclová M. Exogenní alergická alveolitida. Doporučené postupy v pneumologii. 2. vyd. Praha: Maxdorf, 2016;290–304. ISBN 978‑80‑7345‑507‑1.
- Vašáková M. Idiopathic pulmonary fibrosis: Does the time for change of diagnostic and therapeutic recommendations come? Čas Lék čes 2018;157:237–243.
- Selman M, Pardo A. When things go wrong: Exploring possible mechanisms driving the progressive fibrosis phenotype in interstitial lung diseases. Eur Respir J 2021:2004507.
- Meyer KC. Immunosuppressive agents and interstitial lung disease: what are the risks? Expert Rev Respir Med 2014;8:263–266.
- Gersten RA, Moale AC, Seth B, et al. A scoping review of palliative care outcome measures in interstitial lung disease. Eur Respir Rev 2021;30:210080.