Jak léčit pacienty s kognitivními obtížemi po prodělání nemoci covid‑19
Nedávný průzkum v ordinacích českých lékařů ukázal potřebu věnovat zvýšenou pozornost pacientům, kteří prodělali nemoc covid‑19 a trpí příznaky postcovidového syndromu, jež zahrnují i poruchy kognitivních funkcí. O nemoci covid‑19 je kromě mnoha dalších skutečností známo, že spouští aktivaci transkripčního faktoru NF‑κB v buňkách. Ten vede k produkci a uvolňování velkého množství cytokinů s prozánětlivým a destrukčním charakterem. To je doprovázeno změnami koagulace, trombózami a dysfunkcí endotelu. Vinpocetin je řadu desetiletí úspěšně využíván k léčbě zhoršené cerebrovaskulární perfuze a symptomů s tím souvisejících, včetně kognitivních poruch. Zlepšuje průtok krve mozkem, má neuroprotektivní účinky a v posledních letech se využívá i jeho protizánětlivý účinek, který spočívá právě v inhibici transkripčního faktoru NF‑κB cestou IKK komplexu.
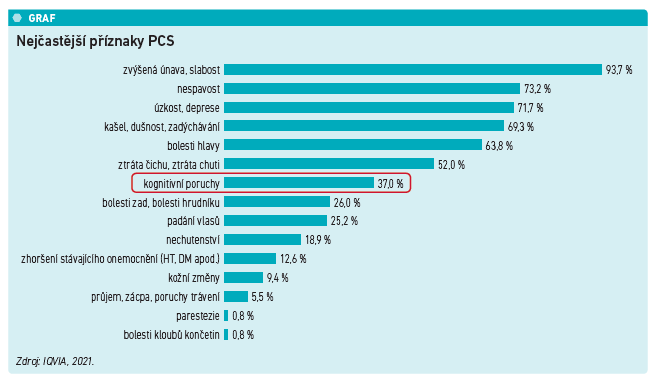
Koncem roku 2021 proběhl průzkum v ordinacích českých praktických lékařů, neurologů a psychiatrů, jehož cílem bylo zjistit, jaké následky po prodělání onemocnění covid‑19 se u jejich pacientů vyskytují. Ukázalo se, že všichni dotazovaní lékaři se ve své praxi setkávají s postcovidovým syndromem (PCS), a to v průměrné četnosti devět až deset případů za měsíc. Nejčastějšími příznaky, na které si pacienti s PCS stěžují, jsou zvýšená únava, slabost, nespavost, úzkost a deprese (viz graf) (1). Avšak z průzkumu je patrné, že zvýšená pozornost by měla být věnována i pacientům, kteří trpí poruchami kognitivních funkcí. Tímto psychoneurologickým projevem postcovidového syndromu trpí až v 37 procentech případů. Současně až 75 procent lékařů vnímá léčbu tohoto symptomu jako „nenaplněnou potřebu“ – rádi by těmto svým pacientům pomohli, ale nevědí jak.
Na onemocnění covid‑19 je stále častěji nazíráno nikoli pouze prismatem akutní rizikovosti ve vztahu k respiračnímu systému, nýbrž také prismatem zahrnujícím zasažení jiných orgánů a orgánových soustav, ke kterým dochází v pozdější fázi. Tedy ve fázi, kdy virus již v organismu není přítomen, ale zánětlivé procesy, které nastartoval, ano. Mezi mnohými je akcentováno úzké napojení na nervovou soustavu. To není až tak překvapivé, jestliže si uvědomíme, že koronaviry patří k neurotropním virům, tj. mají výraznou afinitu k nervové soustavě. To ostatně potvrzuje nedávná studie prokazující neuroinvazi SARS‑CoV‑2 v lidských buněčných kulturách i v mozcích pitvaných zemřelých (2).
Virus SARS‑CoV‑2 po překonání anatomických a chemických obranných bariér hostitelského organismu a po vazbě svého povrchového S‑proteinu na receptor enzymu konvertujícího angiotensin 2 (ACE2) vstupuje do hostitelské buňky. Jakmile se virus dostane do cytoplazmy, unikne reakci přirozené imunity buď uvolněním aktivity virové endoribonukleázy (RNázy), nebo vytvořením replikačních organel v membránách hostitelských buněk, které zabraňují rozpoznání virové RNA. Během inkubační doby se replikují virové genomy, zatímco se aktivuje vrozená imunitní odpověď hostitele, která zahrnuje syntézu a uvolňování cytokinů. Zánětlivé markery (interleukiny IL‑2, IL‑6, IL‑7, IL‑10 a IL‑18, interferon IFNγ, monocytový chemoatraktantní protein 1 [MCP‑1], MCP‑3 či makrofágový zánětlivý protein‑1α) jsou pozitivně spojeny se závažností symptomů; koncentrace IL‑6 či tumor nekrotizujícího faktoru TNFα mohou sloužit jako ukazatele závažnosti onemocnění a prediktory přežití (3).
Výše zmíněná neurotropie SARS‑CoV‑2 může vést k insuficienci kognitivních funkcí, jejichž podkladem je mj. právě zmíněná zánětlivá reakce doprovázená i změnami koagulace a dysfunkcí endotelu. V prevenci a zejména pak i léčbě postcovidového syndromu s vyznačenou neuropsychiatrickou symptomatikou se nabízí možnost využití léčivých látek s neuroprotektivními vlastnostmi. Jakkoli pro cílené doporučení alespoň prozatím postrádáme důkazy přínosu z prospektivních randomizovaných klinických studií, vlastnosti a mechanismy účinků alespoň některých zástupců (např. vinpocetin) naznačují racionální zdůvodnění pro jejich cílené využití u takto nemocných (4).
Vinpocetin byl poprvé syntetizován v roce 1975. Průmyslová výroba byla zahájena o tři roky později maďarskou farmaceutickou společností Gedeon Richter. Vinpocetin zlepšuje průtok krve mozkem a má neuroprotektivní účinky. V zemích střední a východní Evropy je již řadu desetiletí úspěšně využíván k léčbě cerebrovaskulárních poruch a zhoršené paměti související s věkem.
Vinpocetin snadno prochází skrz hematoencefalickou bariéru, díky čemuž nachází své klinické využití v prevenci a léčbě neurologických či psychiatrických onemocnění, jako jsou iktus, poruchy paměti či demence. Vinpocetin pod obchodním názvem Cavinton byl původně vyvinut a uveden na trh v Maďarsku koncem 70. let minulého století, přičemž od té doby je bohatě využíván prakticky po celém světě.
Farmakologické poznámky
Doporučená denní dávka pro dosažení požadovaného terapeutického efektu je 3× 10 mg perorálně, z důvodu relativně krátkého biologického poločasu (1 až 2 hodiny) (5,6). Po užití se snadno vstřebává z gastrointestinálního traktu (7) a rovněž dobře proniká skrz hematoencefalickou bariéru (8). Vrcholových plazmatických koncentrací je dosahováno již přibližně za 1 hodinu (6,9). Distribuční objem (Vd) má hodnotu 3,2 ± 0,9 l/kg, což odráží jeho vysokou distribuci ve tkáni (5). Vinpocetin je rychle a rozsáhle metabolizován především na svůj deesterifikovaný derivát, kyselinu apovinkaminovou a další minoritní metabolity. Celková plazmatická clearance vinpocetinu je 0,88 ± 0,20 l/h/kg (7). Obecně platí, že v terapeutických dávkách má vinpocetin lineární farmakokinetiku, čímž v podstatě nedochází k akumulaci léčiva (6).
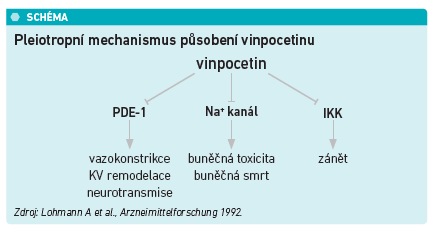
Mechanismus účinku vinpocetinu lze bez nadsázky označit jako pleiotropní. Jedním z jeho farmakologických cílů je fosfodiesteráza 1 (PDE‑1) katalyzující degradaci cAMP a/nebo cGMP (má vyšší afinitu k podtypům PDE‑1A/1B než k PDE‑1C). Důsledkem je potlačená vazokonstrikce, kardiovaskulární remodelace a zlepšení neurotransmise. Působí rovněž jako blokátor napěťově závislých Na+ kanálů, a to s hodnotou inhibiční koncentrace IC50 10–50 µM. Zřejmou souvislostí je pak nižší buněčná zátěž, respektive snížení rizika apoptózy. Nedávné studie odhalily další účinky vinpocetinu, včetně účinku protizánětlivého, který je realizován jeho inhibičním vlivem na kinázu IκB (IKK) s hodnotou IC50 již kolem 17 µM. Tato kináza hraje klíčovou roli v mediaci buněčných zánětlivých reakcí. Její inhibice tak zmírňuje zánětlivou reakci (viz schéma) (10).
Vinpocetin a nervový systém
Vinpocetin byl původně určen pro léčbu neurologických onemocnění spojených s cerebrovaskulárními poruchami, jako jsou cévní mozková příhoda a demence. V prvním a velmi často i druhém případě se výrazně patofyziologicky uplatňuje ischémie, a není proto příliš překvapivé opakované zjišťování přínosu vinpocetinu u stavů charakterizovaných ischémií mozku, a to jak na preklinické (11), tak i klinické (12,13) úrovni.
Od doby, kdy prvně vstoupil do klinického užití, byl vinpocetin rovněž úspěšně podáván i u řady dalších neurologických degenerativních onemocnění. Příkladem jsou Parkinsonova choroba, Huntingtonova choroba a demence Alzheimerova typu. V mozku vinpocetin významně zlepšuje průtok krve tím, že působí jako cerebrální vazodilatátor a podporuje cerebrální metabolismus facilitací příjmu a zvýšenou utilizací kyslíku a glukózy, stimulací neuronální produkce ATP. V řadě neuronových buněk nebo nervových zakončení bylo také prokázáno, že vinpocetin působí dokonce jako antioxidant a zabraňuje neurotoxickému působení vápníku a sodíku (10).
Zřejmým důsledkem uvedených dílčích účinků vinpocetinu je dosažení neuroprotekce. Ta je výslednicí jeho vazodilatačního působení na cévy na straně jedné a přímého ovlivnění neuronů či buněk glie na straně druhé. Kromě toho obdobně protektivně působí rovněž u jiných stavů souvisejících s ischémií, zejména pak při postižení sítnice (14), jater (15), ledvin (16) a kůže (17).
Vzhledem k tomu, že covid‑19 může vyvolat rozvoj a zesílení endoteliální dysfunkce, koagulopatie a trombózy, zdá se, že vinpocetin by mohl být při léčbě takových stavů přínosem. Ostatně nasvědčují tomu i závěry menší klinické studie (n = 20) s kardiovaskulárně nemocnými pacienty, u kterých léčba vinpocetinem statisticky významně snižovala koncentraci von Willebrandova faktoru (ukazatel endoteliální dysfunkce) i agregaci trombocytů indukovanou kyselinou arachidonovou. Tyto účinky byly pozorovány již 7. den terapie a přetrvávaly 30 dní po léčbě. Po 30 dnech bylo navíc pozorováno i signifikantní zlepšení deformability erytrocytů (18).
Protizánětlivé vlastnosti vinpocetinu
Dnes jsou tak již dobře zmapovány protizánětlivé účinky vinpocetinu na úrovni endoteliálních buněk, buněk vaskulárního hladkého svalstva, monocytů a makrofágů, neutrofilů, epiteliálních buněk, mikroglie a dendritických buněk (19–21). Zprostředkovány jsou přímou inhibicí aktivity IKK vedoucí k vazbě IκB s NF‑κB a následnému potlačení exprese mediátorů zánětu, které přetrvávají i poté, co byl virus eliminován z organismu.
Z perspektivy běžné klinické praxe je důležité, že tento protizánětlivý účinek vinpocetinu byl popsán i v multicentrické studii zahrnující 60 nemocných s okluzí v přední části Willisova okruhu a rozvíjejícím se iktem mozkové cirkulace a nástupem mrtvice (22). Pacienti léčení vinpocetinem měli nejen lepší obnovu neurologických funkcí a zlepšené klinické výsledky, ale též sníženou aktivaci signalizace NF‑κB a expresi prozánětlivých mediátorů. Profit z takovéto léčby je možné logicky očekávat i u stavů spojených s poklesem kognitivních funkcí navozeným zánětem či infekcí, včetně diskutovaného onemocnění covid‑19 či u postcovidového syndromu (4). To ostatně potvrzuje i recentní klinická studie čítající 97 nemocných s diagnostikovaným long‑covidem. Její autoři zmiňují výrazné zlepšení symptomatiky nemocných při léčbě vinpocetinem v kombinaci s protizánětlivě působícím aceklofenakem (23).
Závěr
Výše popsané skutečnosti jasně dokládají pestrou paletu účinků vinpocetinu ve vztahu k nervovému systému. Současně však přibývají i důkazy o jeho kladném vlivu na kardiovaskulární systém a funkce endotelu cév. Vinpocetin tak nemá jediný unikátní cíl, působí pleiotropně.
Jeho vícečetné působení, včetně vazodilatace, antioxidace, protizánětlivého působení, antitrombotických vlastností a zlepšení reologických vlastností krve, působí terapeuticky synergicky, čímž pokrývá multifaktoriálně podmíněná cerebrovaskulární a kardiovaskulární onemocnění.
Schopnost vinpocetinu přerušit zánětlivou reakci výše popsanou cestou inhibice IKK komplexu, která přetrvává u některých pacientů s prodělaným onemocněním covid‑19 i dlouhé týdny po odeznění infekce (kdy má zánět prokazatelně již destrukční charakter), je v tomto časovém úseku žádoucí. Tato fáze zánětu má zcela opačný účinek než zánět aktivovaný na začátku infekce virem SARS‑CoV‑2, kdy má ochrannou roli.
Literatura
- IQVIA, 2021.
- Song E, Zhang C, Israelow B et al. Neuroinvasion of SARS‑CoV‑2 in human and mouse brain. J Exp Med. 2021 Mar 1;218(3):e20202135.
- Del Valle DM, Kim‑Schulze S, Huang HH et al. An inflammatory cytokine signature predicts COVID‑19 severity and survival. Nat Med. 2020 Oct;26(10):1636–1643.
- Golovacheva VA, Tabeeva GR, Kuznetsov IV. Cognitive impairment in COVID‑19: associations, pathogenesis and treatment questions. Neurology, Neuropsychiatry, Psychosomatics. 2021;13(2):123–129.
- Miskolczi P, Vereczkey L, Szalay L et al. Effect of age on the pharmacokinetics of vinpocetine (Cavinton) and apovincaminic acid. Eur J Clin Pharmacol. 1987;33(2):185–189.
- Miskolczi P, Kozma K, Polgár M et al. Pharmacokinetics of vinpocetine and its main metabolite apovincaminic acid before and after the chronic oral administration of vinpocetine to humans. Eur J Drug Metab Pharmacokinet. 1990 Jan‑Mar;15(1):1–5.
- Vereczkey L. Pharmacokinetics and metabolism of vincamine and related compounds. Eur J Drug Metab Pharmacokinet. 1985 Apr–Jun;10(2):89–103.
- Polgár M, Vereczkey L, Nyáry I. Pharmacokinetics of vinpocetine and its metabolite, apovincaminic acid, in plasma and cerebrospinal fluid after intravenous infusion. J Pharm Biomed Anal. 1985;3(2):131–139.
- Lohmann A, Dingler E, Sommer W et al. Bioavailability of vinpocetine and interference of the time of application with food intake. Arzneimittelforschung. 1992 Jul;42(7):914–917.
- Zhang YS, Li JD, Yan C. An update on vinpocetine: New discoveries and clinical implications. Eur J Pharmacol. 2018;819:30–34.
- Jincai W, Tingfang D, Yongheng Z. Effects of vinpocetine and ozagrel on behavioral recovery of rats after global brain ischemia. J Clin Neurosci. 2014 Apr;21(4):661–663.
- Zhang W, Huang Y, Li Y et al. Efficacy and Safety of Vinpocetine as Part of Treatment for Acute Cerebral Infarction: A Randomized, Open‑Label, Controlled, Multicenter CAVIN (Chinese Assessment for Vinpocetine in Neurology) Trial. Clin Drug Investig. 2016 Sep;36(9):697–704.
- Bönöczk P, Panczel G, Nagy Z. Vinpocetine increases cerebral blood flow and oxygenation in stroke patients: a near infrared spectroscopy and transcranial Doppler study. Eur J Ultrasound. 2002 Jun;15(1–2):85–91.
- Nivison‑Smith L, Khoo P, Acosta ML et al. Pre‑treatment with vinpocetine protects against retinal ischemia. Exp Eye Res. 2017 Jan;154:126–138.
- Zaki HF, Abdelsalam RM. Vinpocetine protects liver against ischemia‑reperfusion injury. Can J Physiol Pharmacol. 2013 Dec;91(12):1064–1070.
- Fattori V, Borghi SM, Guazelli CFS et al. Vinpocetine reduces diclofenac‑induced acute kidney injury through inhibition of oxidative stress, apoptosis, cytokine production, and NF‑κB activation in mice. Pharmacol Res. 2017 Jun;120:10–22.
- Xiao‑Xiao T, Sen‑Min W, Ding‑Sheng L. Effects of vinpocetine on random skin flap survival in rats. J Reconstr Microsurg. 2013 Jul;29(6):393–398.
- Feher G, Csecsei P, Papp J et al. The Role of Adjuvant Vinpocetine Therapy in Aspirin‑Treated Cerebrovascular Patients. J Cardiol Ther. 2020;7(1):942–945.
- Jeon KI, Xu X, Aizawa T. Vinpocetine inhibits NF‑kappaB‑dependent inflammation via an IKK‑dependent but PDE‑independent mechanism. Proc Natl Acad Sci U S A. 2010 May 25;107(21):9795–9800.
- Ruiz‑Miyazawa KW, Pinho‑Ribeiro FA, Zarpelon AC et al. Vinpocetine reduces lipopolysaccharide‑induced inflammatory pain and neutrophil recruitment in mice by targeting oxidative stress, cytokines and NF‑κB. Chem Biol Interact. 2015 Jul 25;237:9–17.
- Feng X, Wang Y, Hao Y et al. Vinpocetine Inhibited the CpG Oligodeoxynucleotide‑induced Immune Response in Plasmacytoid Dendritic Cells. Immunol Invest. 2017 Apr;46(3):263–273.
- Zhang F, Yan C, Wei C et al. Vinpocetine Inhibits NF‑κB‑Dependent Inflammation in Acute Ischemic Stroke Patients. Transl Stroke Res. 2018 Apr;9(2):174–184.
- Samartsev IN, Zhivolupov SA, Butakova JS et al. [The open observational study of aceclofenac and vinpocetine effectiveness and tolerability in treatment of patients with chronic cerebrovascular disease after COVID‑19 (AQUA study)]. Zh Nevrol Psikhiatr Im S S Korsakova. 2021;121(11):s1–s8.