Konzervativní léčba osteoartrózy velkých kloubů
Neoperační terapie osteoartrózy velkých kloubů by měla být interdisciplinární kategorií, která pacientovi s touto diagnózou přináší komplexní postup prevence a léčby dle jeho individuálních potřeb. Neleží tedy jen v rukou ortopedů a optimálně kombinuje lokální i systémovou farmakoterapii, rehabilitaci či doporučení pro racionální fyzické aktivity, dietní opatření a určité metody fyzikální terapie.
Úvod
Osteoartróza (OA) je multifaktoriální, chronické a primárně nezánětlivé onemocnění synoviálních kloubů. Komplexní degenerativní, remodelační, a nakonec i zánětlivé procesy vedou nejen k nevratné destrukci kloubní chrupavky a ke změnám subchondrální kosti, jako je osteoskleróza, ale i ke vzniku kostních cyst a k formaci osteofytů (kostní výrůstky při okrajích kloubních ploch). Tyto změny v důsledku vyústí v dysfunkci a hypomobilitu kloubu s případným rozvojem kontraktur či atrofie okolního svalstva.1 OA představuje onemocnění kloubů s celosvětově nejvyšší prevalencí a nejčastěji postihuje kloub kolenní, dále pak klouby ruky, kyčel, páteř a poté klouby ostatní. Ačkoli aktuální statistiky pro Českou republiku k dispozici nemáme, studie z okolních států ukazují, že obecně OA častěji postihuje ženy (ve věku nad 18 let s prevalencí 22 % u žen a 14 % u mužů). V populaci starší 65 let je sužována projevy OA až polovina žen a třetina mužů. Gonartróza (OA kolenního kloubu) je pak u žen zdaleka nejčastější.2,3
Dělení a patogeneze
Z hlediska etiologie rozeznáváme častěji se vyskytující OA primární bez známé příčiny a poté OA sekundární, která vzniká jako následek známé mechanické, biologické či kombinované patologie. Za vznikem sekundární OA mohou stát traumata (chondrální poranění, intraartikulární či periartikulární fraktury nebo poškození dalších struktur kloubu, jako jsou menisky, vazy či labra), vrozené a vývojové vady (DDH – vývojová dysplazie kyčelního kloubu), systémová onemocnění (revmatoidní artritida, reaktivní artritida), aseptické nekrózy (m. Perthes) a další.
Pro lepší představu zmiňme alespoň schematicky fyziologické uspořádání hyalinní chrupavky, jež pokrývá artikulační plochy kostí a sestává z chondrocytů (do 5 % hmotnostního podílu), které propojuje strukturální síť extracelulární matrix (ECM). Hlavní vláknitou složkou ECM je kolagen (z 90 % jde o kolagen typu II) a s ním spojené proteoglykany (10% kyselina hyaluronová + aggrecan – dominantně tvořen chondroitin sulfátem). Takto uspořádaná ECM je pak schopna vázat vodu, a to v podílu až 75 % z celkové hmoty hyalinní chrupavky. Zdravá hyalinní chrupavka v biomechanicky správně fungujícím kloubu zajišťuje hladkost pohybu a díky dostatečné elasticitě přispívá k absorpci sil při zatížení a nárazech.4
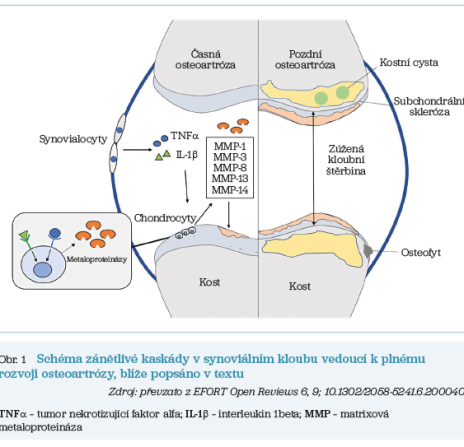 Ať už je příčina vzniku a rozvoje OA jakákoli, literatura podporuje tezi, že je provázena destruktivním zánětlivým cyklem při převaze degradace chrupavky nad její novotvorbou. Tento cyklus je řízen prozánětlivými cytokiny, jako je například interleukin 1beta (IL‑1β), či tumor nekrotizujícím faktorem alfa (TNFα). Přičemž tyto a další cytokiny a katabolické enzymy hrají kritickou roli při degradaci ECM chrupavky zvýšením produkce matrixových metaloproteináz (MMPs) v chondrocytech s potenciálem ke štěpení kolagenu v ECM. Tento rozpad ECM iniciuje zánětlivou odpověď na úrovni chrupavky i synovie (výstelka kloubu) a podporuje smyčku pozitivní zpětné vazby, v níž zánětlivé cytokiny indukují další poškození tkáně, které pak stimuluje produkci dalších zánětlivých cytokinů. To má za následek progresivní degeneraci chrupavky a pokročilou OA spojenou s reparací chrupavky pro tuto lokalitu méněcenným kolagenem typu I, posléze i s reaktivními změnami na úrovni subchondrální kosti (osteofyty, osteoskleróza, cysty, obr. 1).1
Ať už je příčina vzniku a rozvoje OA jakákoli, literatura podporuje tezi, že je provázena destruktivním zánětlivým cyklem při převaze degradace chrupavky nad její novotvorbou. Tento cyklus je řízen prozánětlivými cytokiny, jako je například interleukin 1beta (IL‑1β), či tumor nekrotizujícím faktorem alfa (TNFα). Přičemž tyto a další cytokiny a katabolické enzymy hrají kritickou roli při degradaci ECM chrupavky zvýšením produkce matrixových metaloproteináz (MMPs) v chondrocytech s potenciálem ke štěpení kolagenu v ECM. Tento rozpad ECM iniciuje zánětlivou odpověď na úrovni chrupavky i synovie (výstelka kloubu) a podporuje smyčku pozitivní zpětné vazby, v níž zánětlivé cytokiny indukují další poškození tkáně, které pak stimuluje produkci dalších zánětlivých cytokinů. To má za následek progresivní degeneraci chrupavky a pokročilou OA spojenou s reparací chrupavky pro tuto lokalitu méněcenným kolagenem typu I, posléze i s reaktivními změnami na úrovni subchondrální kosti (osteofyty, osteoskleróza, cysty, obr. 1).1
Diagnostika a léčba
Důležitou roli v diagnostice OA hrají nejen zobrazovací metody a objektivní nález při fyzikálním vyšetření kloubu, ale i symptomy pacienta. Iniciálním příznakem typicky bývá zátěžová bolest, která po snížení námahy a při odpočinku odeznívá nebo reaguje na běžná analgetika. Další progresí dochází k omezení rozsahu pohybu, který je časem doprovázen kloubními drásoty. S celkovými změnami v kloubu je pak spojen otok a někdy přítomnost udávané ztuhlosti s tzv. startovací bolestí – typicky ráno, trvající méně než 30 minut. V konečné fázi pak OA způsobuje i bolesti klidové, často komplikované atrofií svalstva a kontrakturami.1
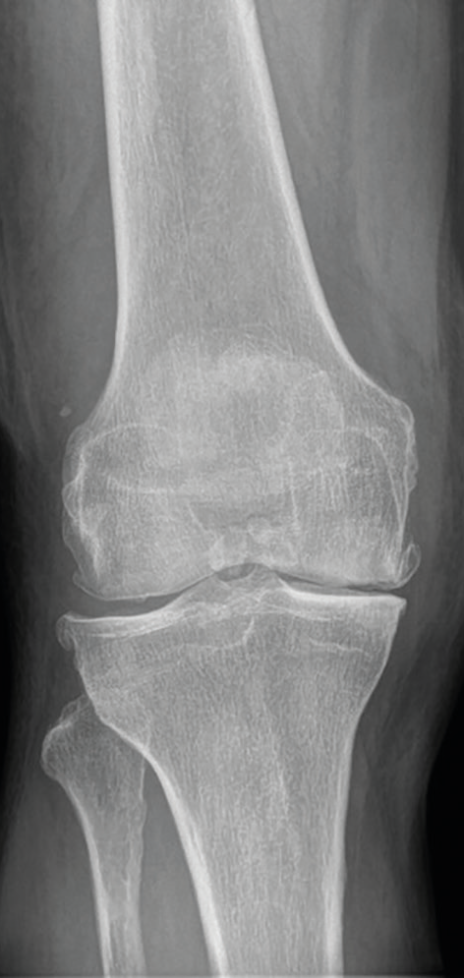 Pro základní zobrazení a posouzení progrese poskytuje rentgenové vyšetření dostatečné informace o šířce kloubní štěrbiny, postavení artikulačních ploch, kvalitě subchondrální kosti a případných cystách či okrajových osteofytech. Je také pilířem radiologické diagnostické klasifikace stupně OA dle Kellgrena a Lawrence z roku 1957 – celkem pět stupňů, grade 0–IV, přičemž za přítomnou je považována OA grade II = s jistou přítomností osteofytů a možným zúžením kloubní štěrbiny.5 Příklad pokročilé gonartrózy ukazují obrázky 2 a 3.
Pro základní zobrazení a posouzení progrese poskytuje rentgenové vyšetření dostatečné informace o šířce kloubní štěrbiny, postavení artikulačních ploch, kvalitě subchondrální kosti a případných cystách či okrajových osteofytech. Je také pilířem radiologické diagnostické klasifikace stupně OA dle Kellgrena a Lawrence z roku 1957 – celkem pět stupňů, grade 0–IV, přičemž za přítomnou je považována OA grade II = s jistou přítomností osteofytů a možným zúžením kloubní štěrbiny.5 Příklad pokročilé gonartrózy ukazují obrázky 2 a 3.
 Sonografické vyšetření (UZ) dovoluje přímo v ortopedické ambulanci detekovat kvantitativně i kvalitativně kolekci tekutiny v kloubu a v určitém rozsahu i hodnotit synoviální výstelku, menisky, kontury chrupavčitých povrchů, kolem kloubní vazy a svalové úpony. Za UZ kontroly lze také provádět specifické dynamické testy různých patologií a provádět sonograficky navigované ortopedické intervence, jako jsou například punkce kloubů či specifická aplikace léčiv.
Sonografické vyšetření (UZ) dovoluje přímo v ortopedické ambulanci detekovat kvantitativně i kvalitativně kolekci tekutiny v kloubu a v určitém rozsahu i hodnotit synoviální výstelku, menisky, kontury chrupavčitých povrchů, kolem kloubní vazy a svalové úpony. Za UZ kontroly lze také provádět specifické dynamické testy různých patologií a provádět sonograficky navigované ortopedické intervence, jako jsou například punkce kloubů či specifická aplikace léčiv.
Magnetická rezonance nám může poskytnout podrobné informace o stavu kloubních povrchů, edému kostní dřeně, synovitidě a abnormalitách měkkých tkání. Výpočetní tomografie oproti tomu umožňuje podrobnější zobrazení kosti při komplikovanějších destrukcích a intraartikulárních zlomeninách.6
Z výše zmíněného vyplývá, že osteoartróza je právem celosvětově velmi diskutovaným multidisciplinárním medicínským tématem a při hledání optimální terapie je třeba nalézt bezpečnou cestu při syntéze dosud dostupných znalostí. O takový konsenzus se snaží nejedna kontinentální či nadnárodní odborná společnost a na poli léčby OA vydává doporučení, např. OARSI – Osteoarthritis Research Society International, AAOS – American Academy of Orthopaedic Surgeons (úroveň doporučení 1–4 body na 4bodové škále), v některých oblastech EFORT – European Federation of National Associations of Orthopaedics and Traumatology – a také řada revmatologických společností.
Samotná terapie
Následující text si klade za cíl připomenout v našich podmínkách dostupné a nejhojněji využívané terapeutické modality a přiblížit míru jejich doporučení v léčbě OA na základě metaanalýz výše zmíněných společností.
Režimová opatření
Dieta a cvičení jsou důležitou součástí komplexní léčby OA ve všech stadiích. U pacientů s nadváhou a obezitou s osteoartrózou kolenního kloubu bylo prokázáno, že hubnutí zmírňuje bolest a v menší míře zvyšuje funkci kloubu. Ačkoli existují určité důkazy, že cvičení může být pro dosažení tohoto úbytku hmotnosti lepší než dieta, preferovaným přístupem je použití diety a cvičení současně.7 Doporučení vhodného cvičení je třeba přizpůsobit individuálním možnostem pacienta s cílem dlouhodobé adherence k nastavené terapii. Mělo by probíhat pravidelně a nepřetěžovat postižený segment. Jde o cvičení aerobní, silová různé intenzity, balanční a další. Přínosem by navíc měla být lepší případná perioperační adaptace a zkrácená doba hospitalizace při potřebě operačního řešení OA.8 Z vlastní praxe shledáváme pouze minimální ochotu pacientů k přijetí této části navržené terapie.
Rehabilitace a fyzikální metody
Léčebná rehabilitace může představovat navazující nebo nahrazující krok k individuálně provozovanému cvičení u pacientů s výrazně sníženými pohybovými možnostmi a nižší motivací. Cílem je zlepšení či udržení rozsahu pohybu, svalové síly a prevence kontraktur, na což se zaměřuje zejména funkční pohybová terapie ve formě fyzioterapie a ergoterapie. Fyzikální rehabilitační metody lze uplatnit pro úlevu od bolestí, čehož je dosaženo například magnetoterapií, terapií léčebným ultrazvukem či elektroterapií.
Farmakologická léčba
I přes pokrok v pochopení patogeneze OA na enzymatické úrovni a probíhající výzkum není zatím plošně dostupné efektivní léčivo cíleně zasahující do zánětlivé kaskády a zastavující progresi OA.
Analgetika, nesteroidní protizánětlivé léky (NSAID)
Perorální NSAID zůstávají hlavním pilířem farmakologické léčby OA a jejich použití se napříč odbornými společnostmi doporučuje. Velký počet studií prokázal jejich krátkodobou účinnost. Perorální NSAID jsou počáteční medikací volby bez ohledu na anatomickou lokalizaci. V souladu se zásadou, že vhodnější jsou léky s nejmenší systémovou expozicí (tj. lokální léčba), je třeba před použitím perorálních NSA zvážit lokální NSAID, jež u pacientů s OA kolene prokázaly mírné zlepšení v průběhu 12 týdnů.10
Zvýšené pozornosti je třeba u pacientů s přidruženými gastrointestinálními obtížemi, u kterých se doporučují selektivní inhibitory COX‑2 či doplnění terapie o inhibitory protonové pumpy. Nesteroidní antirevmatika kterékoli třídy se nedoporučují pacientům s relevantními kardiovaskulárními (KV) komorbiditami kvůli důkazům o spojitosti užívání NSAID se zvýšením KV rizika.11 V případě kontraindikace užívání NSAID se doporučuje pro tlumení bolesti a zlepšení funkce paracetamol (doporučení úrovně 4/4 dle gudelines AA0S).7
SYSADOA
Přípravky dříve označované jako chondroprotektiva jsou charakterizovány jako „symptomaticky pomalu působící léky proti OA (Symptomatic Slow Acting Drugs in Osteoarthritis)”. Jedná se o látky na přírodní bázi nebo látky tělu vlastní. Schéma užívání je obvykle 2–3 měsíce následované pauzou, přičemž společnou výhodou je bezpečnost a tzv. carry‑over efekt, kdy účinek trvá i po vysazení léčby.11 Nejpoužívanějšími zástupci účinných látek jsou u SYSADOA glukosamin sulfát (GS) a chondroitin sulfát (CS). Specifickou kategorii tvoří léky jako Piascledine (nezmýdelnitelný olej ze sóji a avokáda) a Diacerein, které deklarují efekt na úrovni základních patogenetických drah OA.
GS i CS mají po inkorporaci do hyalinní chrupavky schopnost vázat vodu a udržovat tak její elastické vlastnosti. Někteří zástupci SYSADOA jsou v České republice registrováni jako léky, ačkoli se vyskytují i v řadě doplňků stravy. Studie in vitro a následně rovněž in vivo, kde je však hodnocení chrupavky obtížné, naznačovaly u těchto léků vlastnosti nemoc modifikujícího léku (snížení degradace chrupavky a zvýšení biosyntézy proteoglykanů a kolagenu). Nevýhodou této lékové skupiny je recentní zpochybňování účinků metaanalýzami a s tím spjaté snížení úrovně doporučení v léčbě OA na 2/4 dle guidelines AAOS.9,10
Nitrokloubní aplikace terapeutik
Injekční intraartikulární podávání léčivých přípravků je další rozšířenou modalitou léčby OA poskytovanou v ortopedických ambulancích. Obvyklou lokalitu tvoří kloub kolenní, klouby ruky, méně pak kyčelní kloub, kde je silně doporučována aplikace pod ultrazvukovou kontrolou.9
Kyselina hyaluronová (HA)
Jedná se o tělu vlastní látku, která spolu s chondroitin sulfátem a keratan sulfátem tvoří proteoglykanové agregáty a vytváří v chrupavkách síť pro kolagen typu II a podobně jako GS a CS váže vodu a přispívá tak k hydrataci kloubu. Mimoto se nachází i v synoviální tekutině, kde přispívá ke správné lubrikaci a tím i ke správné funkci kloubu. Pro léčbu OA existuje řada variant HA s rozdíly v molekulové hmotnosti a typu chemických vazeb, přičemž studiemi nebyl prokázán signifikantní rozdíl v jejich účinnosti. Zmíněná kyselina se aplikuje injekčně přímo do kloubu (intraartikulárně). Tzv. viskosuplementace kyselinou hyaluronovou má zajistit opětovné obnovení viskoelastické vlastnosti nitrokloubní tekutiny a dle některých autorů také indukovat i endogenní tvorbu HA. Oproti intraartikulárně instilovanému kortikosteroidu vykazuje HA delší trvání úlevy od bolestí (neplatí pro kyčelní kloub) a může mít příznivé účinky na bolest po 12 týdnech léčby a po ní a příznivější dlouhodobý bezpečnostní profil.10 V ČR je HA standardně aplikována u pacientů s OA grade II a III dle Kellgrena a Lawrence (částečná úhrada zdravotní pojišťovnou u kolenního kloubu, nicméně lze při plné úhradě pacientem léčbu využít s vynikajícím efektem i při nižším stupni OA). Podobně jako u SYSADOA je i účinek HA recentními studiemi z důvodu nedostatečné evidence či bias zpochybňován. Při léčbě OA kyčelního kloubu převládá názor, že intraartikulární aplikace kortikosteroidů představuje účinnější kontrolu symptomů.7,10,12
Kortikosteroidy
Aplikujeme je do kloubu s cílem potlačit zánětlivou reakci. Intraartikulární injekce glukokortikoidů se doporučují u pacientů s OA kolene a/nebo kyčle a podmíněně se doporučují u pacientů s OA ruky – spíše pro nedostatečné výsledky studií z této anatomické oblasti.9 Oproti kyselině hyaluronové vykazují kortikosteroidy kratší dobu účinku, na druhou stranu efekt nastupuje časněji a jsou terapií volby u exacerbací OA. Vzhledem k možnému riziku poškození hyalinní chrupavky a subchondrální kosti při časté intraartikulární aplikaci je doporučená četnost čtyři injekce ročně s minimálním odstupem mezi aplikacemi alespoň šest týdnů. I z tohoto důvodu snížil AAOS míru svého doporučení na úroveň 3 ze 4.9
Hydrolyzovaný kolagen
Zástupce novější, diskutované a v ČR na některých pracovištích prováděné metody nitrokloubní léčby OA. Kolagen je hlavní strukturální protein v lidském těle, představuje hlavní složku pojivové tkáně a pro aplikaci se využívá v hydrolyzované podobě (tedy rozštěpený na menší řetězce). Výsledky aktuální přehledové studie ukázaly, že intraartikulární aplikace kolagenu může představovat platnou terapeutickou možnost pro OA kolene.13 Bylo zjištěno, že použití kolagenu typu I jako intraartikulární léčby OA kolene je nejen účinné, ale také bezpečné se zanedbatelnými vedlejšími účinky. Nejvyššího efektu bylo dosaženo u gonartrózy grade II–III dle Kellgrena a Lawrence. Dle některých autorů i při sledování pacientů po dobu 60 měsíců.13
Kondiciovaná krevní plazma
V našich podmínkách je to nejčastěji plazma obohacená krevními destičkami (PRP – Platelet Rich Plasma). Tato terapie spočívá ve zpětné intraartikulární aplikaci vlastní krevní plazmy, bohaté na krevní destičky a v některých případech ještě obohacené o další aktivní látky. Tato terapie není v současné době hrazena prostředky veřejného zdravotního pojištění a představuje možnou léčbu doplňkovou, a to jak pro nitrokloubní, tak pro extraartikulární patologie. Efekt této terapie je, ostatně jako u všech předchozích modalit, cílem řady výzkumů a studií. Podle některých prací je jistý efekt prokazatelný, jiné práce jej srovnávají s efektem placeba.14
Závěr
Ačkoli se zdá být patogeneze OA z velké části rozklíčována a celosvětově je dlouhodobě na studium OA a její terapie vynakládáno velké úsilí, dostupnou kauzální léčbu zatím neznáme. V současné době žádná léčba nemůže prokazatelně změnit průběh OA a terapie je zaměřena zejména na ovlivnění rizikových faktorů, zmírnění bolesti, zlepšení funkce kloubů a celkově kvality každodenního života. Vzhledem k tomu, že operační řešení OA představuje přes pokrok technologií a operačních technik významný zásah do běžného života, je na vzestupu referovaná léčba konzervativní. V závislosti na regionálních zvyklostech naší země se může lišit spektrum nitrokloubních aplikovaných léčiv, doporučovaných perorálních léků, doplňků stravy, či dokonce snaha o dosažení režimových změn v životě našich pacientů. Cílem však zůstává prodloužení intervalu funkčních kloubů našich pacientů s OA s akceptovatelnou symptomatologií.
Literatura
- Loeser RF, Goldring SR, Scanzello CR, Goldring MB. Osteoarthritis: a disease of the joint as an organ. Arthritis Rheum 2012;64:1697–1707. doi: 10.1002/art.34453. Epub 2012 Mar 5. PMID: 22392533; PMCID: PMC3366018.
- Fuchs J, Kuhnert R, Scheidt‑Nave C. 12‑month prevalence of osteoarthritis in Germany. J Health Monit 2017;2:51–56. doi: 10.17886/RKI‑GBE‑2017‑066. PMID: 37168952; PMCID: PMC10165920.
- GBD 2021 Osteoarthritis Collaborators. Global, regional, and national burden of osteoarthritis, 1990‑2020 and projections to 2050: a systematic analysis for the Global Burden of Disease Study 2021. Lancet Rheumatol 2023;5:e508–e522. doi: 10.1016/S2665‑9913(23)00163‑7. PMID: 37675071; PMCID: PMC10477960.
- Miller MD, Thompson SR. Miller‘s review of orthopaedics. 8th edition. 2020, Elsevier Inc.
- Pai V, Knipe H, Rock P, et al. Kellgren and Lawrence system for classification of osteoarthritis. Reference article, Radiopaedia.org
- Park EH, Fritz J. The role of imaging in osteoarthritis. Best Pract Res Clin Rheumatol 2023;37:101866. doi: 10.1016/j.berh.2023.101866. Epub 2023 Aug 31. PMID: 37659890
- American Academy of Orthopaedic Surgeons Management of Osteoarthritis of the Knee (Non‑Arthroplasty) Evidence‑Based Clinical Practice Guideline (3rd Edition). https://www.aaos.org/oak3cpg Published August 31, 2021.
- Deng X, Xu H, Hao X, et al. Effect of moderate exercise on osteoarthritis. EFORT Open Reviews 2023;8:148–161.
- 2019 American College of Rheumatology/Arthritis Foundation Guideline for the Management of Osteoarthritis of the Hand, Hip, and Knee.
- 2019 OARSI guidelines for the non‑surgical management of knee, hip, and polyarticular osteoarthritis, Version of Record 17 October 2019.
- Giordano N, Fioravanti A, Papakostas P, et al. The efficacy and tolerability of glucosamine sulfate in the treatment of knee osteoarthritis: A randomized, double‑blind, placebo‑controlled trial. Curr Ther Res Clin Exp 2009;70:185–196.
- American Academy of Orthopaedic Surgeons Management of Osteoarthritis of the Hip Evidence‑Based Clinical Practice Guideline. https://www.aaos.org/oahcpg2. Published December 1, 2023.
- Tarantino D, Mottola R, Palermi S, et al. Intra‑Articular Collagen Injections for Osteoarthritis: A Narrative Review. Int J Environ Res Public Health 2023;20:4390. doi: 10.3390/ijerph20054390.
- Shahid A, Malik A, Bukhari A, et al. Do Platelet‑Rich Plasma Injections for Knee Osteoarthritis Work? Cureus 2023;15:e34533. doi: 10.7759/cureus.34533. PMID: 36751575; PMCID: PMC9897683.