Léčba pacientů s komorovými arytmiemi a prevence náhlé srdeční smrti ve světle nových doporučení
Úvod
Komorové tachykardie (KT) jsou definovány jako srdeční rytmus, který primárně vychází ze svaloviny komor či z převodního systému pod úrovní Hisova svazku a který má vyšší frekvenci než 100/min. KT zahrnují široké spektrum poruch srdečního rytmu, některé formy mají zásadní klinický význam – mohou vést k oběhové zástavě a náhlé srdeční smrti (NSS). V letošním roce byly publikovány nové postupy Evropské kardiologické společnosti, které se zaměřují na léčbu KT a prevenci NSS.1 Jedná se o komplexní dokument, který aktualizuje předchozí doporučené postupy z roku 2015. Následující přehled uvádí současný pohled na léčbu KT a prevenci NSS s přihlédnutím k novým doporučením.
Diagnostika
Komorové tachykardie lze klasifikovat podle řady kritérií. Nejdůležitější je prognostická klasifikace, která rozlišuje, zda je arytmie u pacienta spojena se zvýšeným rizikem NSS. Nové doporučené postupy předkládají strukturovaný přístup k diagnostice pacientů s různými formami KT: a) náhodný záchyt nesetrvalé KT, b) dokumentovaná monomorfní KT, c) vyšetření u pacientů, kteří prodělali oběhovou zástavu, d) vyšetření prvostupňových příbuzných pacientů, kteří zemřeli na NSS. Cílem těchto vyšetřovacích algoritmů je především rozlišení, zda je u pacienta přítomno strukturální či primární elektrické onemocnění srdce, nebo nikoliv (idiopatické KT). Obecně platí, že idiopatické KT jsou prognosticky benigní. Naopak přítomnost strukturálního onemocnění srdce nebo příčinné mutace pro primární elektrické onemocnění srdce (tzv. kanálopatie) zvyšuje riziko vzniku oběhové zástavy a NSS. Základem vyšetření by měl být odběr anamnézy (včetně rodinné), 12svodové EKG (elektrokardiografie) a echokardiografické vyšetření. Vedle dalších standardních vyšetření, jako je holterovská monitorace EKG, ergometrie či selektivní koronarografie, zdůrazňují doporučené postupy význam zobrazovacích metod (především magnetické rezonance [MR] s podáním gadolinia) a genetického vyšetření. U pacientů po oběhové zástavě zahrnuje diagnostický algoritmus také toxikologické vyšetření, ve vybraných případech také provokační farmakologické testy (např. podání blokátorů sodíkového kanálu při podezření na Brugada syndrom nebo acetylcholinu v případě vazospastické anginy pectoris). Součástí vyšetření by měl být i záznam EKG s umístěním elektrod v horních prekordiálních svodech (diagnostika Brugada syndromu). Invazivní elektrofyziologické vyšetření hraje v současné době v diagnostice a rizikové stratifikaci spíše okrajovou roli, nově se doporučuje jeho provedení ve skupině nemocných s myotonickou dystrofií. V případě NSS je zdůrazněna role soudních lékařů, případně patologů specializujících se na diagnostiku kardiovaskulárních onemocnění. Správně stanovená diagnóza při sekci má zásadní význam při posuzování rizika u příbuzných oběti NSS. Ti by měli být kardiologicky vyšetřeni především v případě podezření na familiární srdeční onemocnění.
Farmakologická léčba KT
V léčbě idiopatických KT jsou doporučeny betablokátory či blokátory vápníkových kanálů. Lze použít i antiarytmika (AA) třídy I, nicméně v této indikaci je účinnější než farmakologická léčba katetrizační ablace. Amiodaron je u pacientů s idiopatickými KT považován za nevhodný jako lék první volby. U pacientů s primárními elektrickými syndromy (syndrom dlouhého QT intervalu – LQT, katecholaminergní polymorfní komorová tachykardie – CPVT) je doporučeno dlouhodobé podávání neselektivních betablokátorů – nadololu či propranololu. Tato léčba je prokazatelně účinnější než podávání selektivních betablokátorů. U syndromu LQT typu 3 je doporučován mexiletin, u CPVT pak flekainid.
U pacientů se strukturálním onemocněním srdce je důležité, aby farmakoterapie srdečního selhání (SS) byla vedena podle současných odborných doporučení.2 Léčba by měla zahrnovat inhibitory angiotenzin konvertujícího enzymu (ACEI), betablokátory (BB) a antagonisty mineralokortikoidních receptorů (MRA). Evidence pro snížení NSS přitom existuje především pro BB a MRA.3,4 Z nových farmak používaných v léčbě SS snižují významně riziko NSS také inhibitory angiotenzinového receptoru a neprilysinu (ARNI). Ve studii PARADIGM‑HF5 vedly ARNI ke snížení rizika úmrtí z kardiovaskulárních příčin a hospitalizace, ale také rizika NSS o 20 %. Podobně příznivý efekt mají inhibitory sodíko‑glukózového kotransportéru 2 (SGLT2). Ve studii DAPA‑HF snížilo přidání dapagliflozinu ke stávající medikaci riziko vzniku klinicky významné KT či NSS o 21 %.6
Antiarytmika jsou u pacientů se srdečním selháním užívána převážně v případě, kdy dochází k opakovaným intervencím kardioverteru‑defibrilátoru (ICD). Dosud nebyl u žádného AA prokázán příznivý efekt na mortalitu. Většina AA má negativně inotropní efekt, který může vést ke zhoršení hemodynamické stability. U AA třídy I bylo navíc u nemocných se strukturálním onemocněním srdce prokázáno zvýšení mortality, které je přisuzováno proarytmickému účinku těchto léčiv.7 V poslední době se však některá AA začala znovu ve specifických případech využívat. Příkladem může být chinidin, který se používá pro léčbu polymorfních KT u nemocných s ischemickou chorobou srdeční,8 dále jako záložní léčba pro jinak refrakterní komorové arytmie.9
Amiodaron je AA třídy III a v současnosti se používá jako primární lék k prevenci recidiv KT u pokročilého SS. Systematická metaanalýza osmi studií10 hodnotící účinek AA ukázala, že amiodaron významně snížil počet adekvátních intervencí ICD (poměr šancí, odds ratio [OR] 0,3, p < 0,001), nikoliv však mortalitu. Je třeba poznamenat, že amiodaron je spojen s násobně vyšším rizikem plicní a tyreoidální toxicity,11 které mohou zvýšit mortalitu.
U některých specifických onemocnění, jako je sarkoidóza12 nebo myokarditida13, může hrát zásadní roli v arytmogenezi zánět a nedílnou součástí terapie by měla být imunosupresivní léčba. Dle současných doporučení je u těchto pacientů vhodné posouzení aktivity zánětu (např. pomocí pozitronové emisní tomografie) a v případě, že je prokázána akutní fáze zánětu, je indikováno podávání imunosupresivní terapie v kombinaci s AA.14
Přístrojová terapie
Z hlediska indikací k implantaci ICD nepřinášejí nové doporučené postupy příliš změn. Obecně je ICD indikován u pacientů s anamnézou hemodynamicky významné setrvalé KT nebo po prodělané oběhové zástavě – tzv. sekundární prevence NSS.15 Ačkoli většina historických studií vylučovala pacienty s předpokládanou reverzibilní příčinou KT, i tito pacienti mají během dalšího sledování vysokou mortalitu a implantace ICD by měla být zvážena.16 Výjimku tvoří pouze nemocní, u kterých došlo k oběhové zástavě v rámci akutního infarktu myokardu.17
Implantace ICD se dnes nejčastěji indikuje v rámci tzv. primární prevence NSS, tedy u pacientů, u nichž ke vzniku maligní KT ještě nedošlo, ale kteří se nacházejí ve vysokém riziku. Jedná se především o nemocné s ejekční frakcí (EF) levé komory sníženou na méně než 35 %. Účinnost ICD v této skupině potvrdilo několik randomizovaných kontrolovaných studií.18–21 Nejspolehlivější důkazy jsou u pacientů s ischemickou kardiomyopatií, naopak výsledky studie DANISH ukázaly, že u pacientů s blíže neurčenou neischemickou kardiomyopatií je přínos vyjádřen méně.22
Obecně platí, že riziková stratifikace NSS postavená výlučně na EF levé komory má řadu úskalí. Zaprvé, riziko NSS se v posledních letech snížilo23 a pouze menšina příjemců ICD bude terapii ICD potřebovat. Dále platí, že absolutní většina případů NSS se vyskytuje nikoli u pacientů se sníženou EF, ale u pacientů se středně sníženou nebo zachovanou EF.24 Proto se hledají nové parametry pro stanovení rizika NSS. Patří mezi ně přítomnost fibrózy identifikované pomocí MR srdce (late gadolinium enhancement), specifické genetické mutace (tj. mutace lamin A/C, fosfolamban, zkrácený filamin nebo mutace SCN5A), nevysvětlitelná synkopa, rodinná anamnéza NSS a další. Obecně je cílem dosáhnout personalizovaného posouzení individuálního rizika. K jeho odhadu mohou pomoci tzv. kalkulátory rizika, které využívají několika vstupních parametrů a jsou dostupné na webu. Tyto kalkulátory jsou specifické pro jednotlivá onemocnění (např. arvcrisk.com pro arytmogenní kardiomyopatii pravé komory, lmna‑risk‑vta.fr pro laminopatie, doc2do.com/hcm pro hypertrofickou kardiomyopatii, 1‑2‑3 Risk calculator pro syndrom dlouhého QT).
Důležitým faktorem, kterému je v doporučených postupech věnována samostatná kapitola a který má zásadní význam pro snížení počtu intervencí ICD a může mít vliv i na prognózu pacienta, je správná programace detekce a terapie KT.25,26 Parametry programace ICD, které účinně snížily výboje a vedly k poklesu mortality, zahrnovaly prodlouženou dobu detekce, použití diskriminačních algoritmů na rozlišení supraventrikulárních a komorových arytmií, detekci ve více zónách a systematické používání antitachykardické stimulace. Vzácně může být implantace ICD spojena se závažnými komplikacemi. Mezi nejčastější patří poškození integrity elektrody, aplikace neadekvátní terapie a infekce kapsy přístroje. Části komplikací souvisejících s transvenózní elektrodou se netýkají subkutánních ICD (S‑ICD). S‑ICD (obr. 1) nemá intravaskulární elektrodu a nemůže dodat antibradykardickou a antitachykardickou stimulaci. Ve studii PRETORIAN, která srovnávala S‑ICD oproti transvenóznímu ICD, byla prokázána pro S‑ICD non‑inferiorita.27 S‑ICD lze proto použít jako alternativu k transvenóznímu ICD v případě, kdy není potřeba kardiostimulace, antitachykardický pacing či resynchronizační terapie.
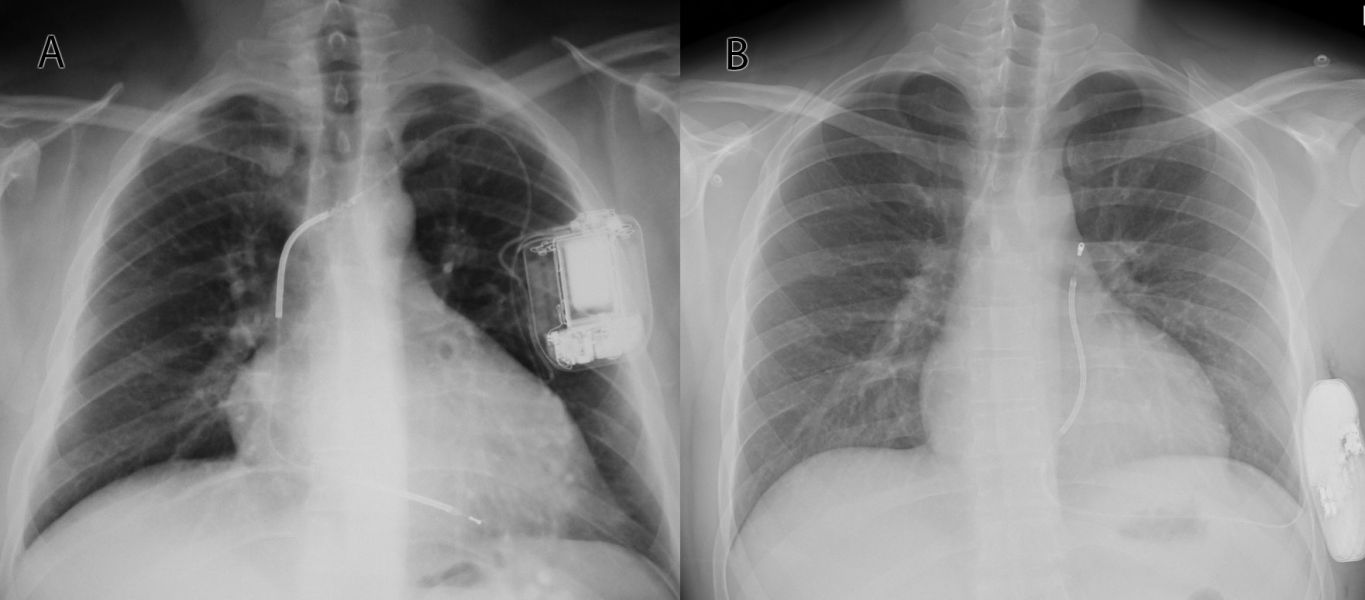
Obr. 1 Skiagram s implantabilním kardioverterem‑defibrilátorem (ICD). Panel A ukazuje konvenční ICD s defibrilační elektrodou implantovanou přes žilní řečiště do hrotu pravé komory. Panel B zobrazuje subkutánní ICD, který je implantován do oblasti střední axilární čáry, elektroda je vedena nad žebry a hrudní kostí v podkoží.
Jinou novou možností je nositelný externí kardioverter‑defibrilátor (wearable ICD). Ačkoli observační studie naznačovaly vysokou účinnost, randomizovaná studie VEST28 u pacientů časně po infarktu myokardu s nízkou ejekční frakcí neprokázala, že by nositelný kardioverter‑defibrilátor dokázal snížit primární endpoint – arytmickou smrt. Zdá se tedy, že jeho použití je vhodné pouze pro vybrané pacienty, kteří jsou považováni za vysoce rizikové pro NSS (např. po extrakci infikovaného zařízení během následné antibiotické léčby).
Katetrizační ablace
U pacientů s idiopatickými formami KT je katetrizační ablace považována za kurativní metodu. Principem je nejčastěji odstranění arytmogenního fokusu (např. ve výtokovém traktu pravé komory), méně často přerušení reentry okruhu (např. u fascikulárních KT). Tato léčba má vynikající akutní i dlouhodobou úspěšnost a je doporučována především pro nemocné s arytmií indukovanou kardiomyopatií.14
U pacientů se strukturálním postižením srdce je základní metodou prevence NSS implantace ICD a ablace je indikována v případě symptomatických KT, které vedou k intervencím ICD (obr. 2). Část pacientů může mít polymorfní KA, které nemají stabilní okruh reentry, ale jsou spouštěny časnými komorovými extrasystolami (KES). Je prokázáno, že úspěšná eliminace spouštěcí ektopie katetrizační ablací může účinně zabránit i recidivám polymorfních KT.29 Stejně tak doporučené postupy doporučují katetrizační ablaci jako metodu léčby u pacientů s monomorfními KT u pacientů po chirurgické korekci Fallotovy tetralogie.
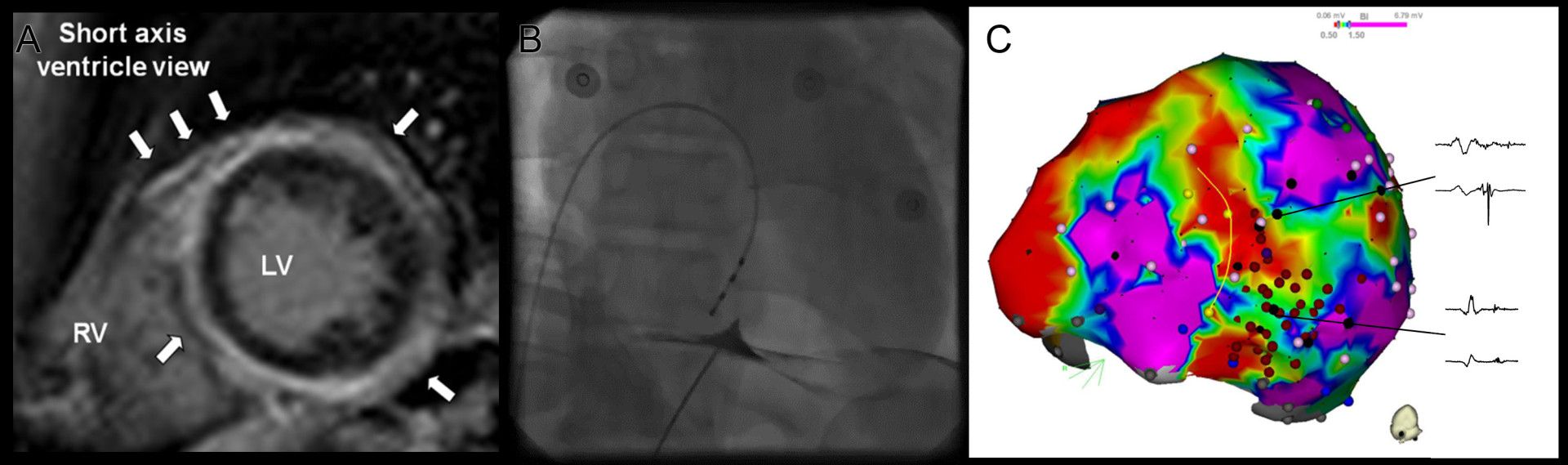
Obr. 2 Příklad epikardiálního mapování a ablace u pacienta s mutací desmoplakinu a neischemickou kardiomyopatií. Panel A znázorňuje obraz z magnetické rezonance s pozdním sycením gadoliniem lokalizovaným dominantně epikardiálně. Endokard není postižen. Panel B ukazuje punkci epikardiálního prostoru pomocí perkutánního subxiphoidního přístupu. Parietální perikard je označen malým množstvím kontrastní látky. Panel C zobrazuje elektroanatomickou voltážovou mapu z inferiorního pohledu. Oblasti s pomalým vedením vzruchu (tzv. pozdní potenciály) byly modifikovány pomocí radiofrekvenční ablace (červené tečky). To vedlo k potlačení inducibility komorových tachykardií.
Arytmická bouře
Zvláštní kapitola doporučených postupů je věnována léčebnému postupu u arytmické bouře. Jedná se o závažný, život ohrožující stav definovaný jako tři nebo více epizod trvalé KT vyskytující se během 24 hodin.30 Arytmická bouře zvyšuje riziko dekompenzace SS, vede k psychickým poruchám a ke zvýšené mortalitě. Často se projevuje jako život ohrožující stav s výraznou elektrickou nestabilitou. Takový průběh arytmické bouře, při kterém lze dosáhnout pouze krátkých úseků stabilního rytmu, vyžaduje rychlý zásah. Léčba musí být komplexní a může zahrnovat reprogramaci ICD, podání antiarytmik, sedaci, katetrizační ablaci, autonomní modulaci a zavedení mechanické podpory oběhu (MCS). Především pro katetrizační ablaci platí, že u pacientů s arytmickou bouří je často život zachraňujícím výkonem. Ukázalo se, že úspěšně provedená ablace je spojena s významným snížením rizika recidiv KT a zlepšeným jednoročním přežitím.31,32 Časnější ablace má potenciál nejen zabránit KT, ale také zlepšit dlouhodobé přežití.33 Proto platí, že práh ke katetrizační ablaci recidivujících KT by měl být v expertním centru nízký.
Nové doporučené postupy z pohledu ambulantního kardiologa
V ambulantní praxi se lékaři s největší pravděpodobností setkají s pacienty s méně závažnými formami KT – nejčastěji s komorovými extrasystolami (KES). V diagnostice je třeba se zaměřit na vyloučení strukturálního onemocnění srdce. Vedle echokardiografie by u KES z atypických lokalizací měla být provedena MR. Ke zhodnocení četnosti ektopie je doporučeno provedení holterovské EKG monitorace. V případě symptomatických či velmi četných KES (více než 10–20 % záznamu) pak selektivní katetrizační ablace. Pro KES z výtokového traktu je katetrizační ablace. V případě KES z výtokového traktu pravé komory je katetrizační ablace metodou první volby. Ablace by také měla být indikována vždy při podezření na ektopií indukovanou kardiomyopatii.
Závěr
Léčba KT a prevence NSS vyžaduje systematický multimodální přístup, který zahrnuje podrobnou diagnostiku základního srdečního onemocnění, farmakoterapii, přístrojovou léčbu a katetrizační ablaci. Recentně vydané doporučené postupy Evropské kardiologické společnosti přinášejí souhrnný přehled současného stavu znalostí o diagnostice a léčbě jednotlivých forem KT a arytmických syndromů. Jejich prostudování lze doporučit všem, kteří se setkávají s pacienty se srdečním onemocněním nebo o tyto nemocné pečují.
Literatura
- Zeppenfeld K, Tfelt‑Hansen J, de Riva M, et al. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J 2022;ehac262.
- McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021;42:3599–3726.
- Al‑Gobari M, El Khatib C, Pillon F, Gueyffier F. β‑Blockers for the prevention of sudden cardiac death in heart failure patients: a meta‑analysis of randomized controlled trials. BMC Cardiovasc Disord 2013;13:52.
- Pitt B, Remme W, Zannad F, et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003; 348:1309–1321.
- McMurray JJV, Packer M, Desai AS, et al. Angiotensin‑neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014;371:993–1004.
- Curtain JP, Docherty KF, Jhund PS, et al. Effect of dapagliflozin on ventricular arrhythmias, resuscitated cardiac arrest, or sudden death in DAPA‑HF. Eur Heart J 2021; 42:3727–3738.
- Cardiac Arrhythmia Suppression Trial (CAST) Investigators: Preliminary report: effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. N Engl J Med 1989;321:406–412.
- Viskin S, Chorin E, Viskin D, et al. Quinidine‑Responsive Polymorphic Ventricular Tachycardia in Patients With Coronary Heart Disease. Circulation 2019;139:2304–2314.
- Li DL, Cox ZL, Richardson TD, et al. Quinidine in the Management of Recurrent Ventricular Arrhythmias: A Reappraisal. JACC Clin Electrophysiol 2021; 7:1254–1263.
- Santangeli P, Muser D, Maeda S, et al. Comparative effectiveness of antiarrhythmic drugs and catheter ablation for the prevention of recurrent ventricular tachycardia in patients with implantable cardioverter‑defibrillators: A systematic review and meta‑analysis of randomized controlled trials. Heart Rhythm 2016;13:1552–1559.
- Piccini JP, Berger JS, O’Connor CM. Amiodarone for the prevention of sudden cardiac death: a meta‑analysis of randomized controlled trials. Eur Heart J 2009;30:1245–1253.
- Papageorgiou N, Providência R, Bronis K, et al. Catheter ablation for ventricular tachycardia in patients with cardiac sarcoidosis: a systematic review. EP Europace 2018; 20:682–691.
- Peretto G, Sala S, Rizzo S, et al. Arrhythmias in myocarditis: State of the art. Heart Rhythm 2019;16:793–801.
- Cronin EM, Bogun FM, Maury P, et al. 2019 HRS/EHRA/APHRS/LAHRS expert consensus statement on catheter ablation of ventricular arrhythmias. Europace 2019;21:1143–1144.
- Al‑Khatib SM, Stevenson WG, Ackerman MJ, et al. 2017 AHA/ACC/HRS Guideline for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death: Executive Summary. J Am Coll Cardiol 2018;72:1677–1749.
- Wyse DG, Friedman PL, Brodsky MA, et al. Life‑threatening ventricular arrhythmias due to transient or correctable causes: high risk for death in follow‑up. J Am Coll Cardiol 2001;38:1718–1724.
- Ladejobi A, Pasupula DK, Adhikari S, et al. Implantable Defibrillator Therapy in Cardiac Arrest Survivors With a Reversible Cause. Circ Arrhythm Electrophysiol 2018; 11:e005940.
- Moss AJ, Zareba W, Hall WJ, et al. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med 2002;346:877–883.
- Buxton AE, Lee KL, Fisher JD, et al. A randomized study of the prevention of sudden death in patients with coronary artery disease. Multicenter Unsustained Tachycardia Trial Investigators. N Engl J Med 1999;341:1882–1890.
- Bardy GH, Lee KL, Mark DB, et al. Amiodarone or an implantable cardioverter‑defibrillator for congestive heart failure. N Engl J Med 2005;352:225–237.
- Moss AJ, Hall WJ, Cannom DS, et al. Improved Survival with an Implanted Defibrillator in Patients with Coronary Disease at High Risk for Ventricular Arrhythmia. N Engl J Med 1996;335:1933–1940.
- Køber L, Thune JJ, Nielsen JC, et al. Defibrillator Implantation in Patients with Nonischemic Systolic Heart Failure. N Engl J Med 2016;375:1221–1230.
- Shen L, Jhund PS, Petrie MC, et al. Declining Risk of Sudden Death in Heart Failure. N Engl J Med 2017;377:41–51.
- Myerburg RJ, Junttila MJ. Sudden cardiac death caused by coronary heart disease. Circulation 2012; 125:1043–1052.
- Tan VH, Wilton SB, Kuriachan V, et al. Impact of programming strategies aimed at reducing nonessential implantable cardioverter defibrillator therapies on mortality: a systematic review and meta‑analysis. Circ Arrhythm Electrophysiol 2014;7:164–170.
- Scott PA, Silberbauer J, McDonagh TA, Murgatroyd FD: Impact of prolonged implantable cardioverter‑defibrillator arrhythmia detection times on outcomes: a meta‑analysis. Heart Rhythm 2014;11:828–835.
- Knops RE, Olde Nordkamp LRA, Delnoy P‑PHM, et al. Subcutaneous or Transvenous Defibrillator Therapy. N Engl J Med 2020;383:526–536.
- Olgin JE, Lee BK, Vittinghoff E, et al. Impact of wearable cardioverter‑defibrillator compliance on outcomes in the VEST trial: As‑treated and per‑protocol analyses. J Cardiovasc Electrophysiol 2020;31:1009–1018.
- Knecht S, Sacher F, Wright M, et al. Long‑term follow‑up of idiopathic ventricular fibrillation ablation: a multicenter study. J Am Coll Cardiol 2009;54:522–528.
- Kowlgi GN, Cha Y‑M. Management of ventricular electrical storm: a contemporary appraisal. Europace 2020; 22:1768–1780.
- Vergara P, Tung R, Vaseghi M, et al. Successful ventricular tachycardia ablation in patients with electrical storm reduces recurrences and improves survival. Heart Rhythm 2018;15:48–55.
- Aldhoon B, Wichterle D, Peichl P, et al. Outcomes of ventricular tachycardia ablation in patients with structural heart disease: The impact of electrical storm. PLoS One 2017; 12:e0171830.
- Della Bella P, Baratto F, Vergara P, et al. Does Timing of Ventricular Tachycardia Ablation Affect Prognosis in Patients With an Implantable Cardioverter Defibrillator? Results From the Multicenter Randomized PARTITA Trial. Circulation 2022;145:1829–1838.