Léčba těžkého astmatu a kazuistika
Bronchiální astma postihuje přibližně 334 milionů lidí celosvětově, přičemž v České republice se prevalence pohybuje kolem 8 % populace. Ačkoli většina pacientů dosahuje kontroly onemocnění pomocí standardní terapie, přibližně 5–10 % případů spadá do kategorie těžkého refrakterního astmatu vyžadujícího pokročilé léčebné strategie. Tento článek shrnuje klíčové aspekty managementu těžkého astmatu s důrazem na fenotypizaci, biomarkery a biologickou léčbu v kontextu nejnovějších doporučení GINA 2025.
Fenotypy a endotypy jako základ personalizované léčby
Zásadní roli v moderním přístupu k léčbě astmatu hraje rozlišení dvou hlavních endotypů: T2‑high (eozinofilní/alergický) a T2‑low (neutrofilní/paucigranulocytární). T2‑high astma je charakterizováno zvýšeným počtem eozinofilů v periferní krvi (≥ 300 buněk/μl), zvýšenou koncentrací frakčního vydechovaného oxidu dusnatého (FeNO > 50 ppb u dospělých) a často zvýšenými hodnotami imunoglobulinu E (IgE). Zánětlivý proces je zde řízen aktivací Th2 lymfocytů, které produkují interleukiny 4, 5 a 13 (IL‑4, ‑5, ‑13), což vede k aktivaci žírných buněk, bazofilů, eozinofilů a k remodelaci dýchacích cest. T2‑high fenotyp je typický pro astma s časným nástupem, častou přítomností alergií a komorbiditou v podobě chronické rinosinusitidy s nosními polypy (CRSwNP), která je přítomna u 20–60 % pacientů s těžkým astmatem. Naopak T2‑low endotyp je charakterizován převahou neutrofilů, zvýšenou expresí IL‑8, IL‑17 a tumor nekrotizujícího faktoru alfa (TNFα), častěji postihuje ženy, osoby s obezitou a pacienty s pozdním nástupem onemocnění. Tento fenotyp je spojen s horší odpovědí na inhalační kortikosteroidy (IKS) a vyšším rizikem rozvoje fixované bronchiální obstrukce.
Klíčovým faktorem je věk nástupu onemocnění – astma s časným nástupem je často spojeno s atopií a alergiemi, zatímco astma s pozdním nástupem bývá závažnější, častěji postihuje ženy a je obvykle nealergického původu.
Diagnostika astmatu a komorbidit
Diagnostika astmatu vyžaduje komplexní přístup. Základem je podrobná anamnéza (rodinná anamnéza, alergická onemocnění v průběhu života, začátek příznaků a léčby astmatu, kouření, vlivy prostředí, včetně pracovního, historie exacerbací, spotřeby SABA a systémových kortikosteroidů, hodnoty absolutního počtu eozinofilů v periferní krvi a FeNO, komorbidity…) a fyzikální vyšetření. Pro objektivní posouzení stavu dýchacích cest a rozsahu strukturálních změn bronchů i bronchiální hyperreaktivity se využívají funkční plicní vyšetření, zejména spirometrie (k detekci obstrukce a bronchiální hyperreaktivity), bodypletysmografie (k záchytu air‑trappingu) a oscilometrie (pro odhalení periferní obstrukce).
Aktivita zánětu v bronchiální sliznici je běžně monitorována měřením FeNO, přičemž dalšími využívanými biomarkery jsou absolutní počet eozinofilů v periferní krvi a hodnoty celkového či specifického IgE. Tyto ukazatele napomáhají při určování endotypu a fenotypu astmatu, hodnocení rizika exacerbací, ztráty kontroly nad onemocněním a při predikci odpovědi na biologickou léčbu. Včasné zahájení terapie na základě biomarkerů zánětu umožňuje zasáhnout již v subklinických fázích astmatu, čímž lze minimalizovat riziko exacerbací a rozvoje strukturálního poškození, jako je bronchiální obstrukce, pokles plicních funkcí či remodelace dýchacích cest, což má příznivý dopad na dlouhodobou prognózu onemocnění.
Pro detailní zhodnocení strukturálních změn dolních cest dýchacích lze využít zobrazovací metody (např. CT plic k detekci hlenových zátek a ztluštění stěny bronchů), analýzu indukovaného sputa (stanovení buněčnosti, přítomnost Charcotových–Leydenových krystalů, autoprotilátek, mikrobiologie) či histologické vyšetření bronchiální sliznice při bronchoskopii. Vzhledem k náročnosti však tato vyšetření nejsou rutinně prováděna, ale jejich výsledky mohou významně ovlivnit rozhodování o dalším terapeutickém postupu, například při volbě konkrétní biologické léčby.
Při komplexním posouzení pacienta s astmatem je nezbytné pátrat také po souvisejících komorbiditách, které mohou významně ovlivnit průběh a kontrolu onemocnění. Mezi časté komorbidity patří CRSwNP, která je u 20–60 % případů asociována s astmatem a vede k horší kontrole nemoci a výraznější obstrukci dýchacích cest. U části pacientů s těžkým astmatem se vyskytuje i intolerance kyseliny acetylsalicylové, přičemž tato triáda (astma, CRSwNP, intolerance ASA) je označována jako Samterova trias, resp. aspirinem exacerbovaná respirační nemoc (AERD), která je spojena s častějšími exacerbacemi a vyšší potřebou systémových kortikosteroidů. Dalšími významnými komorbiditami jsou obezita, gastroezofageální reflux (GERD) a psychické poruchy, které vyžadují komplexní přístup v rámci managementu astmatu.
Terapie astmatu
Cílem léčby astmatu je dosažení plné kontroly nad onemocněním, minimalizace počtu exacerbací, normalizace plicních funkcí a zvýšení kvality života. Tohoto cíle dosáhne většina pacientů, zejména pokud je léčba zahájena včas a plicní funkce jsou zachovány. Léčba astmatu je dynamický proces, který vyžaduje pravidelné přehodnocování terapeutického režimu a úpravu intenzity léčby podle aktuální kontroly astmatu.
Doporučení Globální iniciativy pro astma (Global Initiative for Asthma) GINA 2025 zdůrazňují preventivní přístup s časným zařazením fixních kombinací IKS a formoterolu již od 1. stupně léčby. Tato strategie snižuje riziko exacerbací o 26–36 % ve srovnání s režimy založenými na inhalačních β2‑agonistech s krátkodobým účinkem (SABA). U těžkého astmatu (stupeň 5) se využívá vysokých dávek IKS kombinovaných s inhalačními β2‑agonisty s dlouhodobým účinkem (LABA) a inhalačními anticholinergiky s dlouhodobým účinkem (LAMA), přičemž systémové kortikosteroidy by měly být rezervovány pouze pro akutní exacerbace kvůli riziku dlouhodobých nežádoucích účinků (osteoporóza, katarakta, diabetes ad.).
U jedinců s respirační alergií a lehkým až středně těžkým astmatem lze využít efektu alergenové imunoterapie, která může zabránit progresi do těžší formy onemocnění. Od roku 2021 je v doporučeních GINA uvedena možnost sublinguální imunoterapie proti roztočům domácího prachu ve 2.–4. kroku léčby u pacientů s prokázanou alergií na roztoče.
K úspěchu léčby významně přispívá edukace pacienta, pravidelný nácvik inhalační techniky a využití digitálních nástrojů pro podporu adherence. Chyby v inhalační technice jsou přítomny až u 70 % pacientů a zásadně snižují účinnost léčby. Pravidelné kontroly, edukace a motivace pacienta jsou proto nezbytné. V posledních letech se rozvíjí využití mobilních aplikací, které pacientům připomínají užití léků a umožňují sledování symptomů a plicních funkcí v domácím prostředí.
Biologická léčba těžkého refrakterního astmatu: cílený zásah do patogeneze
Biologika jsou indikována u pacientů s refrakterním těžkým astmatem, které nedosahuje kontroly navzdory maximální standardní terapii, a to i po vyloučení vlivu komorbidit, neadekvátní inhalační techniky nebo nedostatečné adherence k léčbě. Působí na specifické molekulární cíle zánětu a jejich cílem je dosáhnout snížení počtu exacerbací astmatu, snížení nebo úplného vysazení systémové kortikoterapie, zlepšení kontroly astmatu a kvality života pacienta a stabilizace nebo normalizace plicních funkcí. Biologická léčba je vždy indikována a vedena v centrech pro těžké astma (NCTA). Výběr biologika je podmíněn nejen hodnotami FeNO, eozinofilů a IgE, ale také přítomností komorbidit, například CRSwNP, atopické dermatitidy nebo AERD. Tabulka 1 uvádí podrobnější charakteristiku jednotlivých skupin biologik.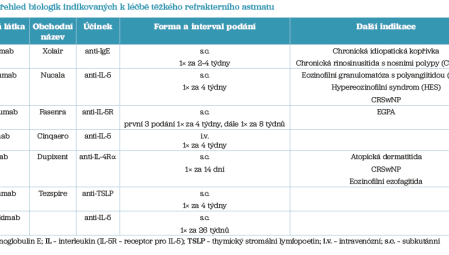
Omalizumab blokuje vazbu IgE na žírné buňky a bazofily, čímž potlačuje alergickou reakci. Je určen pro pacienty s těžkým alergickým eozinofilním astmatem a pozitivitou kožních testů nebo specifického IgE na celoroční alergeny (např. roztoče, plísně).
Reslizumab, depemokimab, benralizumab cílí na IL‑5, klíčový cytokin pro diferenciaci a přežití eozinofilů. Zatímco depemokimab a reslizumab vážou přímo IL‑5, benralizumab blokuje jeho receptor, což navíc indukuje apoptózu eozinofilů. Depemokimab, schválený Evropskou lékovou agenturou (EMA) v lednu 2025, umožňuje aplikaci 1× za 6 měsíců díky modifikované Fc oblasti protilátky.
Dupilumab inhibuje signalizaci IL‑4 a IL‑13, což potlačuje produkci IgE a remodelaci dýchacích cest.
Tezepelumab cílí na thymický stromální lymfopoetin (TSLP), alarmin spouštějící T2‑high typ zánětu (eozinofilní) i T2‑low typ zánětu (neutrofilní).
Kazuistika
74letý pacient byl odeslán dispenzarizujícím pneumologem do našeho centra k posouzení indikace biologické léčby pro diagnózu těžké refrakterní průduškové astma. Astma bylo u pacienta diagnostikováno v 23 letech, spolu s alergií na roztoče a pyl stromů. Do věku 59 let bylo onemocnění pod kontrolou na středních dávkách IKS.
V posledních 15 letech dospěl pacient s postupnou ztrátou kontroly nad astmatem k vysokým dávkám IKS a k inhalačním bronchodilatanciím LABA a LAMA. Od 71 let měl denní symptomy námahové dušnosti a kašle, opakované exacerbace astmatu s nutností léčby systémovými kortikosteroidy a hospitalizací na plicním oddělení. V dokumentaci byl záznam o průkazu bronchiální hyperreaktivity – pozitivní bronchodilatační test se změnou FEV1 (usilovně vydechnutý objem za první sekundu) o 26 %.
Eozinofilní fenotyp astmatu byl potvrzen naměřením absolutního počtu eozinofilů v periferní krvi 490/μl a vyšší hodnotou FeNO – 43 ppb – krátce po zahájení systémové kortikoterapie. Při vyšetření plic výpočetní tomografií (CT) byly popsány hlenové zátky oboustranně v subsegmentálních a segmentálních bronších. Dalším důležitým anamnestickým údajem, který potvrzoval obraz eozinofilního zánětu v dýchacích cestách a vysvětloval těžký průběh astmatu, byl záznam o provedeném flexibilním endoskopickém vyšetření polykání (FEES) a septoplastice pro CRSwNP a deviaci nosního septa ve věku 70 let.
Dále se pacient léčil s GERD, pro který v minulosti prodělal fundoplikaci žaludku, s arteriální hypertenzí, hypercholesterolemií a ischemickou chorobou srdeční. Vedle inhalační terapie a teofylinu užíval inhibitor angiotenzin konvertujícího enzymu (ACEi), statin, inhibitor protonové pumpy a kyselinu acetylsalicylovou.
Při úvodním vyšetření jsme vedle důkladné anamnézy provedli alergologické vyšetření, spirometrii (před užitím LABA – FEV1 27 %, vitální kapacita [VC] 52 %, 2 l), FeNO (24 ppb), test kontroly astmatu (8/25) a ověřili compliance a správnou inhalační techniku. Prick testy prokázaly senzibilizaci na pyl břízovitých stromů. Senzibilizace na celoroční alergen nebyla prick testy ani následným laboratorním vyšetřením specifických IgE prokázána. Hodnota celkového IgE byla 112,98 kU/l, eozinofilní kationický protein (ECP) 51,6 μg/l, absolutní počet eozinofilů 600/μl a hraniční nález antinukleárních protilátek (ANA). Pacient v době vyšetření denně užíval 5 mg prednisonu.
V terapii jsme provedli změnu ACEi za sartan z důvodu neproduktivního chronického kašle, přidali jsme antileukotrien a pacienta reedukovali o režimových a dietních opatřeních při GERD. Do úvahy jsme vzali možnost AERD, s ohledem na těžké astma a CRSwNP. Proto jsme doporučili vysazení kyseliny acetylsalicylové a konzultaci její náhrady s kardiologem.
Po dvou měsících od vstupního vyšetření jsme na základě výsledků potvrdili diagnózu těžkého refrakterního eozinofilního astmatu a zahájili biologickou léčbu s anti‑IL‑5 molekulou.
Po 17 dnech od zahájení biologické léčby si pacient sám od sebe vysadil prednison. Po třech aplikacích anti‑L5 biologického přípravku došlo k významnému zlepšení klinického stavu pacienta. Toleruje námahu, včetně jízdy na kole. Dušnost se objevuje jen při hodně velké námaze. Z krátkodobých bronchodilatancií užívá ipratropium‑bromid 3–4× do týdne. Pochvaluje si, že se mu daří odkašlávat hleny, které dříve cítil na průduškách (patrně v důsledku pozitivního efektu anti‑IL‑5 na hlenové zátky popsané na CT). V testu kontroly astmatu dosáhl hodnoty 17/25. Spirometrie po ranním užití LABA prokázala nárůst hodnoty FEV1 na 62 % a VC 90 % (3,48 l). Laboratorním vyšetřením jsme pozorovali pokles hodnoty biomarkerů zánětu 2. typu (ECP 4,29 μg/l, absolutní počet eozinofilů 30/μl) s výjimkou vzestupu hodnoty celkového IgE na 174,13 kU/l, patrně vlivem pylové sezony.
Závěr
Terapie těžkého astmatu prošla výraznou transformací směrem k personalizované medicíně. Klíčem k úspěchu zůstává včasná diagnóza a léčba, fenotypizace, monitorování biomarkerů (FeNO, eozinofily) a strukturálních změn, interdisciplinární přístup k řešení komorbidit a důraz na edukaci a motivaci pacientů. Biologická léčba přináší naději na klinickou remisi u dříve refrakterních forem astmatu.
MUDr. Tomáš Balner,
doc. MUDr. Jaromír Bystroň, CSc.
Oddělení alergologie a klinické imunologie FN Ostrava, Ústav laboratorní medicíny, Lékařská fakulta, Ostravská univerzita
Korespondenční adresa:tomas.balner@fno.cz