Mikroskopická kolitida: malý zánět – velké problémy
Souhrn
Mikroskopická kolitida je vzácná forma zánětlivého střevního onemocnění, která se typicky manifestuje chronickými vodnatými průjmy bez příměsi krve. Endoskopický obraz během kolonoskopie je bez významného patologického nálezu. Průkazem tohoto onemocnění je biopsie, kde nalézáme typické histologické změny. Mikroskopická kolitida má dva histologické subtypy, jimiž jsou lymfocytární kolitida a kolagenní kolitida. Typickým pacientem, který je léčen pro mikroskopickou kolitidu, je žena středního věku, která je sledována již pro jiné autoimunitní onemocnění, jako je např. celiakie, autoimunitní tyreoiditida či diabetes mellitus 1. typu.
Klíčová slova: chronický průjem · mikroskopická kolitida · lymfocytární kolitida · kolagenní kolitida · budesonid
Summary
Microscopic colitis is a very rare inflammatory intestinal disease, typical clinical manifestation is chronic watery diarrhea, without blood. Endoscopic finding is normal, without signs of inflammation of colonic mucosa. The diagnosis of microscopic colitis is based on biopsy, where are described typical histological changes. Microscopic colitis has two histological subtypes – colagen colitis and lymphocytic colitis. A typical patient is a middle‑aged woman with other autoimmune disease like celiac disease, autoimmune thyreoiditis or type 1 diabetes.
Key words: chronic diarrhea · microscopic colitis · lymphocytic colitis · colagen colitis · budesonide
Úvod
Mikroskopická kolitida je vzácná forma zánětlivého střevního onemocnění, která se typicky manifestuje chronickými vodnatými průjmy bez příměsi krve. Endoskopický obraz během kolonoskopie je bez významného patologického nálezu. Průkazem tohoto onemocnění je biopsie, kde nalézáme typické histologické změny. Mikroskopická kolitida má dva histologické subtypy, jimiž jsou lymfocytární kolitida (LC) a kolagenní kolitida (CC).
Termín kolagenní kolitida poprvé použil Lindström v roce 1976, lymfocytární kolitidu poprvé popsal Lazenby v roce 1989. Vlastní pojem mikroskopická kolitida prvně použil Reed v roce 1980 ve studii s pacienty trpícími průjmy nejasné etiologie.2
Incidence tohoto onemocnění je 2–10 případů na 100 tisíc obyvatel za rok.3 Predilekčně jsou postiženy ženy středního věku, průměrný věk v době stanovení diagnózy je 65 let.4 U dětí je diagnóza mikroskopické kolitidy raritní.
Důležité je pomýšlet na tuto diagnózu u pacientů, kteří jsou již dispenzarizováni pro jiné autoimunitní choroby, jako je např. autoimunitní tyreoiditida, glutenová enteropatie, diabetes mellitus 1. typu. S autoimunitními chorobami je častěji asociován kolagenní subtyp mikroskopické kolitidy. Zhruba 60 % pacientů léčených pro mikroskopickou kolitidu je dispenzarizováno pro jinou autoimunitní chorobu.4
Patofyziologie
Patofyziologie vzniku mikroskopické kolitidy je nejasná. Předpokládá se, že vznik choroby je multifaktoriální. Na rozvoji choroby se zcela jistě podílejí genetické predispozice spolu s abnormální imunitní odpovědí sliznice střeva na intraluminální faktory (zejména změna kolagenového metabolismu ve smyslu zvýšené depozice kolagenových vláken subepiteliálně, dále porucha bariérové funkce střevní sliznice).5
Z genetické predispozice se předpokládá asociace s HLA‑DQ2, HLA‑DQ1 a HLA‑DQ3. Stejné histokompatibilní komplexy jsou asociovány s celiakií, a proto je diagnóza mikroskopické kolitidy často spojena právě s nesnášenlivostí lepku.6
Abnormální kolagenový metabolismus může způsobovat zvýšené ukládání kolagenových vláken v mukóze střeva a tím zapříčiňovat vznik kolagenové mikroskopické kolitidy. Zvýšení depozice kolagenových vláken do subepiteliální matrix bývá přisuzováno vzestupu exprese fibrogenních genů, hodnot prokolagenu I a metaloproteinázových inhibitorů. Modifikace kolagenového mechanismu bývá vysvětlována zvýšenou syntézou histaminu, prostaglandinů a oxidu dusnatého.
Dalším faktorem, který se spolupodílí na vzniku mikroskopické kolitidy, je špatná bariérová funkce střevního epitelu. Porucha bariérové funkce sliznice vede ke vzestupu slizniční permeability pro antigeny a bakterie, a tím ke vzniku zánětu.7
V důsledku slizničního zánětu je snižována absorpce chloridu sodného, chlorid je následován vodou a to vede ke vzniku sekrečního vodnatého průjmu.8 Dalším faktorem, který se podílí na vzniku průjmu, může být malabsorpce žlučových kyselin, což vysvětluje terapeutický efekt cholestyraminu při léčbě průjmů u mikroskopické kolitidy.8
Etiologie
Jako hlavní rizikové faktory mikroskopické kolitidy jsou uváděny riziková medikace a kouření.8 Z rizikové medikace se jedná především o nesteroidní antirevmatika (NSAID), jež bývají popisována jako nejčastější spouštěč mikroskopické kolitidy.
Dále se spekuluje o možnosti, že se na vzniku mikroskopické kolitidy spolupodílejí další léky, např. inhibitory protonové pumpy (lansoprazol)8,15, statiny či selektivní inhibitory zpětného vychytávání serotoninu (SSRI). Riziko vzniku mikroskopické kolitidy je zvýšeno hlavně při podávání kombinace NSAID spolu s výše uvedenými léky.10 Dalším rizikovým faktorem je kouření cigaret.8
Klinická manifestace
Typickou manifestací je chronický vodnatý průjem bez příměsi krve.1 Průjmy trvají alespoň po dobu čtyř týdnů. Typický je relativně náhlý vznik, který může napodobovat infekční povahu onemocnění. Velmi časté jsou i noční obtíže.5
Další obtíže jako bolesti břicha či febrilie nejsou přítomny. Výjimečně pacienti udávají nespecifické příznaky charakteru malého hmotnostního úbytku, únavy či inkontinence stolice.5
Kolonoskopický nález je makroskopicky bez významnějších pozoruhodností a definitivní diagnóza je stanovena až z histologického nálezu.2
Klinická manifestace je shodná bez ohledu na histologický subtyp mikroskopické kolitidy.22
Chronické průjmy při mikroskopické kolitidě snižují celkovou kvalitu života nemocných a omezují je v běžných životních aktivitách.5
Diagnóza
V diagnostice průjmu se obecně uplatňuje základní odběr laboratorních vzorků zahrnujících krevní obraz, iontogram, jaterní testy, renální parametry, zánětlivé parametry (CRP) a fekální kalprotektin.4
Laboratorní nálezy nejsou specifické, může být přítomna např. lehká anémie, zvýšená sedimentace erytrocytů či iontová dysbalance (např. hypokalemie) v důsledku těžkých chronických průjmů. U zhruba 50 % pacientů bývá přítomna pozitivita revmatoidního faktoru (RF), antinukleárních protilátek (ANA) nebo jsou doloženy antimitochondriální protilátky (AMA), dále bývá pozorován častější výskyt protilátek proti cytoplazmě neutrofilů (ANCA) nebo protilátek proti Saccharomyces cerevisiae (ASCA).11
Dalším častým nálezem je lehké zvýšení hodnoty fekálního kalprotektinu (FK) ve stolici (200–400 µg/g), nicméně elevace není vždy přítomna.12
Vzhledem k tomu, že biopsie je jediným definitivním potvrzením diagnózy mikroskopické kolitidy, má být kolonoskopie s odběrem etážové biopsie indikována u každého pacienta s chronickými průjmy i při normální hladině fekálního kalprotektinu. Makroskopický nález během kolonoskopie je téměř normální, vzácně mohou být přítomny známky lehkého edému či hyperemie sliznice, někdy je vídáno vymizení cévní kresby.13
Nálezy zjištěné pomocí radiologických metod, jako je CT enterografie či sonografické vyšetření, nejsou nijak typické pro diagnózu mikroskopické kolitidy.14
Komplikace
U pacientů, kteří jsou léčeni pro mikroskopickou kolitidu, nebyl prokázán zvýšený výskyt kolorektálního karcinomu či jiných nádorů tlustého střeva.20
Vzácnou komplikací kolagenní formy mikroskopické kolitidy je perforace střeva během kolonoskopického vyšetření, nicméně je popisováno několik případů spontánní perforace střeva při doposud nediagnostikované kolagenní kolitidě.15,16
Histologický nález
Lymfocytární mikroskopická kolitida je charakteristická více než 20 intraepiteliálními lymfocyty na 100 epiteliálních buněk sliznice střeva. Architektonika krypt bývá zachována, ale lokálně může být vyjádřena lehká forma kryptitidy (obr. 1, 2).17
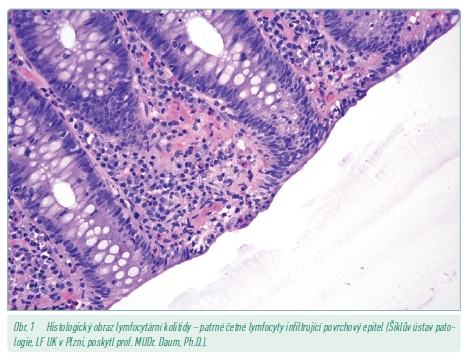
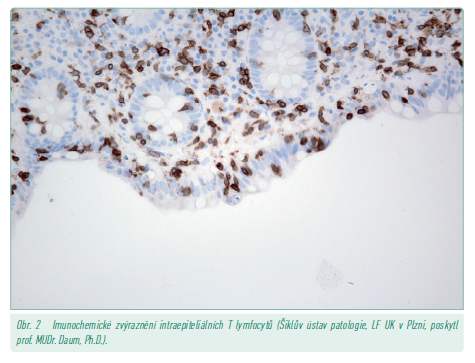
Kolagenová mikroskopická kolitida je charakterizována subepiteliální depozicí kolagenových vláken delších než 10 µm v průměru. Kolagenová vlákna se nacházejí nejvíce v oblasti mezi kryptami.17
Nespecifikovaná mikroskopická kolitida je typická vzestupem hodnot intraepiteliálních lymfocytů spolu se zvýšením depozice kolagenových vláken.
Diferenciální diagnostika
V diferenciální diagnostice zvažujeme zejména tyto nozologické jednotky po vyloučení infekční etiologie průjmů:
- Glutenová enteropatie – k jejímu vyloučení je nutný odběr protilátek proti tkáňové transglutamináze (anti‑tTRG IgA, celkové IgA), provedení enterobiopsie;
- Idiopatické střevní záněty – IBD (Crohnova choroba, ulcerózní kolitida) – kolonoskopie, CT/MR enterografie, odběr fekálního kalprotektinu;
- Syndrom dráždivého tračníku – IBS.
Léčebný management
Základem léčby je užívání budesonidu v dávce 9 mg jednou denně po dobu 6–8 týdnů k indukci klinické remise (maximální doba užívání plné dávky budenosidu je 12 týdnů), poté postupná redukce dávky vždy o 3 mg po dobu 6–8 týdnů. Léčba budenosidem by neměla být delší než 6 měsíců. Efekt léčby lze očekávat po 2–4 týdnech zhruba u 80 % pacientů.(13) Budesonid je lokálně aktivní kortikosteroid s významným first‑pass efektem v játrech a nízkým systémovým důsledkem, a neměl by tedy mít nežádoucí účinky jako léčba běžnými systémovými kortikosteroidy. Nicméně jsou popisovány vzácné nežádoucí účinky ve smyslu iatrogenního Cushingova syndromu. Hyperkortikalismus regreduje po vysazení budesonidu.(22)
V případě kortikodependence či kortikorezistence lze zahájit imunosupresivní léčbu azathioprinem (v dávce 2mg/kg/den, perorálně).(18)
Systémové kortikosteroidy, mesalazin, metotrexát, antibiotika a probiotika nejsou k léčbě mikroskopické kolitidy indikovány.(18)
Ke zvážení je v případě selhání imunosupresivní léčby i biologická terapie anti‑TNF‑alfa preparátem infliximabem ve standardním dávkovacím schématu.(5) Při selhání infliximabu lze přistoupit k terapii vedolizumabem ve standardním dávkování.(18)
Další podpůrnou terapií je užití antidiarotik jako např. cholestyraminu v maximální dávce až 4g/denně(19) či loperamidu (maximální dávka je 12mg/denně).(20)
V případě selhání konzervativní léčby lze jako ultimum refugium využít chirurgické řešení v podobě proktokolektomie s trvalou ileostomií.(1)
Důležitou součástí léčebného managementu je vyvarovat se případného spouštěče onemocnění, tzn. vysadit rizikovou medikaci, zanechat kouření apod.(10)
Shrnutí a připomenutí
- Mikroskopická kolitida je zánětlivé střevní onemocnění charakterizované výskytem vodnatých nekrvavých průjmů bez další specifické symptomatologie.
- Mikroskopická kolitida je často asociována s jinými autoimunitními onemocněními, jako je např. glutenová enteropatie, autoimunitní tyreoiditida atd.
- Nejčastějším spouštěčem onemocnění je užívání nesteroidních antirevmatik.
- U pacientů s chronickým nekrvavým průjmem je nutné vždy indikovat provedení kolonoskopie s odběrem etážové biopsie, endoskopický obraz je zpravidla normální, histologický nález je ale vcelku typický.
- Jako základní léčebný management by měla být preferována léčba budesonidem s postupnou redukcí dávky.
Kazuistika
Třicetiletá žena dispenzarizovaná oftalmologem pro sicca syndrom a revmatologem pro migrující polyartritidu (jasná revmatologická diagnóza doposud nebyla stanovena), pro úporné artralgie dlouhodobě léčena vysokými dávkami nesteroidních antirevmatik (ibuprofen v dávkách až 3 g/den), dále u pacientky známa sérologická pozitivita HLA‑B27. Do naší gastroenterologické ambulance se dostavila pro vodnaté průjmy bez příměsi krve trvající čtyři měsíce ve frekvenci cca 15–20 průjmovitých stolic denně. U pacientky byl zjištěn normální laboratorní nález bez elevace zánětlivých parametrů, ale byla doložena pozitivita hodnoty fekálního kalprotektinu (hodnota 650 µg/g). Pacientka byla indikována k provedení kolonoskopie. Kolonoskopický nález byl zcela normální, při odběru etážové biopsie však byla zjištěna mikroskopická lymfocytární kolitida. U pacientky byla zahájena léčba budesonidem v dávce 9 mg denně, po zahájení léčby u nemocné dochází ke kompletní regresi obtíží během 1–2 týdnů léčby. Dávka budesonidu byla postupně snižována (dle tab. 1) – bez další recidivy obtíží. Ve spolupráci s revmatologem byly řešeny výrazné artralgie se zahájením léčby sulfasalazinem s dobrým efektem a došlo k vysazení NSAID.

Literatura
- Lukáš K. Nemoci tlustého střeva, Záněty. In: Lukáš K., Hoch J. a kol. Nemoci střev. Praha: Grada, 2018; 268–271.
- Boland K, Nguyen GC. Microscopic colitis: A review of collagenous and lymphocytic colitis. Gastroenterol Hepatol 2017;13:671–677.
- Olesen M, Eriksson S, Bohr J, et al. Microscopic colitis: A common diarrhoeal disease. An epidemiological study in Örebro, Sweden, 1993‑1998. Gut 2004;53:346–350.
- Terruzzi V, Minoli G. Collagenous colitis: a retrospective study of clinical presentation and treatment in 163 patients. Gastrointest Endoscopy 1997;46:200–201.
- Ianiro G, Cammarota G, Valerio L, et al. Microscopic colitis. World J Gastroenterol 2012;18: 6206–6215.
- Pisani LF, Tontini GE, Vecchi M, Pastorelli L. Microscopic Colitis: What Do We Know About Pathogenesis? IBD 2016;22:450–458.
- Park T, Cave D, Marshal C. Microscopic colitis: A review of etiology, treatment and refractory disease. World J Gastroenterol 2015;21:804–8810.
- Gentile N, Yen EF. Prevalence, pathogenesis, diagnosis, and management of microscopic colitis. Gut Liver 2018;12: 227–235.
- Hawkey CJ, Bosch J, Richter JE. Textbook of Clinical Gastroenterology and Hepatology. New Jersey: Wiley‑Blackwell, 2012.
- Verhaegh BPM, De Vries F, Masclee DM. High risk of drug‑induced microscopic colitis with concomitant use of NSAIDs and proton pump inhibitors. Aliment Pharmacol Ther 2016;43:1004–1013.
- Roth B, Gustafsson RJ, Ohlsson B. Auto‑antibodies and their association with clinical findings in women diagnosed with microscopic colitis. PLoS ONE 2013;8(6):e66088.
- Larsson JK, Sjöberg K, Vigren L, et al. Chronic non‑bloody diarrhoea: A prospective study in Malmö (Sweden) with focus on microscopic colitis. BMC Research Notes 2014;236:1–7.
- Okamoto R, Negi M, Tomii S, et al. Diagnosis and treatment of microscopic colitis. Clin J Gastroenterol 2016;9:169–174.
- Gil J, Wojtuń S, Stec‑Michalska K, Chojnacki C. Nieswoiste choroby zapalne jelit‑diagnostyka obrazowa. Pol Merkur Lekarski 2004;17:27–31.
- Mori H, Miyake T, Shimizu T, et al. A case of spontaneous colonic perforation in collagenous colitis. Surg Case Rep 2019;5:90.
- Mitchell A, Dugas A. Collagenous colitis presenting as spontaneous perforation in an 80 year old woman: Report of a Case. BMC Gastroenterology 2016;124:1–5.
- Lewin K, Riddell RH, Weinstein WM. Gastrointestinal pathology and its clinical implication. Philadelphia: Wolters Kluwer Health, 2014.
- Shor J, Churrango G, Marshall C. Management of microscopic colitis : challenges and solutions. Clin Exp Gastroenterol 2019;12:111–120.
- Nguyen GC, Smalley WE, Vege SS, Carrasco‑Labra A. American Gastroenterological Association Institute Guideline on the Medical Management of Microscopic Colitis. Gastroenterology 2016;150:242–246.
- Levy A, Borren NZ, Maxner B, et al. Cancer risk in microscopic colitis: a retrospective cohort study. BMC Gastroenterology 2019;19:1.
- Pardi DS. Diagnosis and Management of Microscopic Colitis. Am J Gastroenterol 2017;112:78–85.
- Tripathi K, Dunzendorfer T. Budesonide‑related iatrogenic Cushing‘s syndrome in microscopic colitis. ACG Case Rep J 2017 an 4;4:e5. doi: 10.14309/crj.2017.5. eCollection 2017.