Moderní léčba IgA nefropatie a C3 glomerulopatie
Primární glomerulonefritidy jsou imunitně podmíněné choroby, které představují častou příčinu selhání ledvin. Na rozdíl od minulosti, kdy se v nefrologii často hledaly způsoby, jak optimalizovat použití obvykle nespecificky působících přípravků (kortikoidy, cyklofosfamid atd.), můžeme nyní používat léky mnohem lépe zacílené, a díky tomu méně toxické a efektivnější. Díky výrazně lepšímu chápání patofyziologických mechanismů glomerulonefritid a zájmu farmakologického průmyslu se také nefrologie stává oborem medicíny, kde je testováno mnoho inovativních přípravků, z nichž několik se zcela recentně dostalo do klinické praxe. Především to platí pro IgA nefropatii a C3 glomerulopatii, které ještě donedávna patřily mezi glomerulonefritidy, pro něž cílená a efektivní léčba v podstatě neexistovala.
IgA nefropatie
IgA nefropatie (IgAN) je nejčastější glomerulonefritidou vůbec, častěji postihuje muže, a to většinou v mladší dospělosti. Jedná se o nemoc, která má velmi široké spektrum klinických manifestací, ale nejčastější je chronická, pomalu progredující ztráta funkce ledvin doprovázená mikroskopickou hematurií a v pokročilejších stadiích také proteinurií. Jedinou možností, jak IgAN diagnostikovat, je biopsie ledviny.1 Vzhledem ke zlepšujícím se možnostem terapie (viz níže) se indikace biopsie nyní rozšířila i na pacienty s proteinurií kolem 0,5 g/den.2 IgA nefropatie totiž navzdory pomalé progresi není benigní chorobou, naopak, většina pacientů, kteří ztratí za rok více než 1 ml/min/1,73 m2, je v riziku, že se dožije selhání ledvin.3
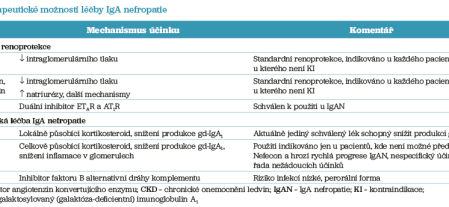 Od roku 1968, kdy Jean Berger toto onemocnění popsal, až do velmi nedávné minulosti byla léčba IgAN spojena spíše s nihilismem, protože největší posuny se děly na úrovni, jak, kdy a zda vůbec podávat pacientům s IgAN kortikoidy.4 Tento přístup se ale v posledních několika letech zásadně změnil. Současný přístup k léčbě IgAN zahrnuje dvě terapeutické větve. Jednak je to léčba nespecifického chronického onemocnění ledvin (CKD, chronic kidney disease)5, jednak léčba imunopatologického procesu specifického pro IgAN6 (tab. 1).
Od roku 1968, kdy Jean Berger toto onemocnění popsal, až do velmi nedávné minulosti byla léčba IgAN spojena spíše s nihilismem, protože největší posuny se děly na úrovni, jak, kdy a zda vůbec podávat pacientům s IgAN kortikoidy.4 Tento přístup se ale v posledních několika letech zásadně změnil. Současný přístup k léčbě IgAN zahrnuje dvě terapeutické větve. Jednak je to léčba nespecifického chronického onemocnění ledvin (CKD, chronic kidney disease)5, jednak léčba imunopatologického procesu specifického pro IgAN6 (tab. 1).
Renoprotekce
Obecně platí, že ztráta určité masy nefronů vede ke spuštění nespecifických faktorů progrese CKD, v důsledku čehož je CKD spontánně progredujícím onemocněním, které lze zpomalit pomocí skupiny opatření označovaných jako renoprotekce.
Léčba CKD u pacientů s IgAN zahrnuje (1) inhibitor renin‑angiotenzinového systému, (2) inhibitor SGLT2 (SGLT2i, inhibitory sodíko‑glukózových kotransportérů typu 2) a (3) endotelinový inhibitor. Mezi inhibitory renin‑angiotenzinového systému (RASi) patří inhibitory ACE (ACEi, inhibitory angiotenzin konvertujícího enzymu) a sartany (ARB, blokátory angiotenzinového receptoru). To, že RASi fungují u IgAN, je známo dlouho,7 a z toho důvodu naprostá většina nových studií s IgAN vyžaduje optimalizovanou inhibici RAS v obou větvích, neboť všichni pacienti s IgAN mají mít RASi.
Renoprotektivní efekt SGLT2i (gliflozinů) byl popsán u IgAN díky studiím DAPA‑CKD a EMPA‑KIDNEY.8,9 Dapagliflozin a empagliflozin prokázaly zpomalení ztráty funkce ledvin, dapagliflozin byl dokonce asociován se snížením proteinurie. Oba přípravky jsou tak nyní doporučovány a schváleny k použití u pacientů s CKD, kam spadají i pacienti s IgAN.
Třetím systémem, který je možné v rámci renoprotekce u IgAN zablokovat, je endotelinový systém. Endotelin‑1 (ET‑1) je peptid vytvářený v podstatě všemi buňkami v ledvinách10 a mezi jeho hlavní efekty patří regulace hemodynamiky v ledvině, poškození mezangiálních buněk, glomerulárních endotelií a podocytů. Většina těchto efektů je realizována skrze receptor ETA (ETAR). Proteinurie a angiotenzin II zvyšují sekreci ET‑1, který dále zvyšuje sekreci angiotenzinu II a zhoršuje proteinurii, čímž se vytváří začarovaný kruh progrese renální dysfunkce.11 U pacientů s CKD, kterým byly podávány současně RASi a antagonista ET‑1, došlo k poklesu proteinurie a glomerulární filtrace, což je fenomén známý (a z hlediska renoprotekce také fenomén žádoucí12,13) u RASi i u SGLT2i.
U pacientů s IgAN je prokázáno, že podávání atrasentanu (selektivní antagonista ETAR) vede k poklesu proteinurie o zhruba 40 % oproti placebové větvi, přičemž pacienti v obou větvích museli mít maximální tolerovanou dávku RASi. Tyto výsledky pocházejí ze studie fáze II (AFFINITY)14 a studie fáze III (ALIGN)15. Sparsentan (kombinovaný antagonista ETAR a AT1R) prokázal ve studii PROTECT signifikantní snížení proteinurie cca o 40 % a zpomalení ztráty glomerulární filtrace oproti placebu.16,17 Sparsentan (Filspari®) je proto schválen k používání u pacientů s IgAN jak ve Spojených státech amerických, tak v Evropské unii. Atrasentan je schválen od dubna 2025 zatím pouze v USA.
V rámci obecné renoprotekce je tedy u pacientů s IgAN doporučeno snížení tělesné hmotnosti, restrikce příjmu sodíku, zanechání kouření, dostatečná kontrola krevního tlaku s cílem snížit jeho hodnotu pod 120/70 mm Hg a prevence a léčba kardiovaskulárních onemocnění.18 Dále je zásadní snížení glomerulární hyperfiltrace pomocí RASi, inhibitorů endotelinu (v tuto chvíli je schválen pouze sparsentan, který je duálním inhibitorem RASi a endotelinu) a inhibitorů SGLT2. Tyto léky se mají optimálně kombinovat a dávka maximalizovat podle tolerance pacienta.
Imunologická léčba IgA nefropatie
Imunologická léčba IgAN se snaží působit na některých klíčových krocích patogeneze IgAN. Na začátku IgAN stojí tvorba degalaktosylovaných IgA1 (gd‑IgA1, galactose‑deficient IgA1). Proti těmto protilátkám se u některých jedinců vytvářejí IgG nebo IgA autoprotilátky. Tak vznikají imunokomplexy, které se vychytávají v glomerulech, kde pak dochází ke vzniku lokálního zánětu. Glomerulární zánět vede postupně ke ztrátě funkce ledvin v důsledku ztráty glomerulů a progrese tubulointersticiální atrofie a fibrózy. Z uvedené patogeneze IgAN pak vyplývá, že se imunologická léčba má zacílit jednak na tvorbu gd‑IgA1, jednak na glomerulární zánět.
Snížení tvorby patologických IgA1
Jednou z logických možností, jak snížit tvorbu autoprotilátek, je deplece B lymfocytů pomocí rituximabu. Rituximab ale v léčbě IgAN selhal a jeho podávání nebylo spojeno s poklesem proteinurie.19 Jedním z vysvětlení, proč rituximab neúčinkuje, je rezistence buněk produkujících gd‑IgA1. Možným řešením by mohly být anti‑CD38 protilátky, jako jsou felzartamab a megazatimab, které v interim analýzách skutečně prokázaly vysokou účinnost stran snížení proteinurie. Druhým možným problémem rituximabu je fakt, že nepůsobí v Peyerových placích tenkého střeva, kde se většina gd‑IgA1 vytváří. Tento problém by měl řešit přípravek Nefecon, což je glukokortikoid (budesonid) se specifickým uvolňováním v terminálním jejunu a v ileu. Nefecon byl testován ve studii fáze III NefIgArd20, která prokázala, že Nefecon snižuje proteinurii i rychlost ztráty glomerulární filtrace. Současně nebyl prokázán vyšší výskyt infekčních komplikací, což bylo zásadním problémem systémových kortikoidů. Je důležité zmínit, že efekt Nefeconu trvá, dokud je podáván. Ve studii NefIgArd bylo pozorováno snížení hodnot gd‑IgA1, které přetrvávalo pouze cca tři měsíce po ukončení terapie, a nový vzestup produkce gd‑IgA1 byl spojen také se vzestupem proteinurie. To pravděpodobně znamená, že léčba Nefeconem musí být buď trvalá, nebo minimálně opakovaná.
Výrazně novějším přístupem je zásah do signalizace B lymfocytů prostřednictvím systému BAFF/APRIL. APRIL a BAFF jsou cytokiny, které jsou produkovány mj. aktivovanými dendritickými buňkami a slizničními epiteliemi a jsou nezbytné pro proliferaci, maturaci a přežití B lymfocytů, stejně jako pro izotypový přesmyk (class switching). Je prokázáno, že na slizničních površích způsobuje signalizace APRIL přeměnu naivních B lymfocytů na buňky produkující IgA1. APRIL navíc zajišťuje dlouhodobé přežití plazmatických buněk, které jsou primárním zdrojem imunoglobulinů. Důležitým zjištěním bylo, že pacienti s IgAN, vyššími hodnotami gd‑IgA1 a vyšším rizikem progrese selhání měli vyšší koncentrace APRIL v krvi.21 Nakonec byla role APRIL v patogenezi IgAN prokázána i v myším modelu, kde použití anti‑APRIL protilátky vedlo ke snížení hodnot gd‑IgA1, snížení depozice IgA, IgG a C3 v glomerulech a zabránilo vzniku proteinurie.22
Do signalizace BAFF/APRIL zasahuje několik léků. Jedním z nich je sibeprenlimab, který je monoklonální protilátkou proti APRIL a byl testován ve studii fáze II (enVISion), jež prokázala výrazné snížení proteinurie a zpomalení ztráty glomerulární filtrace v průběhu 12 měsíců.23 V současnosti probíhá studie fáze III (VISIONARY), jejíž interim analýza byla prezentována na kongresu ERA (European Renal Association) v červnu 2025 a v níž sibeprenlimab snížil proteinurii během devíti měsíců průměrně o 50 %. Mezi další léky, které jsou v této skupině testovány, patří mezi jinými atacicept. Atacicept ve studii fáze II (ORIGIN) prokázal snížení proteinurie o 35 % za 36 měsíců, snížení hodnot gd‑IgA1 a stabilizaci glomerulární filtrace.24 Tyto výsledky poté byly potvrzeny v prodloužení studie ORIGIN až na 96 měsíců, kdy došlo k průměrnému poklesu proteinurie o 50 %, vymizení hematurie a ke stabilizaci glomerulární filtrace.25 U IgAN se také testuje zigakibart, který v klinické studii fáze I/II prokázal snížení proteinurie, vymizení hematurie a stabilizaci glomerulární filtrace.26
Inhibice glomerulárního zánětu
Pokud není možné produkci a ukládání patologických protilátek snížit, je možné inhibovat zánětlivou reakci v glomerulech. K tomuto účelu byly určeny kortikoidy, které byly testovány v řadě studií včetně velkých studií, jako je STOP‑IgAN a TESTING. V současnosti se používání kortikoidů u pacientů s chronickou IgAN doporučuje pouze v případě, že není k dispozici Nefecon.2 Hlavními důvody odklonu od systémových kortikoidů je jejich nízká efektivita a vysoká toxicita.
Jedním z důležitých mechanismů spuštění zánětlivé reakce v glomerulech je aktivace komplementu. Zdá se, že navzdory přítomnosti imunokomplexů nedochází k aktivaci klasické dráhy, ale k aktivaci dráhy alternativní a u třetiny pacientů také dráhy lektinové.27
Inhibitor aktivace lektinové dráhy narsoplimab (monoklonální protilátka proti MASP‑2) byl u pacientů s IgAN zkoušen ve studii ARTEMIS, ta ale byla zastavena z důvodu nedosažení očekávaného účinku.28 Příčinou je pravděpodobně to, že lektinová dráha je aktivní právě u jedné třetiny pacientů, a u zbylých dvou třetin tedy efekt očekávat nelze.
Oproti tomu mívají biopsie u pacientů s IgAN typicky pozitivitu C3, která ukazuje na aktivaci alternativní dráhy komplementu.29 Inhibitor faktoru B iptacopan, který efektivně blokuje alternativní dráhu, byl testován ve studii APPLAUSE IgAN.30 Pacienti v rameni s iptacopanem měli nižší proteinurii – za devět měsíců byl zaznamenán pokles o cca 40 %. Dále byl iptacopan spojen se zpomalením ztráty funkce ledvin, a dokonce bylo zaznamenáno snížení močových koncentrací C5b‑9, což je hodnoceno jako známka poklesu aktivity komplementu v glomerulech.
Vzhledem k vlivu komplementu na progresi IgAN je testován také inhibitor terminálního komplementu ravulizumab.31 Ravulizumab je monoklonální protilátka, která váže C5 složku komplementu s vysokou specificitou. Ravulizumab byl zkoušen u pacientů s IgAN ve studii fáze II SANCTUARY.32 Pacienti léčení ravulizumabem měli signifikantně nižší proteinurii o cca 40 % a došlo k zastavení ztráty funkce ledvin. Z toho důvodu nyní ravulizumab postoupil do studie fáze III s názvem ICAN (NCT06291376), která nyní nabírá pacienty.
C3 glomerulopatie
Oproti IgA nefropatii je C3 glomerulopatie vzácnou diagnózou, která vždy představovala pro nefrology diagnostickou a terapeutickou výzvu, protože se její klasifikace v posledních letech často měnila a dosavadní terapie nebývala účinná. Morfologickým podkladem je vždy membranoproliferativní glomerulonefritida (MPGN), která se podle dominance barvení komplementu C3 v imunofluorescenci rozděluje na C3 glomerulonefritidu a primární imunokomplexovou MPGN. Onemocnění je vzácné s incidencí 1–4 případy na milion obyvatel a rok.33 Klinicky se onemocnění manifestuje někdy až nefrotickou proteinurií, hematurií a sníženou renální funkcí. Močový nález proto může být jak nefrotický, tak i nefritický. V laboratoři bývá koncentrace C3 v séru snížena. Progrese onemocnění do selhání může být rychlá, takže může připomínat rychle progredující glomerulonefritidy. V polovině případů se onemocnění manifestuje v dětském věku, v druhé polovině případů v rané dospělosti, což předpokládá hereditární podklad nemoci. Po transplantaci ledviny onemocnění rekuruje velmi často a velmi časně, zachytí se v biopsiích provedených během prvního měsíce po transplantaci, kdy ještě není vyvinutý močový nález.34
<p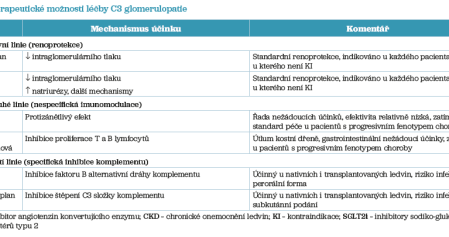 Po vyloučení sekundárních forem onemocnění (nejčastěji infekční a monoklonální gamapatie), kdy jako v jiných případech zbývá jen renoprotekce, je nyní k dispozici terapie, která prokazatelně zpomaluje průběh nemoci a její klinické projevy. Kromě imunosuprese založené na steroidech a mykofenolát mofetilu (doporučení KDIGO) jsou to inhibitory komplementu (tab. 2).
Po vyloučení sekundárních forem onemocnění (nejčastěji infekční a monoklonální gamapatie), kdy jako v jiných případech zbývá jen renoprotekce, je nyní k dispozici terapie, která prokazatelně zpomaluje průběh nemoci a její klinické projevy. Kromě imunosuprese založené na steroidech a mykofenolát mofetilu (doporučení KDIGO) jsou to inhibitory komplementu (tab. 2).
Inhibitory komplementu
Vzhledem k tomu, že na počátku patogeneze C3 glomerulopatií je pravděpodobně hereditární dysregulace komplementu, byla zpočátku jako ultimum refugium léčby použita blokáda C5 komplementu dostupným ekulizumabem. Nejrozsáhlejší informace poskytuje publikace vycházející z francouzského registru.35 Ekulizumab byl účinný jen v méně než polovině případů, úplná remise a částečná remise byly navozeny shodně jen v 23 % případů. Efekt terapie s ekulizumabem byl pozorován převážně u rychle progredující formy onemocnění, kdy byla použita vedle imunosuprese také plazmaferéza.
Vedle ekulizumabu byly a stále jsou testovány ostatní inhibitory komplementu v klinických studiích fází I–III. Avacopan, perorální antagonista receptoru pro C5a, ve studii s C3 glomerulopatií a nemocí denzních depozit (NCT03301467) neuspěl. Během 26 týdnů nedošlo ke změně indexu histologické aktivity onemocnění, v podskupině pacientů ale došlo k poklesu proteinurie.36 Podobně neúspěšná byla fáze II klinické studie s inhibitorem faktoru D danicopanem v indikaci C3G.37 Do III. fáze klinických studií pokročil inhibitor faktoru B iptacopan a inhibitor C3 pegcetacoplan. Oba přípravky ve studiích s C3G anebo C3G/IC-MPGN uspěly, a proto jsou nyní zaváděny do klinické praxe.
Pegcetacoplan
Pegcetacoplan (Aspaveli®, Empaveli®) je malý peptid, který blokuje C3 složku komplementu a aktivaci C3b, takže zabrání štěpení C3, a tak dojde k inhibici aktivace komplementu. Používá se v subkutánní infuzi, která se podává 2× týdně ve fixní dávce. Přípravek je již registrován pro léčbu paroxysmální noční hemoglobinurie, makulární degenerace sítnice a je dokončena studie fáze III v indikaci C3G/IC‑MPGN.
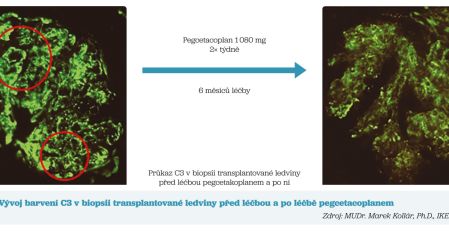 Ve studii II. fáze klinického zkoušení38 s názvem DISCOVERY byl pegcetacoplan podáván osmi pacientům s C3 glomerulopatií. Pacienti měli odhadovanou glomerulární filtraci (eGFR) > 30 ml/min a proteinurii > 750 mg/g, přípravek byl podáván po dobu 48 týdnů, primárním cílem byl pokles proteinurie; bylo dosaženo snížení proteinurie o 48 % oproti začátku studie; šestinásobně se zvýšila koncentrace C3 v séru. Další dokončenou studií fáze II byla NOBLE.39 V této otevřené studii byl pegcetacoplan podáván 10 pacientům po transplantaci ledviny, u kterých byla biopticky prokázána rekurence C3G/IC‑MPGN. Již po 12 týdnech doložily protokolární biopsie snížení histologických známek aktivity onemocnění o 70 %, úplná eliminace histologických známek aktivity byla pozorována u 6 z 9 pacientů, u kterých byla provedena biopsie rok po začátku terapie. VALIANT (NCT05067127) byla randomizovaná, placebem kontrolovaná, dvojitě zaslepená studie fáze III u pacientů s C3G nebo primární IK‑MPGN, která porovnávala 63 pacientů léčených pegcetacoplanem oproti 61 pacientům dostávajícím placebo. Primárním cílem byl pokles proteinurie po 26 týdnech, následovala otevřená část studie, kdy všem pacientům byla po dalších 26 týdnů podávána účinná látka v dávce 1 080 mg 2× týdně v subkutánní infuzi. Léčba pokračuje i po ukončení studie a pacienti jsou sledováni v rámci observační studie VALE do doby, než bude přípravek komerčně dostupný. Tato studie zahrnovala 55 adolescentů a 69 dospělých, 9 pacientů mělo rekurenci v transplantované ledvině, C3G byla zastoupena u 96 pacientů, IC‑MPGN u 28 nemocných. Kontrolní biopsie byly provedeny po 26 a 52 týdnech. Při hodnocení primárního cíle bylo zjištěno, že pegcetacoplan snížil proteinurii o 67,2 % v léčebném rameni, kdežto v kontrolním rameni se proteinurie zvýšila o 2,9 %. K signifikantnímu snížení proteinurie došlo u všech podskupin včetně rekurence po transplantaci ledviny. Během 26 týdnů nastala stabilizace renálních funkcí, kdy v kontrolním rameni poklesla eGFR o 7,8 ml/min, kdežto u pacientů léčených s pegcetacoplanem pouze o 1,5 ml/min. Po 26 týdnech významně poklesla intenzita barvení C3 v biopsiích a 71 % nemocných C3 v biopsii detekováno nemělo. Sami jsme se již přesvědčili o účinnosti této léčby u rekurující C3G (obr. 1).
Ve studii II. fáze klinického zkoušení38 s názvem DISCOVERY byl pegcetacoplan podáván osmi pacientům s C3 glomerulopatií. Pacienti měli odhadovanou glomerulární filtraci (eGFR) > 30 ml/min a proteinurii > 750 mg/g, přípravek byl podáván po dobu 48 týdnů, primárním cílem byl pokles proteinurie; bylo dosaženo snížení proteinurie o 48 % oproti začátku studie; šestinásobně se zvýšila koncentrace C3 v séru. Další dokončenou studií fáze II byla NOBLE.39 V této otevřené studii byl pegcetacoplan podáván 10 pacientům po transplantaci ledviny, u kterých byla biopticky prokázána rekurence C3G/IC‑MPGN. Již po 12 týdnech doložily protokolární biopsie snížení histologických známek aktivity onemocnění o 70 %, úplná eliminace histologických známek aktivity byla pozorována u 6 z 9 pacientů, u kterých byla provedena biopsie rok po začátku terapie. VALIANT (NCT05067127) byla randomizovaná, placebem kontrolovaná, dvojitě zaslepená studie fáze III u pacientů s C3G nebo primární IK‑MPGN, která porovnávala 63 pacientů léčených pegcetacoplanem oproti 61 pacientům dostávajícím placebo. Primárním cílem byl pokles proteinurie po 26 týdnech, následovala otevřená část studie, kdy všem pacientům byla po dalších 26 týdnů podávána účinná látka v dávce 1 080 mg 2× týdně v subkutánní infuzi. Léčba pokračuje i po ukončení studie a pacienti jsou sledováni v rámci observační studie VALE do doby, než bude přípravek komerčně dostupný. Tato studie zahrnovala 55 adolescentů a 69 dospělých, 9 pacientů mělo rekurenci v transplantované ledvině, C3G byla zastoupena u 96 pacientů, IC‑MPGN u 28 nemocných. Kontrolní biopsie byly provedeny po 26 a 52 týdnech. Při hodnocení primárního cíle bylo zjištěno, že pegcetacoplan snížil proteinurii o 67,2 % v léčebném rameni, kdežto v kontrolním rameni se proteinurie zvýšila o 2,9 %. K signifikantnímu snížení proteinurie došlo u všech podskupin včetně rekurence po transplantaci ledviny. Během 26 týdnů nastala stabilizace renálních funkcí, kdy v kontrolním rameni poklesla eGFR o 7,8 ml/min, kdežto u pacientů léčených s pegcetacoplanem pouze o 1,5 ml/min. Po 26 týdnech významně poklesla intenzita barvení C3 v biopsiích a 71 % nemocných C3 v biopsii detekováno nemělo. Sami jsme se již přesvědčili o účinnosti této léčby u rekurující C3G (obr. 1).
Tyto informace byly zatím prezentovány na kongresech v USA a v Evropě. Nehledě na absenci finální publikace byla tato data natolik přesvědčivá, že přípravek již byl 28. 7. 2025 registrován americkým Úřadem pro kontrolu potravin a léčiv (FDA) pro léčbu C3G a IC‑MPGN.
Iptacopan
Do klinické praxe míří také iptacopan. Iptacopan (Fabhalta®) již byl registrován FDA pro léčbu C3 glomerulopatie v březnu 2025 a v květnu jej schválila Evropská agentura pro léčivé přípravky (EMA). Iptacopan je perorálním inhibitorem faktoru B, čímž dochází k inhibici alternativní cesty aktivace komplementu. Již byl schválen také pro léčbu paroxysmální noční hemoglobinurie a je dále úspěšně testován i pro léčbu IgA nefropatie (viz výše).
V indikaci C3 glomerulopatie byl iptacopan testován v několika studiích jak u pacientů s onemocněním nativních ledvin, tak i s rekurencí po transplantaci ledviny. Ve studii fáze II,40 která byla otevřená a jednoramenná, byl iptacopan podáván 2× denně 16 pacientům s C3G v nativních ledvinách a 11 pacientům s rekurujícím onemocněním. Primárním cílem bylo opět snížení proteinurie, u nativních ledvin se proteinurie snížila o 45 % oproti výchozím hodnotám a u rekurencí po transplantaci byly prováděny biopsie, ve kterých byl patrný 2,5násobný pokles podílu depozit C3 ve štěpu. V extenzi této studie41 byly analyzovány výsledky po 12 měsících léčby, proteinurie poklesla o 57 % a došlo ke zlepšení renální funkce oproti výchozím hodnotám o 6,83 ml/min. U pacientů s rekurencí se funkce štěpu nezměnila a zvýšily se koncentrace C3 v séru. V současnosti stále probíhá studie fáze III APPEAR‑C3G, která je randomizovaná a placebem kontrolovaná. Po šesti měsících byli v této studii všichni nemocní převedeni na aktivní léčbu s iptacopanem podávaným v dávce 200 mg dvakrát denně per os.42 Výsledky studie jsou očekávány v roce 2026.
Závěr
Dosažené pokroky v léčbě IgA nefropatie a C3 glomerulopatie představují naději pro mnoho pacientů, u kterých by progresivní onemocnění vedlo nezadržitelně k selhání ledvin. Výsledky klinických studií jsou přesvědčivé, a proto jsou nové léky schvalovány medicínskými agenturami. Protože jde v principu o medikamenty pro terapii vzácných onemocnění, je jasné, že je tato léčba ekonomicky velmi nákladná, což může představovat zdržení při jejich zavádění do klinické praxe v našich podmínkách. Nezpochybnitelnou rolí odborných společností je přispět k definování skupin pacientů, pro které jsou tyto léky indikovány, a centralizovat tuto péči do několika pracovišť. Jedině tento postup bude znamenat racionální využití prostředků, jež musejí být alokovány tak, aby z této inovativní terapie měli prospěch potencionálně všichni indikovaní nemocní z celé České republiky.
MUDr. Vojtěch Petr, prof. MUDr. Ondřej Viklický, CSc.
Klinika nefrologie, Transplantační centrum;
Institut klinické a experimentální medicíny
Korespondenční adresa:ondrej.viklicky@ikem.cz
Literatura
- Petr V, Zahrádka I. Biopsie ledvin u mladých pacientů. Farmakoter Rev 2025;10:123–127.
- KDIGO. KDIGO 2024 Clinical Practice Guideline for the Management of Immunoglobulin A Nephropathy (IgAN) and Immunoglobulin A Vasculitis (IgAV), Public Review Draft Summary of Recommendation Statements and Practice Points. Published online August 15, 2024.
- Pitcher D, Braddon F, Hendry B, et al. Long‑Term Outcomes in IgA Nephropathy. Clin J Am Soc Nephrol 2023;18:727–738. doi:10.2215/CJN.0000000000000135
- Seikrit C, Stamellou E, Rauen T, Floege J. TESTING the effects of corticosteroids in patients with IgA nephropathy. Nephrol Dial Transplant 2022;37: 1786–1788. doi:10.1093/ndt/gfac221
- Ryšavá R, Viklický O. Vybrané doporučené postupy v nefrologii. Praha: Maxdorf, 2022.
- Floege J, Bernier‑Jean A, Barratt J, Rovin B. Treatment of patients with IgA nephropathy: a call for a new paradigm. Kidney Int 2025;107:640–651. doi:10.1016/j.kint.2025.01.014
- Praga M, Gutiérrez E, González E, et al. Treatment of IgA Nephropathy with ACE Inhibitors: A Randomized and Controlled Trial. J Am Soc Nephrol 2003;14:1578–1583. doi:10.1097/01.asn.0000068460.37369.dc
- Wheeler DC, Toto RD, Stefánsson BV, et al. A pre‑specified analysis of the DAPA‑CKD trial demonstrates the effects of dapagliflozin on major adverse kidney events in patients with IgA nephropathy. Kidney Int 2021;100:215–224. doi:10.1016/j.kint.2021.03.033
- Judge P, Staplin N, Mayne K, et al. Impact of primary kidney disease on the effects of empagliflozin in patients with chronic kidney disease: secondary analyses of the EMPA‑KIDNEY trial. Lancet Diabetes Endocrinol 2024;12:51–60. doi:10.1016/s2213‑8587(23)00322‑4
- Kohan DE, Barratt J, Heerspink HJL, et al. Targeting the Endothelin A Receptor in IgA Nephropathy. Kidney Int Rep 2023;8:2198–2210. doi:10.1016/j.ekir.2023.07.023
- Tycová I, Hrubá P, Maixnerová D, et al. Molecular profiling in IgA nephropathy and focal and segmental glomerulosclerosis. Physiol Res 2018;67:93–105. doi:10.33549/physiolres.933670
- Ku E, Tighiouart H, McCulloch CE, et al. Association between Acute Declines in eGFR during Renin‑Angiotensin System Inhibition and Risk of Adverse Outcomes. J Am Soc Nephrol 2024;35:1402–1411. doi:10.1681/asn.0000000000000426
- Heerspink HJL, Cherney DZI. Clinical Implications of an Acute Dip in eGFR after SGLT2 Inhibitor Initiation. Clin J Am Soc Nephrol 2021;16:1278–1280. doi:10.2215/CJN.02480221
- Kim SG, Inker LA, Packham DK, et al. WCN23‑1126 ATRASENTAN FOR THE TREATMENT OF IGA NEPHROPATHY: INTERIM RESULTS OF THE AFFINITY STUDY. Kidney Int Rep 2023;8:1902. doi:10.1016/j.ekir.2023.02.1088
- Heerspink HJL, Jardine M, Kohan DE, et al. Atrasentan in Patients with IgA Nephropathy. N Engl J Med 2025;392:544–554. doi:10.1056/nejmoa2409415
- Heerspink HJL, Radhakrishnan J, Alpers CE, et al. Sparsentan in patients with IgA nephropathy: a prespecified interim analysis from a randomised, double‑blind, active‑controlled clinical trial. The Lancet 2023;401:1584–1594. doi:10.1016/S0140‑6736(23)00569‑X
- Rovin BH, Barratt J, Heerspink HJL, et al. Efficacy and safety of sparsentan versus irbesartan in patients with IgA nephropathy (PROTECT): 2‑year results from a randomised, active‑controlled, phase 3 trial. The Lancet 2023;402:2077–2090. doi:10.1016/s0140‑6736(23)02302‑4
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2024 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int 2024;105(4S):S117–S314. doi:10.1016/j.kint.2023.10.018
- Lafayette RA, Canetta PA, Rovin BH, et al. A Randomized, Controlled Trial of Rituximab in IgA Nephropathy with Proteinuria and Renal Dysfunction. J Am Soc Nephrol 2017;28:1306–1313. doi:10.1681/asn.2016060640
- Lafayette R, Kristensen J, Stone A, et al. Efficacy and safety of a targeted‑release formulation of budesonide in patients with primary IgA nephropathy (NefIgArd): 2‑year results from a randomised phase 3 trial. The Lancet 2023;402:859–870. doi:10.1016/s0140‑6736(23)01554‑4
- Han SS, Yang SH, Choi M, et al. The Role of TNF Superfamily Member 13 in the Progression of IgA Nephropathy. J Am Soc Nephrol 2016;27:3430–3439. doi:10.1681/ASN.2015060677
- Myette JR, Kano T, Suzuki H, et al. A Proliferation Inducing Ligand (APRIL) targeted antibody is a safe and effective treatment of murine IgA nephropathy. Kidney Int 2019;96:104–116. doi:10.1016/j.kint.2019.01.031
- Mathur M, Barratt J, Chacko B, et al. A Phase 2 Trial of Sibeprenlimab in Patients with IgA Nephropathy. N Engl J Med 2024;390:20–31 doi:10.1056/nejmoa2305635
- Lafayette R, Barbour S, Israni R, et al. A phase 2b, randomized, double‑blind, placebo‑controlled, clinical trial of atacicept for treatment of IgA nephropathy. Kidney Int 2024;105:1306–1315. doi:10.1016/j.kint.2024.03.012
- Barratt J, Barbour SJ, Brenner RM, et al. Long‑Term Results from an Open‑Label Extension Study of Atacicept for the Treatment of IgA Nephropathy. J Am Soc Nephrol 2025;36:679–687. doi:10.1681/ASN.0000000541
- Kooienga L, Lo J, Lee EY, et al. Zigakibart demonstrates clinical safety and efficacy in a Phase 1/2 trial of healthy volunteers and patients with IgA nephropathy. Kidney Int Published online June 2025:S0085253825004144. doi:10.1016/j.kint.2025.05.006
- Roos A, Rastaldi MP, Calvaresi N, et al. Glomerular activation of the lectin pathway of complement in IgA nephropathy is associated with more severe renal disease. J Am Soc Nephrol 2006;17:1724–1734. doi:10.1681/ASN.2005090923
- Omeros. https://investor.omeros.com/news‑releases/news‑release‑details/omeros‑corporation‑provides‑update‑interim‑analysis‑artemis‑igan. Published online October 13, 2023.
- Petr V, Thurman JM. The role of complement in kidney disease. Nat Rev Nephrol. Published online September 21, 2023. doi:10.1038/s41581‑023‑00766‑1
- Perkovic V, Barratt J, Rovin B, et al. Alternative Complement Pathway Inhibition with Iptacopan in IgA Nephropathy. N Engl J Med. Published online October 25, 2024:NEJMoa2410316. doi:10.1056/NEJMoa2410316
- Syed YY. Ravulizumab: A Review in Atypical Haemolytic Uraemic Syndrome. Drugs 2021;81:587–594. doi:10.1007/s40265‑021‑01481‑6
- Lafayette R, Tumlin J, Fenoglio R, et al. Efficacy and Safety of Ravulizumab in IgA Nephropathy: A Phase 2 Randomized Double‑Blind Placebo‑Controlled Trial. J Am Soc Nephrol. Published online October 25, 2024. doi:10.1681/ASN.0000000534
- Smith RJH, Appel GB, Blom AM, et al. C3 glomerulopathy — understanding a rare complement‑driven renal disease. Nat Rev Nephrol. Published online 2019. doi:10.1038/s41581‑018‑0107‑2
- Tarragón B, Peleg Y, Jagannathan G, et al. C3 Glomerulopathy Recurs Early after Kidney Transplantation in Serial Biopsies Performed within the First 2 Years after Transplantation. Clin J Am Soc Nephrol 2024;19:1005–1015. doi:10.2215/CJN.0000000000000474
- Le Quintrec M, Lionet A, Kandel C, et al. Eculizumab for treatment of rapidly progressive C3 glomerulopathy. Am J Kidney Dis Off J Natl Kidney Found 2015;65:484–489. doi:10.1053/j.ajkd.2014.09.025
- Bomback AS, Herlitz LC, Kedia PP, et al. Safety and Efficacy of Avacopan in Patients with Complement 3 Glomerulopathy: Randomized, Double‑Blind Clinical Trial. J Am Soc Nephrol 2025;36:487–499. doi:10.1681/asn.0000000526
- Nester C, Appel GB, Bomback AS, et al. Clinical Outcomes of Patients with C3G or IC‑MPGN Treated with the Factor D Inhibitor Danicopan: Final Results from Two Phase 2 Studies. Am J Nephrol 2022;53:687–700. doi:10.1159/000527167
- Dixon BP, Greenbaum LA, Huang L, et al. Clinical Safety and Efficacy of Pegcetacoplan in a Phase 2 Study of Patients with C3 Glomerulopathy and Other Complement‑Mediated Glomerular Diseases. Kidney Int Rep 2023;8:2284–2293. doi:10.1016/j.ekir.2023.08.033
- Bomback AS, Daina E, Remuzzi G, et al. Efficacy and Safety of Pegcetacoplan in Kidney Transplant Recipients With Recurrent Complement 3 Glomerulopathy or Primary Immune Complex Membranoproliferative Glomerulonephritis. Kidney Int Rep. Published online October 2024:S2468024924019612. doi:10.1016/j.ekir.2024.09.030
- Wong E, Nester C, Cavero T, et al. Efficacy and Safety of Iptacopan in Patients With C3 Glomerulopathy. Kidney Int Rep 2023;8:2754–2764. doi:10.1016/j.ekir.2023.09.017
- Nester CM, Eisenberger U, Karras A, et al. Iptacopan Reduces Proteinuria and Stabilizes Kidney Function in C3 Glomerulopathy. Kidney Int Rep 2025;10:432–446. doi:10.1016/j.ekir.2024.10.023
- Bomback AS, Kavanagh D, Vivarelli M, et al. Alternative Complement Pathway Inhibition With Iptacopan for the Treatment of C3 Glomerulopathy‑Study Design of the APPEAR‑C3G Trial. Kidney Int Rep 2022;7:2150–2159. doi:10.1016/j.ekir.2022.07.004