Multioborový přístup k diagnostice Castlemanovy choroby

Kongres European Alliance of Associations for Rheumatology (EULAR) 2023 se konal na přelomu května a června v italském Miláně. V rámci tohoto odborného setkání uspořádala společnost EUSA Pharma/Recordati satelitní sympozium s názvem Unexplained lymfadenopaties: how a multidisciplinary approach can lead to a better diagnosis (Nevysvětlitelné lymfadenopatie: jak může multioborový přístup zlepšit diagnostiku). Obsah prezentací byl zaměřen na idiopatickou multicentrickou Castlemanovu chorobu (iMCD) a na to, proč by na toto vzácné onemocnění měli myslet i revmatologové. Hvězdou sympozia pak byl doktor David Fajgenbaum, pacient s iMCD, zakladatel Castleman Disease Collaborative Network (CDCN), lékař, imunolog, vědec a organizátor, díky němuž se iMCD a Castlemanově chorobě (CD) věnuje více pozornosti.
Sympoziu předsedal profesor Carlo Selmi (Univerzita v Boloni), který současně představil styčné body revmatických autoimunních onemocnění a CD. „Vzácná onemocnění existují a musíme na ně myslet. Mnohá z nich již umíme léčit,“ uzavřel předsedající. V následné prezentaci vysvětlila doktorka Puja Mehtová (University College Londýn) zásady diferenciální diagnostiky iMCD a nastínila možnosti její léčby na příkladu kazuistiky 51letého muže. Zdůraznila, že u iMCD s těžkým průběhem je v pozadí akutní hyperinflamatorní stav a cytokinová bouře, u níž je nutné co nejdříve terapeuticky zasáhnout. Velmi užitečná je jak v diagnostice, tak v léčbě spolupráce patologa, infekcionisty, revmatologa, chirurga a hematologa. Pacient s iMCD se však může objevit v ordinaci/na oddělení jakékoli specializace a je důležité na tuto vzácnou, ale život ohrožující diagnózu myslet.
Tyto dvě vynikající prezentace však byly zcela zastíněny vystoupením dr. Davida Fajgenbauma Management iMCD z pohledu pacienta a odborníka (iMCD disease management: the patient and expert perspective).
Castlemanova choroba
V souhrnu zde přinášíme základní informace o Castlemanově chorobě (CD). Onemocnění nese název po americkém patologovi Benjaminu Castlemanovi z Massachusetts, který je popsal v roce 1956 [1]. Castlemanova choroba (CD) zahrnuje skupinu nejméně čtyř proliferativních lymfadenopatií, které mají podobné spektrum charakteristických histopatologických rysů, ale liší se etiologií, klinickým obrazem, léčebnými postupy a prognózou [2,3,4].
Castlemanova choroba může být unicentrická nebo multicentrická.
Unicentrická CD (zvětšená je jedna uzlina nebo nízký počet uzlin v jedné lokalizaci) je zpravidla bez příznaků nebo má mírné útlakové symptomy. Chirurgická resekce bývá kurativní a prognóza pacientů velmi dobrá. U neresekovatelných případů se zánětlivými projevy připadá v úvahu anti IL‑6 terapie (siltuximab), při útlakové symptomatologii lze zvážit farmakoterapii (rituximab, kortikosteroidy), radioterapii či embolizaci [5].
Multicentrická CD má další podskupiny:
U iMCD lze dále rozlišit
Idiopatická multicentrická forma Castlemanovy choroby (iMCD)
Jde o specifickou formu CD, která tvoří 30–60 procent MCD [3]. Epidemiologická data z ČR nejsou k dispozici. Podle nově provedené analýzy v USA je odhadovaná roční incidence 3,4 případu na milion obyvatel a prevalence 6,9 případu na milion obyvatel [6]. To znamená, že v ČR by ročně mohlo být diagnostikováno kolem 35 případů iMCD a prevalence by mohla činit asi 80 jedinců s iMCD.
Klíčovou roli u rozvoje akutního hyperinflamatorního stavu hraje interleukin 6 (IL‑6). Příčina jeho zvýšené produkce je nejasná. Virový původ se nezdá být pravděpodobný. Autoprotilátky jsou přítomny u přibližně 25 procent pacientů s iMCD. Často jsou nalézány polymorfismy receptoru pro IL‑6. Existují také důkazy pro neoplastickou etiologii se zvýšeným rizikem hematologických malignit a klinicko‑patologickou podobností s Hodgkinovým lymfomem a myelofibrózou. Monoklonální plazmatické buňky pak patří k obrazu syndromu POEMS [2].
Klinický průběh iMCD může být od velmi mírného flu‑like až po život ohrožující sepsis‑like. Idiopatická MCD může postihnout jakýkoli orgán a může vést k fatálnímu multiorgánovému selhání; neléčená iMCD má 35% pětiletou mortalitu, do deseti let zemře 60 procent pacientů s iMCD [3]. Příznaky a diagnostický postup jsou uvedeny v tabulce.
Diagnóza není podle histopatologů snadná. Bioptické vzorky bývají popsány jako nespecifická zánětlivá lymfoproliferace, proto bývá nutná opakovaná konzultace klinických lékařů a patologů. K diagnóze MCD přispěje PET/CT nebo PET/MR s 18F-fludeoxyglukózou, při níž se radioaktivní kontrast akumuluje v postižených uzlinách, a tak se ozřejmí rozsah postižení.
Základním pravidlem je reference pacienta (i s podezřením na CD) do specializovaného centra.
Terapie
Jediným specifickým léčivým přípravkem schváleným pro léčbu IMCD je siltuximab (Sylvant). Používá se jak u méně závažné, tak těžké iMCD. Léčebné (doposud platné) schéma terapie navrhl profesor Frits van Rhee s kolegy v roce 2018 [4]. Místo v něm mají kortikosteroidy, off‑label tocilizumab a rituximab. U těžkých forem se podává kombinovaná chemoterapie, imunomodulační terapie (mTOR) (viz graf)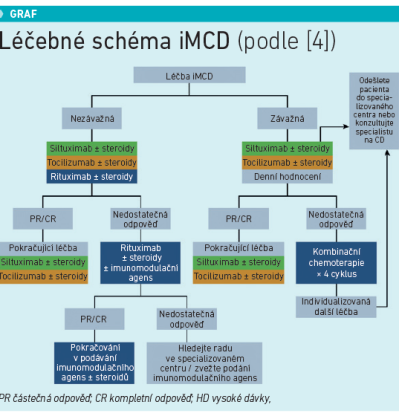
Management iMCD z pohledu pacienta a odborníka
David Fajgenbaum, MD, MBA, MSc. (Pennsylvania, Center for Cyrokine Storm Treatment & Laboratory; Associate Director, Orphan Disease Center, University of Pennsylvania; Co‑Founder & President, Castleman Disease Collaborative Network (CDCN); Co‑Founder, Every Cure), přijal na základě vlastní zkušenosti za svůj životní program a cíl věnovat se výzkumu, publikacím i publicitě, pacientské advokacii, vývoji nových léčebných metod v oblasti idiopatické multicentrické Castlemanovy choroby.
Jeho prezentace na EULAR 2023 nazvaná iMCD disease management: the patient and expert perspective byla vskutku fascinující, jak bývá u tohoto mladého lékaře pravidlem.
Chasing my cure
David Fajgenbaum věnoval úvod přednášky svému osobnímu příběhu, který popsal i v knize Chasing my Cure: A Doctor’s Race to Turn Hope into Action (Hon za léčbou: doktorův závod o proměnu naděje v činy) [9].
Své vyprávění začíná v době, kdy u něj byla v dětství diagnostikována porucha obecně známá jako ADHD (attention deficit hyperactivity disorder, porucha pozornosti s hyperaktivitou), kterou zvládal díky sportu, ale která mu umožnila v případě extrémního zájmu věnovat se jedné věci velmi intenzivně po dlouhou dobu (na rozdíl od záležitostí, které jej nebavily). Brzy pochopil, že nemá talent pro atletiku, a napřel své úsilí jinam. Díky vytrvalosti a tvrdému tréninku vynikl jako rozehrávač středoškolského týmu amerického fotbalu. Když mu bylo 18 let, byl jeho matce diagnostikován glioblastom, kterému za tři roky podlehla.
David Fajgenbaum inklinoval po vzoru otce – ortopeda ke studiu medicíny. Smrt matky jej přivedla k rozhodnutí stát se onkologem, aby mohl léčbou zachraňovat lidské životy. „Save the lives“ je jeho životním mottem dodnes.
V průběhu prvních let studia na univerzitě (Perelman School of Medicine of the University of Pennsylvania) se v létě 2010 u Davida Fajgenbauma v jeho 25 letech velmi rychle rozvinulo zvláštní onemocnění: nejprve si povšiml zvětšené inguinální uzliny, pak se objevily hemangiomy po celém těle a současně jej – výkonného sportovce – přemohla vysilující únava. Přidalo se noční pocení a otoky. Pro zhoršení stavu byl přijat do nemocnice a v několika málo dnech skončil na jednotce intenzivní péče pro multiorgánové selhání s následujícími nálezy:
Celé týdny nikdo nevěděl, jakou chorobou David trpí. Jeho stav se navzdory intenzivní léčbě nelepšil, měl trvalou nauzeu, ascites a otoky (cca 35 l), retinopatii, bezvědomí se střídalo se zastřeným vědomím. Byla vyloučena infekce, onkologická onemocnění, autoimunity. Až po týdnech patolog určil z bioptického vzorku uzliny diagnózu – Castlemanova choroba. Jenže znalostí diagnózy se David Fajgenbaum neuzdravil. Nezabíraly kortikoidy ani anti‑IL-6 léky. Při životě jej udržela agresivní chemoterapie a po měsících se dostavila remise. Naštěstí měl z doby intenzivního sportování značnou zásobu svalové hmoty, která byla zdrojem energie v době nemoci. Bez ní by možná na EULAR nikdy nepřednášel.
Pacientský příběh tím nekončí: David Fajgenbaum přežil celkem tři těžké relapsy postupně přesněji diagnostikované idiopatické (HHV‑8 negativní) multicentrické Castlemanovy choroby. V akutním stadiu byla jeho iMCD refrakterní ke všem léčebným modalitám s výjimkou agresivních chemoterapeutických režimů. Retrospektivním vyšetřením krevních vzorků bylo zjištěno, že relapsu vždy předcházel výsev nových hemangiomů na základě nadprodukce VEGF (vaskulární endoteliální růstový faktor), který má na svědomí angioneogenezi, zvýšená koncentrace IL‑6 následovala vzápětí. Sám na sobě vyzkoušel imunomodulaci sirolimem s částečným efektem. Nakonec byl nalezen dlouhodobý léčebný režim, který mu umožňuje žít normálním životem (od roku 2012). Oženil se a má se svou ženou Caitlin dvě děti.
Profesně se naplno věnuje iMCD: založil Castleman Disease Collaborative Network (CDCN), nadaci věnující se podpoře pacientů se stále smrtelnou iMCD. Životopis tohoto 38letého lékaře, vědce, imunologa, organizátora je delší než celoživotní soupis aktivit mnoha světově uznávaných kapacit.
Co dělat, když léčba anti‑IL‑6 nefunguje?
Jak u sebe, tak následně u pacientů dr. Fajgenbaum zvažuje klíčové otázky:
Odpovědi na obtížně léčitelné formy iMCD hledají autoři v kazuistickém zpracování, které bylo uveřejněno v roce 2022 [10]. Dr. Fajgenbaum, spoluautor této práce, v přednášce poukázal na mírně inovované schéma z roku 2018 [4].
V první řadě by pacienti po diagnóze iMCD měli být odesláni do specializovaného centra (v USA do Castleman Disease Collaborative Network). Doporučuje se také posouzení závažnosti onemocnění pro stanovení harmonogramu aplikace siltuximabu a výše dávek kortikosteroidů. Za těžkou iMCD se považuje, jsou‑li splněna alespoň dvě kritéria z následujících:
U těžké iMCD by jakékoli zhoršení orgánových funkcí po zahájení léčby siltuximabem a vysokými dávkami kortikosteroidů (KS) mělo vést ke zvážení kombinované chemoterapie. Pacienti s těžkou iMCD, u kterých dojde k částečné nebo kompletní odpovědi na siltuximab, mohou pokračovat v léčbě každý týden po dobu čtyř cyklů a následně deeskalovat na léčbu každé tři týdny.
U nezávažné iMCD mohou být pacienti léčeni siltuximabem každé tři týdny s KS, a pokud je dosaženo dlouhodobé, trvalé remise, lze intervaly prodloužit na šest týdnů a vysadit KS.
U všech pacientů, jejichž onemocnění je refrakterní k siltuximabu, je vhodné zvážit zařazení pacienta do klinické studie (například se sirolimem), podání rituximabu (off label), kombinace thalidomid + cyklofosfamid + prednison, případně podání dalšího imunomodulátoru.
Prediktivní faktory odpovědi na siltuximab
Heterogenita patomechanismů u iMCD stojí za skutečností, že někteří pacienti odpovídají na terapii anti‑IL‑6 výborně a dosahují kompletní dlouhodobé odpovědi, ale mnozí pacienti stěží dosáhnou parciální odpovědi nebo jsou non‑respondéry. Idiopatická MCD je stále v mnoha případech letální.
Proteomická analýza
Zatím nelze rutinně využívat prediktivní faktory léčebné odpovědi na siltuximab. Jsou však uveřejněny první práce, které se v tomto ohledu zdají slibné. Sheila Piersonová se spolupracovníky uveřejnila proteomickou analýzu vzorků 88 pacientů s iMCD a 60 pacientů s podobnými (překrývajícími se) onemocněními (HHV‑8 MCD, Hodgkinův lymfom, revmatoidní artritida) a 42 zdravými kontrolami [11]. Analýza pomocí panelu sedmi analytů (apolipoprotein E, amfiregulin, P‑komponenta sérového amyloidu, inaktivovaný komplement C3b, imunoglobulin E, IL‑6, erytropoetin) odhalila novou podskupinu pacientů s iMCD s lepší odpovědí na siltuximab Zároveň byla identifikována Janusova kináza a aktivátor signální dráhy STAT 3 jako možné terapeutické cíle u non‑respondérů na siltuximab. Tato proteomická analýza však bohužel není zavedena do rutinní klinické praxe.
CXCL13
Porovnáním koncentrací 1 178 proteinů v sérech zdravých účastníků (N = 42), pacientů s iMCD (N = 88) a s příbuznými chorobami (N = 60) byl identifikován a validován chemokin ligand‑13 (CXCL13) jako protein nejvýrazněji up‑regulovaný u iMCD. Časné a významné snížení koncentrace CXCL13 jasně odlišuje respondéry na siltuximab od nereagujících; 17% snížení CXCL13 do osmého dne po zahájení terapie siltuximabem předpovídá dobrou odpověď v 64. dni. Studie naznačuje, že CXCL13 je prediktivním biomarkerem odpovědi na siltuximab u iMCD [12].
Patologická signální dráha PI3K/AKT/mTOR u anti‑IL‑6 refrakterní iMCD
Studie tří případů iMCD refrakterních k anti-IL‑6 odhalila zvýšenou aktivaci CD8+ T lymfocytů, VEGF‑A a aktivitu signální dráhy PI3K/Akt/mTOR. Podávání sirolimu podstatně zeslabilo aktivaci CD8+ T lymfocytů a snížilo koncentraci VEGF‑A. Sirolimus vyvolal klinickou odpověď u všech tří pacientů a setrvalou remisi po dobu 66, 19 a 19 měsíců. Tento přístup precizní medicíny identifikuje signální dráhu PI3K/Akt/mTOR jako první cíl pro farmakologické ovlivnění průběhu iMCD refrakterní na blokádu IL‑6. Plánuje se prospektivní studie účinnosti sirolimu u iMCD refrakterní na léčbu anti‑IL‑6 [12].
Budoucnost je ve spolupráci
V letech 2012–2023 došlo v oblasti poznání iMCD k velkým pokrokům, ale stále ještě není splněn sen Davida Fajgenbauma – průkaz iMCD z jediného vzorku krve, rutinně dostupné prediktory účinnosti léčby anti‑IL‑6 a vícero terapeutických modalit. K dosažení těchto ambicí přispívá spolupráce všech odborníků po celém světě. Závěrem dr. Fajgenbaum vyzval všechny kolegy i pacienty, aby neváhali a připojili se k jeho iniciativám: davidfa@pennmedicine.upenn.edu.
Siltuximab: první a jediný léčivý přípravek schválený k terapii Castlemanovy choroby
Siltuximab (Sylvant) je chimerická monoklonální protilátka podtřídy IgG1 cílená přímo proti IL‑6. V roce 2014 byly uveřejněny výsledky multicentrické randomizované, dvojitě zaslepené, placebem kontrolované studie. Zařazeno do ní bylo 79 pacientů s iMCD (53 s léčbou siltuximabem; 23 s placebem). Všem pacientům byla poskytnuta nejlepší podpůrná péče. Pacienti pokračovali v terapii až do selhání léčby. Primárním cílovým parametrem byla trvalá lymfatická a symptomatická odpověď po dobu alespoň 18 týdnů u léčené populace.
Kompletní odpovědi dosáhlo 18 pacientů (34 %) ze skupiny siltuximabu a žádný v placebové skupině (p = 0,0012). Výskyt závažných nežádoucích účinků byl podobný v obou skupinách (23 % vs. 19 %). U tří (6 %) z 53 pacientů se vyskytly závažné nežádoucí účinky, které byly vyhodnoceny jako nežádoucí účinek siltuximabu (infekce dolních cest dýchacích, anafylaktická reakce, sepse). Z laboratorních abnormalit se nejčastěji objevovaly trombocytopenie, anémie, neutropenie. V souvislosti s léčbou nedošlo k žádnému úmrtí [14,15].
Jenna Sitengová s kolegy provedla systematický přehled zahrnující 171 případů pacientů s MCD (většina s iMCD) léčených siltuximabem se závěrem: Zatímco při použití tradičních léčebných metod dosáhlo pětiletého přežití pouze 55–77 procent pacientů, výsledky léčby siltuximabem prokázaly pětileté přežití téměř v 96,4 procenta.
Výsledky mnoha klinických studií prokázaly, že siltuximab je extrémně účinný při zmírňování symptomů onemocnění (únava, bolest a lymfadenopatie) a současně v dosažení remise onemocnění [16].