Paroxysmální noční hemoglobinurie ve dvou kazuistikách
Paroxysmální noční hemoglobinurie (PNH) je získaná klonální porucha kmenové krvetvorné buňky, podkladem je chronická aktivace komplementu při deficitu přirozených inhibitorů komplementu na povrchu krevních buněk. Onemocnění se projevuje zejména intravaskulární hemolytickou anémií, trombofilním stavem s rizikem trombotických komplikací a rozvojem cytopenií v důsledku selhání krvetvorby. Včasná diagnostika onemocnění je důležitá a může předejít rozvoji závažných komplikací, jak ukazuje případ nemocného, u něhož došlo k rozvoji PNH po kombinované imunosupresivní léčbě a jaterní selhání při trombotických komplikacích bylo prvním příznakem choroby. Těhotenství pacientek s PNH bylo dříve zatíženo vysokou mortalitou jak matek, tak plodů. Podávání inhibitorů komplementu vedlo k výraznému poklesu výskytu trombotických komplikací a k signifikantnímu vzestupu hodnot hemoglobinu. Ukazuje se, že je možné na terapii ekulizumabem provést pacientky graviditou až k porodu zdravého plodu, jak dokládá kazuistika opakované úspěšné gravidity u naší nemocné s PNH.
Úvod
Paroxysmální noční hemoglobinurie (PNH) je vzácné získané onemocnění hematopoetické kmenové buňky, jehož hlavním patofyziologickým podkladem je chronická aktivace komplementu na povrchu krevních elementů. Onemocnění se projevuje hemoglobinurií při intravaskulární hemolýze, trombofilním stavem s rizikem trombotických komplikací a rozvojem cytopenie při selhání krvetvorby.1 Až u 40 % nemocných mohou být tyto příznaky málo vyjádřeny a prvním projevem choroby mohou být trombotické komplikace a jejich důsledky.2 Monoklonální protilátky proti C5 či C3 složce komplementu vedou u pacientů k významné redukci hemolýzy a rizika tromboembolismu.3 Recentní publikace ukazují, že je možné na terapii inhibitory C5 složky komplementu provést pacientky graviditou až k porodu zdravého plodu.4
Rozvoj PNH u nemocného léčeného pro aplastickou anémii
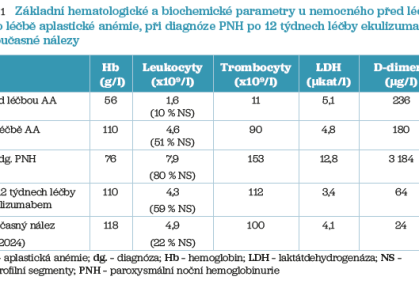 Čtrnáctiletý chlapec byl přijat v lednu 1996 na Kliniku dětské hematologie a onkologie 2. LF UK a FN Motol v Praze s obrazem velmi těžké aplastické anémie (hodnoty krevního obrazu jsou uvedeny v tab. 1). Nemocný byl léčen kombinovanou imunosupresí (antithymocytární globulin + kortikosteroidy + cyklosporin A). Po prvním cyklu léčby nebylo dosaženo odpovědi, a proto byl nemocnému podán druhý cyklus imunosuprese (antilymfocytární globulin + kortikosteroidy + cyklosporin A). Po této léčbě byla přítomna odpověď ve všech řadách (hodnoty jsou uvedeny rovněž v tab. 1), imunosuprese byla postupně redukována a v prosinci 1996 dosáhl pacient remise choroby a dále dostával pouze udržovací léčbu cyklosporinem A.
Čtrnáctiletý chlapec byl přijat v lednu 1996 na Kliniku dětské hematologie a onkologie 2. LF UK a FN Motol v Praze s obrazem velmi těžké aplastické anémie (hodnoty krevního obrazu jsou uvedeny v tab. 1). Nemocný byl léčen kombinovanou imunosupresí (antithymocytární globulin + kortikosteroidy + cyklosporin A). Po prvním cyklu léčby nebylo dosaženo odpovědi, a proto byl nemocnému podán druhý cyklus imunosuprese (antilymfocytární globulin + kortikosteroidy + cyklosporin A). Po této léčbě byla přítomna odpověď ve všech řadách (hodnoty jsou uvedeny rovněž v tab. 1), imunosuprese byla postupně redukována a v prosinci 1996 dosáhl pacient remise choroby a dále dostával pouze udržovací léčbu cyklosporinem A.
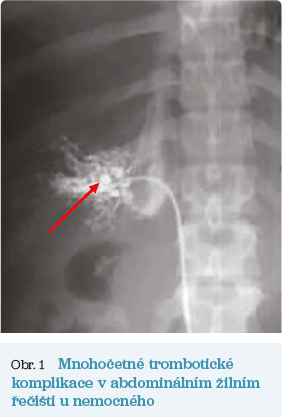 V říjnu 2000 byl pacient vzhledem k věku odeslán k dalšímu sledování do Ústavu hematologie a krevní transfuze (ÚHKT) v Praze. Na kontrolu se však nedostavil. V lednu 2007 (ve věku 25 let) pozoroval opakované bolesti břicha spolu s progredujícím otokem břišní stěny a nárůstem hmotnosti. Při vyšetření hepatologem na interní klinice byl zjištěn ascites při Buddově–Chiariho syndromu (trombóza portální žíly a jaterních žil, parciální trombóza ilických žil a dolní duté žíly) – viz obrázek 1. Byly přítomny laboratorní a klinické známky jaterního selhávání, anémie a hyperkoagulačního stavu (tab. 2). Nemocný byl léčen diuretiky, nízkomolekulárním heparinem a byl mu zaveden transjugulární intrahepatální portosystémový shunt (TIPS) s následným významným poklesem portosystémového gradientu. V květnu 2007 byl pacient konečně odeslán do ÚHKT, kde byla diagnostikována PNH (CD59 kompletní deficit: 35 % erytrocytů, 85 % granulocytů, 80 % monocytů; CD55 kompletní deficit: 44 % erytrocytů, 90 % granulocytů, 88 % monocytů). Nemocný byl léčen antikoagulační léčbou nejprve kontinuálním podáváním heparinu a poté nízkomolekulárním heparinem (LMWH) s následným převedením na warfarin v dávce 7,5–10 mg denně a úpravami dle kontrol INR (mezinárodní normalizovaný poměr). U nemocného byla nadále přítomna anémie s potřebou 2 TU erytrocytů měsíčně. V prosinci 2011 bylo u nemocného zahájeno podávání ekulizumabu ve standardním dávkovacím schématu 4× 600 mg každý týden a dále 900 mg každé 2 týdny. Již po 12 týdnech léčby došlo ke zlepšení hodnot krevního obrazu, k poklesu hodnot laktátdehydrogenázy (LDH) a jaterních testů (tab. 1). Přetrvávající vysoká hodnota celkového bilirubinu je důsledkem prokázaného Gilbertova syndromu. Opakované vyšetření výpočetní tomografií (CT) prokázalo mírný ústup trombotických změn s částečnou rekanalizací portální žíly. V současné době se nemocný nachází v remisi choroby, bez potřeby transfuzí, se stabilizací hodnot jaterních testů a bez známek progrese trombózy, nadále dostává ekulizumab v udržovací dávce 900 mg 1× za 2 týdny a perorální antikoagulační léčbu (tab. 1).
V říjnu 2000 byl pacient vzhledem k věku odeslán k dalšímu sledování do Ústavu hematologie a krevní transfuze (ÚHKT) v Praze. Na kontrolu se však nedostavil. V lednu 2007 (ve věku 25 let) pozoroval opakované bolesti břicha spolu s progredujícím otokem břišní stěny a nárůstem hmotnosti. Při vyšetření hepatologem na interní klinice byl zjištěn ascites při Buddově–Chiariho syndromu (trombóza portální žíly a jaterních žil, parciální trombóza ilických žil a dolní duté žíly) – viz obrázek 1. Byly přítomny laboratorní a klinické známky jaterního selhávání, anémie a hyperkoagulačního stavu (tab. 2). Nemocný byl léčen diuretiky, nízkomolekulárním heparinem a byl mu zaveden transjugulární intrahepatální portosystémový shunt (TIPS) s následným významným poklesem portosystémového gradientu. V květnu 2007 byl pacient konečně odeslán do ÚHKT, kde byla diagnostikována PNH (CD59 kompletní deficit: 35 % erytrocytů, 85 % granulocytů, 80 % monocytů; CD55 kompletní deficit: 44 % erytrocytů, 90 % granulocytů, 88 % monocytů). Nemocný byl léčen antikoagulační léčbou nejprve kontinuálním podáváním heparinu a poté nízkomolekulárním heparinem (LMWH) s následným převedením na warfarin v dávce 7,5–10 mg denně a úpravami dle kontrol INR (mezinárodní normalizovaný poměr). U nemocného byla nadále přítomna anémie s potřebou 2 TU erytrocytů měsíčně. V prosinci 2011 bylo u nemocného zahájeno podávání ekulizumabu ve standardním dávkovacím schématu 4× 600 mg každý týden a dále 900 mg každé 2 týdny. Již po 12 týdnech léčby došlo ke zlepšení hodnot krevního obrazu, k poklesu hodnot laktátdehydrogenázy (LDH) a jaterních testů (tab. 1). Přetrvávající vysoká hodnota celkového bilirubinu je důsledkem prokázaného Gilbertova syndromu. Opakované vyšetření výpočetní tomografií (CT) prokázalo mírný ústup trombotických změn s částečnou rekanalizací portální žíly. V současné době se nemocný nachází v remisi choroby, bez potřeby transfuzí, se stabilizací hodnot jaterních testů a bez známek progrese trombózy, nadále dostává ekulizumab v udržovací dávce 900 mg 1× za 2 týdny a perorální antikoagulační léčbu (tab. 1).
Podávání ekulizumabu v těhotenství
Žena narozená v roce 1990 byla od roku 2009 v péči hematologů pro výsev petechií na trupu a končetinách bez vyvolávající příčiny, stav byl uzavřen jako idiopatická trombocytopenická purpura vzhledem k průkazu zkrácené doby přežití trombocytů s jejich destrukcí ve slezině. Byla zahájena terapie prednisonem zpočátku s dobrým efektem, na udržovací dávce však došlo k relapsu choroby, který byl zaléčen pulzem methylprednisolonu a čtyřmi dávkami rituximabu. Od počátku roku 2013 trpěla pacientka opakovanými bolestmi břicha. V březnu 2013 byla, při epizodě intenzivní bolesti v levém epigastriu, angioCT vyšetřením zjištěna trombóza lienální žíly spolu s podezřením na parciální trombózu jaterních žil. Pacientka byla zajištěna nízkomolekulárním heparinem, ale opětovně se bolesti břicha objevily v dubnu 2013, kdy byl stav uzavřen jako zánětlivé postižení duodena a jejuna na podkladě suspektních ischemických změn při pravděpodobné trombóze mezenteriálních žil. V květnu roku 2013 bylo u pacientky provedeno vyšetření periferní krve průtokovou cytometrií (FCM), které prokázalo přítomnost 56 % erytrocytů s úplným chyběním antigenu CD59, a u pacientky byla stanovena diagnóza PNH (tab. 2).
 Od listopadu 2013 byla pacientka v péči ÚHKT (laboratorní nález viz tab. 2), při převzetí do péče byla léčena kombinací prednisonu (10 mg denně) a LMWH (Fraxiparine 0,8 ml jedenkrát denně), trvaly epizody bolestí břicha pravděpodobně na podkladě ischemických změn při opakované akcentaci hemolýzy doprovázené vazokonstrikcí, čerstvé trombotické změny v mezenteriální oblasti nebyly prokázány. Nemocnou bylo nutno opakovaně hospitalizovat a do června roku 2015 jí bylo podáno celkem 25 transfuzních jednotek erytrocytů (ERD). Následkem opakovaných transfuzí došlo u pacientky k aloimunizaci se vznikem protilátek proti antigenům c, E, Cw a K. Od července 2015 zahájila pacientka léčbu ekulizumabem v dávkovacím schématu 4× 600 mg každý týden a dále 900 mg každé 2 týdny. U pacientky došlo při terapii ekulizumabem k rychlému ústupu obtíží, k vymizení bolestí břicha, normalizaci krevního obrazu, biochemického a koagulačního nálezu (tab. 2). Z důvodu anamnézy prodělané trombózy byla ponechána profylaktická dávka nízkomolekulárního heparinu (Fraxiparine 0,4 ml 1× denně).
Od listopadu 2013 byla pacientka v péči ÚHKT (laboratorní nález viz tab. 2), při převzetí do péče byla léčena kombinací prednisonu (10 mg denně) a LMWH (Fraxiparine 0,8 ml jedenkrát denně), trvaly epizody bolestí břicha pravděpodobně na podkladě ischemických změn při opakované akcentaci hemolýzy doprovázené vazokonstrikcí, čerstvé trombotické změny v mezenteriální oblasti nebyly prokázány. Nemocnou bylo nutno opakovaně hospitalizovat a do června roku 2015 jí bylo podáno celkem 25 transfuzních jednotek erytrocytů (ERD). Následkem opakovaných transfuzí došlo u pacientky k aloimunizaci se vznikem protilátek proti antigenům c, E, Cw a K. Od července 2015 zahájila pacientka léčbu ekulizumabem v dávkovacím schématu 4× 600 mg každý týden a dále 900 mg každé 2 týdny. U pacientky došlo při terapii ekulizumabem k rychlému ústupu obtíží, k vymizení bolestí břicha, normalizaci krevního obrazu, biochemického a koagulačního nálezu (tab. 2). Z důvodu anamnézy prodělané trombózy byla ponechána profylaktická dávka nízkomolekulárního heparinu (Fraxiparine 0,4 ml 1× denně).
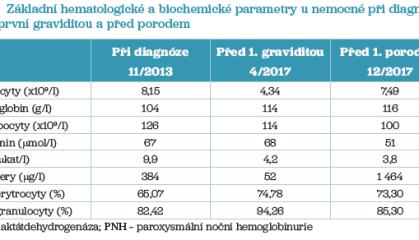
V dubnu 2017 nemocná poprvé otěhotněla (laboratorní hodnoty před graviditou viz tab. 3). Bylo rozhodnuto pokračovat v podávání ekulizumabu v dávce 900 mg à 2 týdny a v profylaxi LMWH (Fraxiparine 0,4 ml 1× denně). V 19. a 21. týdnu došlo opakovaně k vzestupu hodnot D‑dimerů a byla zvýšena dávka LMWH (Fraxiparine nejprve 0,6 ml a dále 0,8 ml 1× denně), vzhledem k poklesu hladiny feritinu v séru byl přidán od 21. týdne do medikace přípravek Sorbifer Durules v dávce 1× 1 denně. V říjnu 2017 (31. týden gravidity) došlo k dalšímu zvýšení hodnoty D‑dimerů – na 2 396 µg/l (při normě do 240 µg/l) – při hodnotě anti‑Xa 0,68 IU/ml. I přes toto zvýšení hodnoty D‑dimerů byla dávka LMWH ponechána na dosavadních 0,8 ml přípravku Fraxiparine beze změny, hodnota anti‑Xa byla v účinném rozmezí a další zvyšování dávky LMWH představovalo zvýšení rizika krvácení u plodu. Současně v tomto týdnu bylo detekováno mírné zvýšení titru anti‑c protilátky (titr 8). Ve 33. týdnu gravidity byla pacientka převedena do poradny rizikového těhotenství ve Všeobecné fakultní nemocnici v Praze, v tomto týdnu byla hodnota D‑dimerů 2 100 µg/l a titr protilátky anti‑c se zvýšil na 64. Ve 35. týdnu gravidity bylo kontrolní ultrasonografické (USG) vyšetření na gynekologii v normě, D‑dimery měly hodnotu 1 980 µg/l. Komplikaci představoval další vzestup titru anti‑c protilátky na 256 (tento titr je již spojen s významným rizikem hemolytického onemocnění novorozence). Gynekolog doporučil další USG vyšetření plodu a následně ukončení gravidity plánovaným císařským řezem ve 37. týdnu gravidity. Dva dny před plánovanou sekcí byla nemocné podána plánovaná dávka ekulizumabu (900 mg), laboratorní hodnoty před porodem jsou uvedeny v tabulce 2. Porod císařským řezem proběhl nekomplikovaně 5. den 37. týdne gravidity, krevní ztráta u pacientky při porodu činila 600 ml. Porodní hmotnost dítěte byla 3 140 g a časný poporodní průběh byl bez komplikací a bez potřeby podání transfuze erytrocytů. Další dávka ekulizumabu byla podána 12 dní po sekci beze změny intervalu v dávkování protilátky. V dalším období byla pacientka bez známek hemolýzy a bez jiných obtíží. Postupně byla snížena dávka přípravku Fraxiparine na 0,6 ml a dále na 0,4 ml 1× denně a ponechána substituce perorálního železa z důvodu kojení a k doplnění zásob.
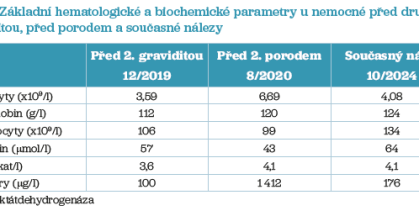 V dalších měsících a letech byla nemocná bez projevů PNH, dále byl podáván ekulizumab 900 mg každé 2 týdny a pokračovala profylaxe nízkomolekulárním heparinem (Fraxiparine 0,4 ml 1× denně). Na počátku ledna roku 2020 pacientka při plánované ambulantní kontrole sdělila, že je opět těhotná. Laboratorní hodnoty před druhou graviditou jsou uvedeny v tabulce 3. Těhotenství zpočátku probíhalo zcela nekomplikovaně, pacientka byla dále léčena ekulizumabem ve standardní dávce 900 mg v pravidelných 14denních intervalech, aplikovala Fraxiparine 0,4 ml 1× denně, dostávala substituci perorálního železa a nepotřebovala transfuze erytrocytů. Trval nález aloprotilátky anti‑c v titru 128, tento titr byl přítomen již před těhotenstvím a v počátku gravidity se nezměnil. V průběhu těhotenství opět docházelo k postupnému zvýšení hodnoty D‑dimerů až na 1 500 µg/l, což si od 25. týdne vynutilo navýšení antikoagulační profylaxe až na 2× 0,6 ml přípravku Fraxiparine denně. Titr anti‑c protilátky zůstával na hodnotě 128. Až do 38. týdne gravidity byla nemocná bez subjektivních obtíží, ale v tomto týdnu se objevily pocity tlaku v břiše a slabost. Biochemické výsledky nesvědčily pro akcentaci hemolýzy (LDH 4,1 µkat/l), hodnota D‑dimerů činila 1 412 µg/l a hodnota anti‑Xa 0,53 IU/ml. Došlo ovšem k poklesu titru anti‑c protilátky na hodnotu 64. Pacientka byla odeslána k vyšetření na gynekologicko‑porodnickou kliniku, kde byl nález stacionární, z hematologického hlediska však nález poklesu titru protilátky svědčil o možné konzumpci protilátky anti‑c plodem a bylo nutno zvážit riziko poškození plodu při hemolytickém onemocnění novorozence. Z naší strany bylo proto doporučeno zvážit plánované ukončení gravidity, a to pokud možno co nejdříve po aplikaci ekulizumabu (laboratorní hodnoty před porodem viz tab. 3). K ukončení těhotenství sekcí došlo v 39. týdnu těhotenství, porod proběhl nekomplikovaně, bez rozvoje hemolýzy, bez potřeby podání transfuzí erytrocytů, i po porodu dále pokračovala antikoagulační profylaxe Fraxiparinem v dávce 2× 0,6 ml denně, následně byl podáván přípravek Clexane 0,6 ml 1× denně a po šesti týdnech byla dávka snížena na 0,4 ml 1× denně. Poporodní průběh byl nekomplikovaný, bez rozvoje hemolýzy nebo jiných komplikací asociovaných s PNH, terapie ekulizumabem nebyla přerušena a v současnosti je nemocná zcela bez obtíží s normálními hodnotami krevního obrazu při léčbě depotním inhibitorem C5 složky komplementu (ravulizumab). Aktuální laboratorní hodnoty u nemocné jsou uvedeny v tabulce 3.
V dalších měsících a letech byla nemocná bez projevů PNH, dále byl podáván ekulizumab 900 mg každé 2 týdny a pokračovala profylaxe nízkomolekulárním heparinem (Fraxiparine 0,4 ml 1× denně). Na počátku ledna roku 2020 pacientka při plánované ambulantní kontrole sdělila, že je opět těhotná. Laboratorní hodnoty před druhou graviditou jsou uvedeny v tabulce 3. Těhotenství zpočátku probíhalo zcela nekomplikovaně, pacientka byla dále léčena ekulizumabem ve standardní dávce 900 mg v pravidelných 14denních intervalech, aplikovala Fraxiparine 0,4 ml 1× denně, dostávala substituci perorálního železa a nepotřebovala transfuze erytrocytů. Trval nález aloprotilátky anti‑c v titru 128, tento titr byl přítomen již před těhotenstvím a v počátku gravidity se nezměnil. V průběhu těhotenství opět docházelo k postupnému zvýšení hodnoty D‑dimerů až na 1 500 µg/l, což si od 25. týdne vynutilo navýšení antikoagulační profylaxe až na 2× 0,6 ml přípravku Fraxiparine denně. Titr anti‑c protilátky zůstával na hodnotě 128. Až do 38. týdne gravidity byla nemocná bez subjektivních obtíží, ale v tomto týdnu se objevily pocity tlaku v břiše a slabost. Biochemické výsledky nesvědčily pro akcentaci hemolýzy (LDH 4,1 µkat/l), hodnota D‑dimerů činila 1 412 µg/l a hodnota anti‑Xa 0,53 IU/ml. Došlo ovšem k poklesu titru anti‑c protilátky na hodnotu 64. Pacientka byla odeslána k vyšetření na gynekologicko‑porodnickou kliniku, kde byl nález stacionární, z hematologického hlediska však nález poklesu titru protilátky svědčil o možné konzumpci protilátky anti‑c plodem a bylo nutno zvážit riziko poškození plodu při hemolytickém onemocnění novorozence. Z naší strany bylo proto doporučeno zvážit plánované ukončení gravidity, a to pokud možno co nejdříve po aplikaci ekulizumabu (laboratorní hodnoty před porodem viz tab. 3). K ukončení těhotenství sekcí došlo v 39. týdnu těhotenství, porod proběhl nekomplikovaně, bez rozvoje hemolýzy, bez potřeby podání transfuzí erytrocytů, i po porodu dále pokračovala antikoagulační profylaxe Fraxiparinem v dávce 2× 0,6 ml denně, následně byl podáván přípravek Clexane 0,6 ml 1× denně a po šesti týdnech byla dávka snížena na 0,4 ml 1× denně. Poporodní průběh byl nekomplikovaný, bez rozvoje hemolýzy nebo jiných komplikací asociovaných s PNH, terapie ekulizumabem nebyla přerušena a v současnosti je nemocná zcela bez obtíží s normálními hodnotami krevního obrazu při léčbě depotním inhibitorem C5 složky komplementu (ravulizumab). Aktuální laboratorní hodnoty u nemocné jsou uvedeny v tabulce 3.
Závěr
Paroxysmální noční hemoglobinurie je onemocnění, na které je třeba pomýšlet u všech nemocných s nejasnou hemolytickou anémií, zejména pokud je přítomna hemoglobinurie. Nejčastěji je třeba PNH odlišit od imunitní hemolytické anémie, u PNH je vždy přítomen určitý stupeň cytopenie i v ostatních krevních řadách a je negativní antiglobulinový test.5 Nicméně ani cytopenie, ani hemoglobinurie nemusejí být výrazněji vyjádřeny a nemocný nemusí mít žádné obtíže. Trombotické komplikace mohou být prvním příznakem choroby až u 40 % nemocných a bývají spojeny s významnou mortalitou,2 na PNH je třeba myslet u všech nemocných mladších 40 let s trombózou, zvláště v atypických lokalizacích (mezenteriální řečiště, plíce, CNS).6 Případ našeho nemocného, jenž byl léčen imunosupresí pro aplastickou anémii, potvrzuje popis rozvoje PNH klonu až u 50 % nemocných léčených kombinovanou imunosupresí.7 Jedná se většinou o malý klon bez klinických příznaků, ale u 8–10 % nemocných může dojít k nárůstu PNH klonu s rozvojem klasického obrazu onemocnění. Je pravděpodobné, že rozvoj klonální proliferace podporuje porušení imunitního dozoru imunosupresivní léčbou. Důležitost včasné diagnostiky onemocnění ukazují obě kazuistiky.
Těhotné pacientky s PNH mají vyšší riziko rozvoje trombotických komplikací a aktivace hemolýzy, což může vést k ohrožení matky i dítěte.8 Méně závažné komplikace (prohloubení anémie, cytopenie) se u těhotných s PNH mohou vyskytnout v 75–95 % případů, závažné komplikace (zejména žilní trombóza) jsou popisovány u 8–16 %8,9 případů a mortalita matek s PNH dosahuje až 20 %5. Dávka ekulizumabu musela být ve většině popsaných případů buď navýšena, nebo byl ekulizumab podáván častěji zejména z důvodu průlomové (breakthrough) hemolýzy, která se vyskytla až v 54 % případů.4 Při terapii ekulizumabem nebyl popsán žádný případ vzniku trombózy v průběhu těhotenství a pouze dva případy trombóz v poporodním období,10 29 % všech těhotenství při terapii ekulizumabem bylo ukončeno předčasně, a to zejména pro rozvoj preeklampsie, intrauterinní růstové retardace nebo progredující trombocytopenie.4 U novorozenců matek léčených ekulizumabem nebyly popsány žádné vrozené malformace nebo vývojové poruchy.10 Dle dostupných výsledků ekulizumab nebo ekulizumab‑C5 komplex proniká pouze ve stopovém množství přes placentu (v pupečníkové krvi je asi 6–7 % koncentrace ekulizumab‑C5 komplexů ve srovnání s krví matky), aktivita komplementu u novorozenců zůstává zcela zachována.11 Ekulizumab nebyl detekován v mateřském mléce léčených pacientek a ve skupině 25 kojených novorozenců matek léčených ekulizumabem nebyly popsány žádné nežádoucí účinky související s touto terapií.11 Lze tedy shrnout, že léčba ekulizumabem v těhotenství dle dosavadních poznatků neovlivňuje plod ani novorozence.
Popsané případy poukazují na nutnost včasné a správné diagnózy paroxysmální noční hemoglobinurie. Včasná správně stanovená diagnóza společně s moderní léčbou inhibitory komplementu umožňuje výrazné zlepšení života a může předejít závažným komplikacím vyplývajícím z povahy choroby.
Prof. MUDr. Jaroslav Čermák, CSc.
Ústav hematologie a krevní transfuze, Praha
E‑mail: jaroslav.cermak@uhkt.cz
Literatura
- Parker C, Omine M, Richards S, et al. Diagnosis and management of paroxysmal nocturnal hemoglobinuria. Blood 2005;106:3699–3709.
- Hill A, Kelly R, Hillmen P. Thrombosis in paroxysmal nocturnal hemoglobinuria. Blood 2013;121:4985–4966.
- Gavriliaki E, Peffault de Latour R, Risitano AM. Advancing therapeutic complement inhibition in hematologic disease: PNH and beyond. Blood 2022;139:3571–3582.
- Kelly RJ, Hill A, Arnold LM, et al. Long‑term treatment with eculizumab in paroxysmal nocturnal hemoglobinuria: sustained efficacy and improved survival. Blood 2011;117:6786–6792.
- Parker CJ. Paroxysmal nocturnal hemoglobinuria. Curr Opin Hematol 2012;19:141–148.
- Socie G, Mary JY, de Gramont A, et al; French Society of Haematology. Paroxysmal nocturnal haemoglobinuria: long‑term follow‑up and prognostic factors. Lancet 1996;348:573–577.
- Young NS. Paroxysmal nocturnal hemoglobinuria and myelodysplastic sydromes, clonal expansion ofPIG‑A‑mutant hematopoietic cells in bone marrow failure. Haematologica 2009;94:4–7.
- Ray JG, Burows RF, Ginsberg JS, Burrows EA. Paroxysmal nocturnal hemoglobinuria and the risk of venous thrombosis: review and recommendations for management of the pregnant and nonpregnant patient. Hemostasis 2000;30:103–117.
- Sarno L, Tufano A, Maruotti GM, et al. Eculizumab in pregnancy: a narative overview. J Nephrol 2019;32:17–25.
- Kelly RJ, Höchsmann B, Szer J, et al. Eculizumab in pregnant patients with paroxysmal nocturnal hemoglobinuria. N Engl J Med 2015;373:1032–1039.
- Hallstensen RFY, Bergseth G, Foss S, et al. Eculizumab treatment during pregnancy does not affect the complement system activity of the newborn. Immunobiology 2015;220:452–459.