Přehled aktuálních možností diagnostiky a léčby plicního karcinomu
Souhrn
Karcinom plic patří mezi nejčastější zhoubná onkologická onemocnění s vysokou mortalitou. Screening plicního karcinomu prokázal ve studiích významnou redukci specifické mortality zejména kvůli záchytu časných, ještě radikálně řešitelných tumorů.1 Vzhledem ke značné heterogenitě klinického i patologického obrazu však finální diagnostika a terapie plicních malignit představují multioborový proces, který by měl být veden hlavně zkušenými multidisciplinárními týmy. Aktuálním standardem v léčbě pokročilého plicního karcinomu je kombinovaná léčba s imunoterapií a u selektovaných pacientů pak cílená terapie.
Klíčová slova: plicní karcinom • diagnostika • terapie
Summary
Lung cancer is among the most common malignancies with high mortality rates. Lung cancer screening showed specific mortality reduction in clinical trials due to identification of early stages, which can be treated radically.1 The clinical and pathological tumour heterogeneity makes the diagnostic and therapeutic process very complex which comes with a need of multidisciplinary team in the lung cancer management. Actual advanced lung cancer therapy standard is based on combined treatment with immunotherapy and with targeted therapy in selected patients.
Key words: lung cancer • diagnostics • therapy
Karcinom plic je nově globálně až druhým nejčastěji diagnostikovaným karcinomem, nicméně zůstává hlavní příčinou nádorové smrti. Data vycházejí z recentně publikované (2/2021) aktualizace databáze GLOBOCAN 2020 (Global Cancer Statistics 2020), dle které se odhadovaná celosvětová incidence karcinomu plic 2,2 milionu (11,4 %) pohybuje jen těsně za incidencí karcinomu prsu (2,3 milionu; 11,7 %) případů. Smrtnost karcinomu plic se dlouhodobě pohybuje kolem 1,8 milionu případů za rok (18 %).2 Je však nutno přiznat velkou variabilitu s ohledem na další faktory, jako jsou například lokalita a socioekonomické podmínky. V České republice máme k dispozici data z roku 2018, kdy bylo celkem zaznamenáno 6 452 nových případů karcinomu plic a 5 398 úmrtí na toto onemocnění. I v České republice existují krajové diference ve výskytu plicního karcinomu, často data korelují s expozicí jednotlivým rizikovým faktorům.3
Plicní karcinom je majoritně preventabilním onemocněním. Hlavní rizikový faktor, jehož je třeba se vyvarovat, představuje kouření cigaret. Odhadem 70–90 % diagnóz plicního karcinomu je následkem aktivního nikotinismu.4 Druhým nejvýznamnějším rizikovým faktorem zejména v České republice je expozice radonu, jehož rizikovost byla prokázána také v české studii, která probíhala v letech 1960–1999 a sledovala 12 000 obyvatel oblasti tzv. Středočeského plutonu.5 Jen pro zajímavost, asi 2–3 % českých domácností jsou exponována koncentraci nad směrnou hodnotou 400 Bq/m3 (zdroj:www.suro.cz). Dále jsou to pak různé profesionální expozice, znečištění ovzduší, alkohol, virová onemocnění a v neposlední řadě pasivní kouření. Primární prevence je založena na zamezení styku zejména s externími rizikovými faktory.6 I přes potentní protikuřácké kampaně a rozšiřující se síť center zaměřených na odvykání kouření je však primární prevence v tomto ohledu spíše jen omezeně úspěšná.
Screening
Vztah prognózy a pozdního záchytu již pokročilého plicního karcinomu si začali uvědomovat již v 60. a 70. letech minulého století (graf 1). V roce 1968 stanovili Wilson a Jungner základní principy screeningu pro Světovou zdravotnickou organizaci (World Health Organisation, WHO).7 Screening představuje testování člověka, který je v riziku, ale nejeví známky dané nemoci. Cílem je časná detekce onemocnění, optimálně ještě v kurabilním stadiu, která povede ke snížení mortality.8
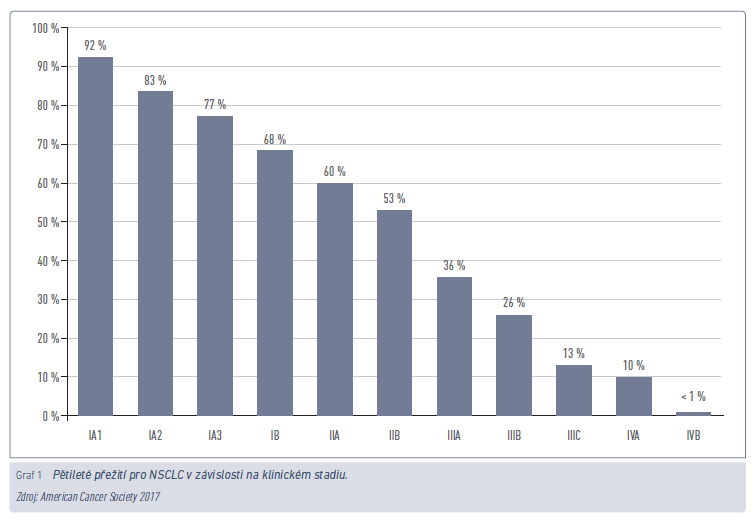
Potřeba prokázat opodstatněnost screeningu a snaha docílit redukce mortality plicního karcinomu byly důvodem realizace nejrozsáhlejší screeningové klinické studie porovnávající možnosti nízkodávkové výpočetní tomografie (low‑dose computed tomography, LDCT) oproti skiagramu hrudníku. Americká studie National Lung Screening Trial (NLST) sledovala populaci 53 454 kuřáků nebo bývalých kuřáků (do 15 let abstinence) ve věku 55–74 let a s historií minimálně 30 balíčkoroků. Studie probíhala v letech 2002–2010 ve 33 specializovaných centrech. Nejdůležitějším závěrem této studie je dosažení 20% redukce rizika specifické mortality.9 Druhou největší byla pak randomizovaná nizozemsko‑belgická studie NELSON, která srovnala screening s LDCT oproti standardu (žádný screening). Celkem bylo do studie zapojeno 15 792 kuřáků nebo bývalých kuřáků ve vysokém riziku, tj. s historií minimálně 15 balíčkoroků. Účastníky s průměrným věkem 59 let tvořili v 84 % muži a v 55 % aktivní kuřáci. Hlavní rozdíl proti NLST představovala metodika měření, protože ve studii NELSON byla použita měření objemu a tzv. volume doubling time. Na LDCT bylo zachyceno okolo 50 % plicních karcinomů v časném stadiu (65–70 % ve stadiu IA) ve srovnání s kontrolní skupinou se 70 % nálezů ve stadiích III a IV. Studie NELSON prokázala významnou redukci rizika specifické mortality o 26 % u mužů, a dokonce až o 61 % u žen po deseti letech systematického screeningu plicního karcinomu metodou LDCT.1,9
V České republice je projekt časného záchytu plicního karcinomu plánován již několik let. Situace s pandemií COVID‑19 však řadu důležitých jednání pozdržela a dle aktuálně dostupných informací je se zahájením národního screeningového programu počítáno v průběhu příštího roku. Ve spolupráci s praktickými lékaři a pneumology budou mít indikovaní rizikoví pacienti příležitost podstoupit preventivní LDCT dle předem stanoveného plánu, vyšetření by mělo být dostupné v radiodiagnostickém zařízení nejbližšího krajského komplexního onkologického centra. Finální podoba screeningu zatím oficiálně zveřejněna nebyla, nicméně je velmi pravděpodobné, že se bude týkat současných či bývalých silných kuřáků ve věku 55–75 let s historií alespoň 20 balíčkoroků. Doposud snad jediný pilotní program screeningu plicní rakoviny u nás probíhá ve Všeobecné fakultní nemocnici v Praze ve spolupráci s Masarykovým onkologickým ústavem v Brně (https://www.screeningplic.cz/).
Klinická manifestace
Až 80 % nemocných s rakovinou plic je u nás diagnostikováno v inoperabilním stadiu, protože se nezřídka jedná o dlouho klinicky němou a obtížně rozpoznatelnou diagnózu. Častý kašel není pro dlouhodobé kuřáky ničím neobvyklým, a nevěnují mu proto větší pozornost. Výraznější obtíže se pak ale objevují ve spojení s pokročilým tumorem a vzdálenými metastázami – dušnost, bolesti, neregredující pneumonie, chrapot, epileptické záchvaty atd. Plicní karcinom se může projevit také paraneoplasticky. Jedná se o široké spektrum symptomů a syndromů, které jsou způsobeny tumorózní produkcí různých biologicky aktivních působků. Mezi častější řadíme poruchy minerálové rovnováhy (hyperkalcemie, SIADH), hormonální dysregulace (Cushingův syndrom), variabilitu v krevním obraze, tromboflebitidy a plicní embolizace. Vzácnější jsou například neurologické a autoimunitní poruchy (Lambertův–Eatonův syndrom).10
Výkonnostní stav pacienta
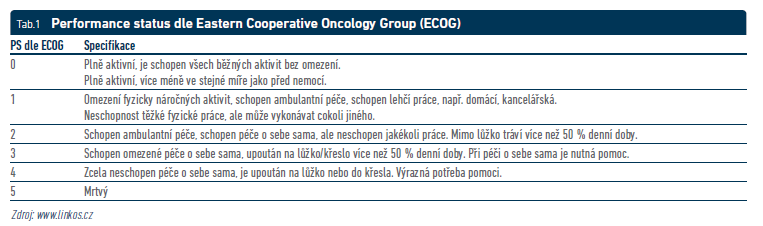
Výkonnostní stav pacienta je jedním z nejsměrodatnějších parametrů vypovídajících o potenciální prognóze pacienta. Pomáhá v monitoraci efektu léčby a umožní adekvátní racionalizaci diagnosticko‑terapeutického postupu. Nejčastěji jej hodnotíme jako performance status (PS) dle ECOG (Eastern Cooperative Oncology Group; tab. 1), dle WHO nebo dle Karnofského (www.linkos.cz). Například komplexní onkologická léčba je ve většině indikací vázána na PS 0–2 dle ECOG, vycházíme‑li zejména z dat registračních klinických studií a úhradových kritérií.
Diagnostika
V případě, že to výkonnostní stav dovolí, je pacient se suspektním bronchogenním karcinomem referován na nejbližší specializované pneumologické pracoviště.
Bioptické metody
Lepší porozumění etiopatogenezi plicního karcinomu vedlo k výraznému rozšíření spektra běžně užívaných histopatologických a genetických vyšetření, s čímž úzce souvisí rostoucí potřeba kvalitního bioptického materiálu v dostatečném množství. V té souvislosti došlo k významnému pokroku také v bronchologii. Základní metodou umožňující vizualizaci a biopsii nádorové léze plic je právě bronchoskopie. Za pomoci pokročilých zobrazovacích technik jsme schopni časně zachytit i relativně malé okrsky nádorově změněné sliznice a zhodnotit rozsah postižení bronchiálního stromu – autofluorescence, narrow band imaging. Velkého pokroku bylo dosaženo v navigačních technikách, které bronchologovi umožňují provádět cílené biopsie také z extramurálně uložených centrálních i relativně periferně rostoucích lézí. Jedná se hlavně o nejčastěji užívané techniky transbronchiální biopsie pod kontrolou endobronchiálního ultrazvuku (EBUS), a to s lineární nebo radiální sondou. EBUS je také standardem ve stagingu mediastinálních uzlin. Mezi další možnosti navigace patří elektromagneticky navigovaná bronchoskopie (ENB) a virtuální bronchoskopická navigace, založená na počítačové rekonstrukci a navigaci bronchiálním stromem.11,12 Zejména v případě periferně rostoucích tumorů je bioptickou alternativou transtorakální punkce pod navigací výpočetní tomografie (computed tomography, CT) nebo eventuálně pomocí ultrasonografie.13 Při opakované nevýtěžnosti a diagnostických rozpacích je vhodné zvážit také chirurgický odběr materiálu. U menších periferních uzlíků je možno před chirurgickým výkonem označit místo odběru drátkem k lepší orientaci v terénu.14
Histopatologie a molekulárně genetický profil
Aktuální klasifikace plicních tumorů vychází z doporučení WHO z roku 2015.15 Plicní karcinom obecně dělíme na dvě základní jednotky. Nemalobuněčný plicní karcinom (non‑small cell lung cancer, NSCLC) představuje s 85% zastoupením nejčastější plicní malignitu.16 Malobuněčný karcinom tvoří zbylých asi 15 % a řadíme jej mezi karcinomy s neuroendokrinní diferenciací.15 Vzhledem k cílům personalizované medicíny je však hlavně ve skupině NSCLC třeba další podrobnější typizace, bez které by bylo velmi obtížné zahájit adekvátní léčbu. Histopatologické vyšetření spočívá v rozlišení skvamózního (spinocelulárního) a neskvamózních subtypů NSCLC. U neskvamózních se jedná zejména o adenokarcinom, který je dále možno kategorizovat dle invazivity. V případě nejasností si patolog pomůže imunohistochemickým barvením. Adenokarcinomy se vyznačují pozitivitou markerů TTF‑1 a/nebo Napsin A, u skvamózních karcinomů pak nacházíme pozitivní markery p40, CK5/6 a TP63 (p63). V případě nespecifičnosti i přes adekvátní histopatologické a imunohistochemické vyšetření se může jednat o tzv. NOS (not otherwise specified).15,17 Tím ale proces nekončí.
Zejména u adenokarcinomu bylo v posledních letech detekováno množství řídících mutací například v genech pro receptorové tyrozinkinázy. Nejčastěji detektujeme mutace v genech pro receptor epidermálního růstového faktoru (epidermal growth factor receptor, EGFR), méně časté jsou pak mutace ALK (anaplastická lymfomová kináza). Tyto jsou u adenokarcinomů vyšetřovány reflexně a výsledek je podmínkou zahájení adekvátní léčby. Vzhledem k významnému technologickému pokroku jsme aktuálně schopni vyšetřovat různé potenciálně targetabilní mutace najednou s velkou úsporou času směrem k zahájení terapie. Známý terapeutický potenciál mají u plicního karcinomu mutace ROS-1, BRAF, RET, NTRK, MET, KRAS a HER2. Právě technika paralelního sekvenování je již relativně zavedeným průlomem v molekulárně genetické diagnostice plicního karcinomu. Budoucností je zdokonalení a zavedení technik vyšetřování nádorových cirkulujících buněk či volné cirkulující DNA v periferní krvi pacienta, což by značně snížilo spotřebu bioptického materiálu.15,17 Dalším důležitým markerem, bez kterého se při iniciaci terapie plicního karcinomu neobejdeme, je tumorózní exprese ligandu programované buněčné smrti (programmed death‑ligand 1, PD‑L1). V praxi je vyjadřována v procentech, řídí se podle ní úhrada léčby a je jediným uznávaným prediktivním ukazatelem odpovědi na imunoterapii.18
Staging
Plicní karcinom má tendence metastazovat. Nejčastěji metastázy postihují játra, CNS, kosti, plíce a nadledviny. Metastázy v játrech mají obecně nejhorší prognózu pro pacienta.19 Znalost rozsahu nádorového postižení má význam prognostický a zejména hraje důležitou roli při volbě adekvátního léčebného postupu. V určování stagingu vycházíme z 8. vydání mezinárodní TNM klasifikace zhoubných novotvarů pro plicní karcinom.16
Multidisciplinární tým (MDT)
Plicní karcinom je závažné onkologické onemocnění, které je ve většině případů diagnostikováno v pokročilém klinickém stadiu a má obecně velmi špatnou prognózu. Moderní diagnostické a terapeutické přístupy – cílená léčba a imunoterapie – však mohou u správně selektovaných pacientů pozitivně ovlivnit celkové přežití a kvalitu života. Multidisciplinární tým je nástrojem optimalizace již diagnostického procesu, kdy je snaha zkrátit čas celkové diagnostiky s maximální výtěžností. V dalším kroku tým doporučí nejlepší možný léčebný přístup, zváží operabilitu a v případě inoperability může rozhodnout o dalším postupu, čímž se za ideálních okolností výrazně zkrátí doba prodlení od stanovení diagnózy k léčbě. Kvalita práce multidisciplinárního týmu závisí na organizaci týmu, vnitřní kontrole, periodicitě schůzek a také na počtu zainteresovaných odborností. S pokročilým molekulárním testováním roste například potřeba přítomnosti i specialistů z řad molekulární biologie a genetiky.20
Terapie časných stadií NSCLC
Lobektomie spolu se systematickým stagingem lymfatických uzlin zůstává zlatým standardem v terapii resekabilních plicních tumorů. Jedná se o konstantně zdokonalovanou metodu kurativní chirurgie (torakotomie, VATS, RATS atd.).21 Řada pacientů chirurgický zákrok odmítne nebo trpí komorbiditami, které neumožní radikální chirurgickou intervenci. Stereotaktická radioterapie (stereotactic body radiotherapy, SBRT) je adekvátní alternativou lobektomie zejména v terapii malých periferních plicních tumorů. Aplikací vysoké dávky radiace (> 6 Gy/1 frakce) v několika málo frakcích (max. 5 frakcí) je docíleno lokální kontroly tumoru a přežití pacienta s dobrou tolerancí léčby.22,23
Terapie III. stadia NSCLC
Staging pacientů v rámci III. klinického stadia závisí zejména na uzlinovém postižení plic a mediastina. Měl by být vždy podpořen minimálně zobrazením PET (pozitronová emisní tomografie) / CT a při nejasnostech bronchoskopickým či mediastinoskopickým stagingem. V případě vyloučení operability (většinou od stadia IIIB) je standardem léčby chemoradioterapie. U karcinomů s expresí PD‑L1 minimálně 1 % bez aktivačních mutací je pak po úspěšné konkomitantní chemoradioterapii doporučeno zahájit maintenance terapii s durvalumabem v trvání maximálně jeden rok.24,25
Terapie generalizovaného NSCLC
Na základě všech výše zmiňovaných vyšetření, dokončeného stagingu a při adekvátním výkonnostním stavu pacienta je úkolem multidisciplinárního týmu rozhodnout o optimálním terapeutickém postupu (viz výše MDT). Aktuálním standardem systémové léčby je imunoterapie v monoterapii nebo v kombinaci s chemoterapií a případně s radioterapií. U selektovaných pacientů pak případně cílená léčba v závislosti na charakteru zjištěné mutace.
Imunoterapie
Po vyloučení přítomnosti aktivačních mutací EGFR a ALK a dodržení ostatních indikačních kritérií (performance status; laboratorní markery; absence autoimunit a dlouhodobé kortikoidní terapie) je standardem první linie léčby generalizovaného nemalobuněčného karcinomu plic imunoterapie, a to buď v monoterapii, nebo v kombinaci s chemoterapií. Pembrolizumab je v České republice prvním a zatím jediným checkpoint inhibitorem, který dosáhl na úhradu v první linii léčby metastatického NSCLC u pacientů s expresí PD‑L1 nad 50 % a u pacientů s expresí PD‑L1 1–49 % v kombinaci s platinovým dubletem.24,26 Inhibitory kontrolních bodů je možno pacientům s generalizovaným NSCLC kromě první linie aplikovat také ve druhé linii po selhání přechozí terapie s platinovým dubletem nivolumab a atezolizumab.24
Zajímavou novinkou, zatím bez úhrady, je u NSCLC terapeutický režim s platinovým dubletem – nivolumabem a ipilimumabem – v první linii léčby. V klinické studii CheckMate 9LA dosáhli pacienti statisticky významného prodloužení celkového přežití oproti chemoterapii bez ohledu na míru exprese PD‑L1 s dobrou tolerancí.27 O úhradu je možno žádat cestou paragrafu 16.
Cílená léčba
U pacientů v celkově dobrém výkonnostním stavu PS 0–1 dle ECOG s prokázanou aktivační mutací EGFR – pouze delece 19 a L858R – je v první linii nově hrazen tyrozinkinázový inhibitor třetí generace osimertinib.28 U ostatních mutací EGFR u pacientů s PS 0–2 přetrvává indikace léčby přípravkem první, respektive druhé generace – gefitinibem, afatinibem, a dále při progresi a průkazu rezistentní mutace T790M je pak nemocný indikován k terapii s osimertinibem. U pacientů s mutací v genu ALK máme kromě alektinibu recentně nově k dispozici plně hrazený tyrozinkinázový inhibitor brigatinib v první linii léčby dospělých pacientů s lokálně pokročilým (stadium IIIB) nebo metastazujícím (stadium IV) nemalobuněčným karcinomem plic.29 Úhrada lorlatinibu a ceritinibu je zatím stále vázána na paragraf 16.
Terapie malobuněčného karcinomu plic
Malobuněčný karcinom zastupuje přibližně 15 procent všech plicních karcinomů, velmi časně generalizuje a má špatnou prognózu. Doposud je jediným hrazeným standardem první linie léčby chemoterapie – cisplatina/karboplatina s etoposidem. Nicméně v kombinaci s platinovým dubletem v první linii je možno prostřednictvím paragrafu 16 žádat rovněž o úhradu durvalumabu u extenzivního stadia SCLC na základě výsledků klinické studie CASPIAN.30
Závěr
Problematika diagnostiky a léčby plicního karcinomu je velmi komplexní a složitá. Jednotlivé terapeutické přístupy se neustále obměňují v závislosti na aktuálních datech klinických studií. Funkční multidisciplinární tým je předpokladem kvalitní a smysluplné diagnosticko‑terapeutické péče o pacienta s plicním karcinomem.
Práce byla podpořena výzkumným projektem Univerzity Karlovy PROGRES Q28 – Onkologie.
Literatura
- De Koning H, van Der Aalst C, ten Haaf K, Oudkerk M. PL02.05 Effects of Volume CT Lung Cancer Screening: Mortality Results of the NELSON Randomised‑Controlled Population Based Trial. J Thorac Oncol 2018;13:S185.
- Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2021;71:209–249.
- Dušek L, Mužík J, Kubásek M, et al. Epidemiologie zhoubných nádorů v České republice. Multimediální podpora výuky klinických a zdravotnických oborů: Portál Lékařské fakulty Masarykovy univerzity [online] [cit. 06. 04. 2021]; Available from: https://portal.med.muni.cz/clanek‑583‑epidemiologie‑zhoubnych‑nadoru‑v‑ceske‑republice.html.
- Jassem J. Lung cancer: a preventable disease. Transl Lung Cancer Res 2019;8(Suppl 1):S1–S2.
- Tomásek L, Müller T, Kunz E, et al. Study of lung cancer and residential radon in the Czech Republic. Cent Eur J Public Health 2001;9:150–153.
- Venclíček O. Zevní rizikové faktory vzniku karicnomu plic u kuřáků. Onkologie 2020;14:45–46.
- Wilson JMG, Jungner G. World Health Organization. Principles and practice of screening for disease. Geneva, 1968.
- Sharma D, Newman TG, Aronow WS. Lung cancer screening: history, current perspectives, and future directions. Arch Med Sci 2015;11:1033–1043.
- Aberle DR, Adams AM, Berg CD, et al. Reduced lung‑cancer mortality with low‑dose computed tomographic screening. N Engl J Med 2011;365:395–409.
- Musil J. Pneumologie. Vol. 2. Praha: Karolinum, 2012.
- Votruba J, Šimovič J. Plicní endoskopie. Praha: Mladá fronta, 2017.
- Chandrika S, Yarmus L. Recent developments in advanced diagnostic bronchoscopy. Eur Resp Rev 2020;29:190184.
- Gross‑Fengels W, Koreuber K, Siemens P, et al. CT‑gesteuerte Stanzbiopsien thorakaler Läsionen bei Patienten mit bronchoskopisch negativen Voruntersuchungen. Der Radiologe 2011;51:299–306.
- Patella M, Bartolucci DA, Mongelli F, et al. Spiral wire localization of lung nodules: procedure effectiveness and oncological usefulness. J Thorac Dis 2019;11:5237–5246.
- Travis WD, Brambilla E, Nicholson AG, et al. The 2015 World Health Organization Classification of Lung Tumors: Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification. J Thorac Oncol 2015;10:1243–1260.
- O’Sullivan B, Brierley J, Byrd D, et al. The TNM classification of malignant tumours‑towards common understanding and reasonable expectations. Lancet Oncol 2017;18:849–851.
- Inamura K. Update on Immunohistochemistry for the Diagnosis of Lung Cancer. Cancers (Basel) 2018;10:72.
- Patsoukis N, Wang Qi, Strauss L, Boussiotis VA. Revisiting the PD‑1 pathway. Science Advances 2020;6:eabd2712.
- Riihimäki M, Hemminki A, Fallah M, et al. Metastatic sites and survival in lung cancer. Lung Cancer 2014;86:78–84.
- Kowalczyk A, Jassem J. Multidisciplinary team care in advanced lung cancer. Transl Lung Canc Res 2019;9:1690–1698.
- Howington JA, Blum MG, Chang AC, et al. Treatment of stage I and II non‑small cell lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence‑based clinical practice guidelines. Chest 2013;143:(5 Suppl):e278S–e313S.
- Potters L, Kavangh B, Galvin JM, et al. American Society for Therapeutic Radiology and Oncology (ASTRO) and American College of Radiology (ACR) practice guideline for the performance of stereotactic body radiation therapy. Int J Radiat Oncol Biol Phys 2010;76:326–332.
- De Ruysscher D, Nakagawa K, Asamura H. Surgical and nonsurgical approaches to small‑size nonsmall cell lung cancer. Eur Respir J 2014;44:483–494.
- Krejčí D. Problematika moderní pneumoonkologické léčby v ČR k 1. 8. 2020. Farmakoter Revue 2020;5:1–4.
- SPC Imfinzi®
- SPC Keytruda®.
- Paz‑Ares L, Ciuleanu T‑E, Cobo M, et al. First‑line nivolumab plus ipilimumab combined with two cycles of chemotherapy in patients with non‑small‑cell lung cancer (CheckMate 9LA): an international, randomised, open‑label, phase 3 trial. Lancet Oncol 2021;22:198–211.
- SPC Tagrisso®.
- SPC Alunbrig®.
- FDA, U.S. FDA approves durvalumab for extensive‑stage small cell lung cancer. 2020; Available from: https://www.fda.gov/drugs/resources‑information‑approved‑drugs/fda‑approves‑durvalumab‑extensive‑stage‑small‑cell‑lung‑cancer.