Prevence tromboembolismu ze všech stran
Problematika prevence tromboembolismu propojuje většinu specializací. Komplexně se na toto téma zaměřil webinář Virtuální masterclass, který se s podporou společnosti Pfizer konal 7. října. Diskusi moderoval prof. MUDr. Richard Češka, CSc., předseda České internistické společnosti ČLS JEP.
Vzdělávací program otevřela doc. MUDr. Debora Karetová, CSc., z II. interní kliniky kardiologie a angiologie 1. LF UK a VFN v Praze. Zaměřila se především na epidemiologii venózní tromboembolické nemoci (VTE), rizikové faktory s ní spojené a prediktory její rekurence. Připomněla, že symptomatická DVT (hluboká žilní trombóza) je v České republice ročně diagnostikována u 50 až 100 jedinců na 100 000 obyvatel a VTE (tedy DVT + plicní embolie) má roční incidenci 125/100 000 obyvatel. Mírně vyšší je výskyt u mužů. Doc. Karetová zdůraznila, že tato nemoc je často recidivující a až u deseti procent neprovokovaných příhod dochází k rekurenci během jednoho roku. V poslední době došlo ve spojitosti s pandemií COVID‑19 k nárůstu počtu nemocných s VTE, čímž se zvýšila zátěž pro interní a angiologická pracoviště.
Diagnostika a prevence VTE
Doc. MUDr. Dalibor Musil, Ph.D., z I. interní kliniky – kardiologické LF UP a FN Olomouc navázal v pořadí druhou přednáškou zabývající se diagnostikou a prevencí VTE. Nejprve hovořil o racionální tromboprofylaxi, která se týká především hospitalizovaných pacientů, u kterých dochází ke kumulaci rizikových faktorů a nárůstu morbidity a mortality. Uvedl, že se jedná zejména o pacienty chirurgické, u kterých je vysoký výskyt proximálních žilních trombóz a symptomatických plicních embolií, pokud jim není podána žádná profylaxe. Tato problematika se týká jak všeobecné chirurgie, tak ostatních chirurgických oborů. Ke stanovení rizik TEN se v praxi běžně používají skórovací systémy vycházející z kumulace klinických a laboratorních rizikových faktorů (vrozených a získaných). Tímto způsobem můžeme zjistit stupeň rizika a doporučený způsob profylaxe – od nejnižšího rizika, kdy stačí časná vertikalizace, po vysoké riziko, kde se využívá mechanická tromboprofylaxe a LMWH či nefrakcionovaný heparin. U pacientů operovaných pro nádor se nesmí zapomínat na dostatečně dlouhou tromboprofylaxi trvající minimálně čtyři týdny po operaci.
Zvláštní skupinu tvoří ortopedické operace, které výrazně zvyšují riziko VTE. Riziko vzniku fatální plicní embolie bez profylaxe po TEP kyčle je nejvyšší v druhém až třetím týdnu od operace, to znamená v době, kdy je pacient již propuštěn z hospitalizace a rehabilituje. Riziko přetrvává až do pěti týdnů od operace. To vše by měla tromboprofylaxe v ortopedii zohledňovat, měla by být prodloužena na 35 dní od operace (minimum jsou dva týdny) a během hospitalizace by měla být duální tromboprofylaxe (farmakoprofylaxe a mechanická tromboprofylaxe). První volbou farmakoprofylaxe u fraktur krčku kosti stehenní a po TEP kyčle nebo kolene je LMWH nebo fondaparinux (alespoň 12 hodin před operací nebo po ní).
Mechanická tromboprofylaxe jako způsob profylaxe VTE je doporučena pouze při vysokém riziku krvácení. Zavedení kaválního filtru není doporučeno v primární prevenci. Před propuštěním z hospitalizace po těchto operacích není doporučován ani sonografický screening DVT.
Další ze stavů vyžadujících tromboprofylaxi jsou stavy po úrazech a stavy imobilizace. Velmi často se tyto stavy objevují u pacientů ve vyšším věku. Pokud je pacient dlouhodobě imobilizován doma či v ústavu, tromboprofylaxe není indikována. V případě izolovaného poranění dolní končetiny, vyžadujícího imobilizaci dolní končetiny, může být v případě absence jakýchkoli rizikových faktorů bez rutinní tromboprofylaxe. Pokud jsou ale rizikové faktory přítomny, po zvážení rizika se aplikuje LMWH v tromboprofylaktické dávce. V případě polytraumatu je profylaxe pomocí LMWH nebo nefrakcionovaného heparinu indikována vždy. Kavální filtry opět nejsou v primární prevenci indikovány. Pokud je polytrauma spojeno s vysokým rizikem VTE (např. poranění mozku, míchy, páteře), je indikována duální profylaxe LMWH + mechanická profylaxe.
Docent Musil též nezapomněl dodat, že tromboprofylaxe je nutná ve všech rizikových situacích, ale rizikovost jednotlivých situací se velmi liší – dlouhé cesty mají riziko vzniku VTE pod jedno procento, ale velké ortopedické operace mají toto riziko větší než 40 procent. Jelikož data ukazují, že více než polovina všech VTE vzniká během hospitalizace nebo do 30 dnů od propuštění z hospitalizace, je nutné mít v každé nemocnici vypracovaný systém aktivní prevence vzniku VTE. „Jakákoli zmíněná prevence je lepší než žádná, ale žádná prevence není nikdy stoprocentní,“ dodal doc. Musil. Zdůraznil také důležitost jednoduchých a účinných metod, jako je časná mobilizace a hydratace, u kterých je vždy třeba začínat, a poté následně navázat farmakoprofylaxí (první volbou je LMWH v dávkách dle tělesné hmotnosti) a mechanickou tromboprofylaxí v případech vyššího rizika krvácení nebo v kombinaci s farmakoprofylaxí v případě vysokého rizika trombózy.
VTE u onkologicky nemocných
Dalším sdělením navázala doc. MUDr.
Jana Hirmerová, Ph.D., z II. interní kliniky LF UK a FN Plzeň. Představila kazuistiku týkající se problematiky specifického pacienta s VTE v ambulantní péči jejich cévní ambulance. Pacientem byl 73letý muž, diabetik 2. typu na kombinované terapii s Ca prostaty v anamnéze (po radioterapii a hormonální terapii – ukončení léčby 08/2019), který v prosinci roku 2019 prodělal plicní embolii bez jasného vyvolávajícího faktoru a bez průkazu zdroje v žilách dolních končetin, pro kterou byl šest měsíců léčen rivaroxabanem. V r. 2021 byl pacient přijat na interní kliniku pro suspektní recidivu plicní embolie s námahovou dušností, na kardioechografii patrna dilatace pravé komory srdeční, známky plicní embolie. Zdroj plicní embolie nalezen v asymptomatické trombóze levé dolní končetiny. Pacient byl léčen LMWH. Při pátrání po příčině byl při koloskopii nalezen významně stenozující objemný tumor rektosigmatu (histologicky se jednalo o invazivní adenokarcinom). V rámci předoperační přípravy byl pacientovi zaveden kavální filtr, provedena nízká resekce rekta, přechodně podáván LMWH v profylaktické dávce, později v dávce intermediální. Po chirurgickém řešení tumoru byl pacient přeložen na interní kliniku, kde byl odstraněn kavální filtr. Dimise s LMWH v plné dávce. Při první návštěvě v cévní ambulanci po dimisi bylo patrné zlepšení stavu – zlepšení dušnosti, tolerování fyzické námahy a pacient byl bez krvácivých komplikací. Onkologické vyšetření doporučilo další dispenzarizaci gastroenterologem. Na přání pacienta byla změněna antikoagulační léčba na perorálně podávaný apixaban. Při další kontrole byl pacient bez krvácivých komplikací a na kontrolním USG viděna podstatná rekanalizace žil.
Docent Hirmerová zařadila tohoto pacienta do skupiny zhruba 20 procent pacientů s VTE, kteří trpí nádorovým onemocněním (CAT = cancer associated thromboembolism). Onkologičtí pacienti mají čtyřikrát až sedmkrát vyšší riziko vzniku VTE než pacienti bez nádorového onemocnění. Tito pacienti mají taktéž horší výsledky léčby – třikrát častější rekurence, dvakrát častěji závažné krvácení, riziko úmrtí více než trojnásobné.
U pacientů s onkologickým onemocněním bylo v posledních letech preferováno užívání LMWH (oproti užívání warfarinu), ale v dlouhodobé léčbě řada onkologických pacientů LMWH vynechávala z různých důvodů (diskomfort, nežádoucí účinky…). S příchodem perorálně podávaných NOAC byla snaha tyto přípravky užívat i v této indikaci. Zpočátku však chyběla potřebná data, neboť prvotní studie měly jen velmi málo onkologických pacientů. Byla však provedena dílčí analýza těchto podskupin (analýza AMPLIFY), kde bylo prokázáno, že léčba NOAC byla srovnatelná, nebo v některých případech dokonce s tendencí k mírně lepším výsledkům oproti klasické léčbě.
Docentka Hirmerová též ukázala výsledky randomizovaných studií srovnávajících NOAC s LMWH v léčbě CAT, kde podrobněji zmínila poslední velkou studii CARAVAGGIO. Šlo o randomizovanou, otevřenou a zaslepenou studii, která měla za cíl zhodnotit, zda je apixaban non‑inferiorní vůči subkutánně podávanému dalteparinu v léčbě DVT a/nebo plicní embolie u pacientů s nádorovým onemocněním. Studie prokázala, že apixaban je u této populace stejně účinný v léčbě rekurence žilního tromboembolismu jako subkutánně podávaný nízkomolekulární heparin. Současně se potvrdilo, že představuje z pohledu rizika závažného krvácení bezpečnou volbu, a to i u nemocných s kolorektálními karcinomy. Možnost perorální profylaxe trombotických příhod má velký význam pro kvalitu života onkologicky nemocných, navíc z pohledu plátců péče jde o ekonomicky výhodný postup.
Podle současných doporučení jsou NOAC navržena k použití u nemocných s nízkým rizikem krvácení a pokud nehrozí interakce NOAC s probíhající onkologickou léčbou. U pacientů s nádory gastrointestinálního traktu s vysokým rizikem krvácení bylo doporučeno preferovat LMWH. Následná aktualizace doporučení (NCCN 2021, ASH 2021) již staví NOAC jako alternativu LMWH.
Doba léčení se obvykle doporučuje minimálně na tři měsíce, ale prodloužení je u pacientů s trvajícím nádorovým onemocněním či při trvající léčbě časté.
Lékové interakce NOAC
Další přednáškou s názvem Klinický význam lékových interakcí a farmakogenetiky v léčbě NOAC navázal prof. MUDr. Jan Bultas, CSc., z Ústavu farmakologie 3. LF UK Praha. Poukázal na to, že jedním z důvodů, proč lékaři preferují NOAC, je právě nižší riziko vzniku lékových interakcí (ve srovnání s léčbou warfarinem). Antikoagulační terapie je totiž hlavně u polymorbidních seniorů významně zatížena rizikem lékové interakce a s ní spojených nežádoucích účinků (dochází k ní u cca 42 % pacientů léčených warfarinem, 30 % nemocných. léčených NOAC), při polypragmazii se však toto riziko zvyšuje až na 85 procent.
Možnosti lékové interakce lze rozdělit do dvou skupin. První jsou interakce na farmakodynamické bázi – např. sčítání účinků s protidestičkovými léčivy (ASA, NSA, klopidogrel), které jsou relativně dobře předvídatelné. Druhou skupinou jsou interakce na farmakokinetické bázi, které mohou být neočekávané. Do této skupiny se řadí interakce, které jsou ovlivněny vstřebáváním léčiva, jeho transformací, transportem, distribucí do tkání a eliminací. Příklady těchto léčiv jsou amiodaron, verapamil, diltiazem. Lékové interakce jsou nejčastější příčinou krvácení při léčbě NOAC.
V tomto kontextu prof. Bultas připomněl určité specifikum dabigatranu, a to že při vzestupu pH dochází ke snížení jeho absorpce. To je důležité zejména při kombinaci s PPi, které snižují absorpci dabigatranu o 25 až 50 procent. Na resorpci xabanů však žádný vliv nemají.
V otázce lékových interakcí NOAC s nynější léčbou COVID‑19 prof. Bultas poukázal na fakt, že virostatika (remdesivir) inhibují P‑gp a CYP3A4, a tím dochází ke zvýšení koncentrace NOAC, ale dexamethason indikuje P‑gp a CYP3A4, čímž se snižuje jejich koncentrace.
Závěrem profesor Bultas připomněl, že při kombinaci se středně silnými inhibitory P‑gp se efekt musí zvažovat vzhledem k věku pacienta, komorbiditám, poklesu renálních funkcí, k hmotnosti – zde všude je vhodná redukce dávky.
Na úplný závěr připomněl výrok J. E. Purkyně „Lečme tak, aby léčba nebyla nebezpečnější než nemoc.“
Diskuse
Druhý blok nabídl příležitost k diskusi nad různými klinickými situacemi spojenými s léčbou a prevencí VTE. Jednotliví řečníci shrnuli nejdůležitější body svých přednášek a rozvinuli další důležitá témata.
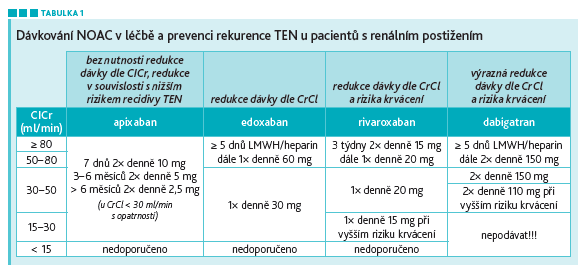
Profesor Bultas dále mluvil o užití NOAC za specifických situací, jako jsou renální a jaterní dysfunkce. Oba tyto stavy aktivují hyperkoagulační stav, dochází ke stáze krve, postižení cévní stěny, poruše funkce krevních destiček atd. Snížení renálních funkcí vede ke zvýšení koncentrace léčiva hlavně u dabigatranu, kdy již malé snížení renálních funkcí vede k 50% zvýšení koncentrace léčiva (u xabanů tento nárůst není nijak výraznější). Úpravu dávek NOAC uvádí tabulka 1.
Problematiku výběru antikoagulancia u pacientů s onkologickým onemocněním v rychlosti nastínila doc. Hirmerová. Zdůraznila kritéria volby antikoagulancií u těchto pacientů, mezi něž patří účinnost a bezpečnost antikoagulancia, typ malignity a lokalizace, přítomnost metastáz v mozku, komorbidity pacienta, lékové interakce a preference pacienta. Pokud je délka léčby prodloužena nad tři měsíce, ukazuje se nižší riziko recidivy VTE. Probíhající studie APICAT zkoumající velké množství onkologických pacientů, kterým je podáván apixaban ve dvou dávkovacích schématech, by měla brzy přinést další důležité informace pro podávání NOAC u pacientů s onkologickým onemocněním.
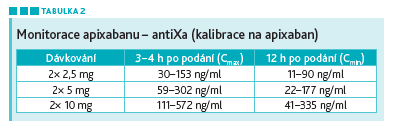
Na otázku, zda má cenu monitorovat NOAC, odpověděla doc. Karetová. Podávání těchto léků se řídí hmotností pacienta, věkem, renálními funkcemi. Hodnota koncentrace apixabanu se může vypočítat pomocí speciálně kalibrovaného antiXa (viz tabulku 2). Tato monitorace může být prospěšná v urgentních situacích (závažné trauma, krvácení, spinální analgezie…), v monitoraci adherence pacienta k léčbě a v situacích, kdy došlo k neočekávanému krvácení (předávkování, interakce, vysoký věk…).