Přístup k nádorům močového měchýře v roce 2021
Souhrn
Pro pacienty s pokročilejším uroteliálním karcinomem močového měchýře představuje základ kurativní léčby chirurgický výkon v podobě radikální cystektomie s pánevní lymfadenektomií, u neinvazivních lézí transuretrální resekce. Onkologická léčba v podobě neoadjuvantní chemoterapie na bázi cisplatiny je spojena s vysokým počtem léčebných odpovědí, včetně kompletních regresí nálezu, a s prodloužením přežití, navíc mnohem pravděpodobněji umožní operaci s ponecháním močového měchýře. Do léčebného armamentária patří nadále také léčba zářením a stále významnější pozici si získává moderní imunoterapie inhibitory kontrolního bodu.
Klíčová slova: karcinom močového měchýře • radikální cystektomie • radioterapie, chemoterapie • cisplatina • imunoterapie • intravezikální výplach • BCG vakcína • inhibitory kontrolního bodu
Summary
Radical cystectomy with pelvic lymphadenectomy is the basic curative treatment for patients with advanced urothelial urinary bladder carcinoma, same as transurethral resection in non‑invasive laesions. Oncological treatment in the form of platinum‑based neoadjuvant chemotherapy is associated with a high number of treatment responses, complete remision incl. and with an overall survival improvement, moreover, there is higher probability of bladder sparing surgery. Radiation therapy also belongs continuously to the treatment armamentarium and modern immunotherapy with check‑point inhibitors plays even more important role today, too.
Key words: urinary bladder cancer • radical cystectomy • radiotherapy • chemotherapy • cisplatin • immunotherapy • intravesical lavage • BCG vaccine • check‑point inhibitors
Úvod
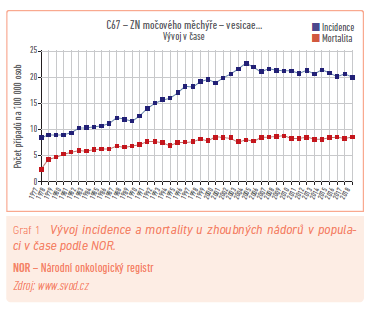
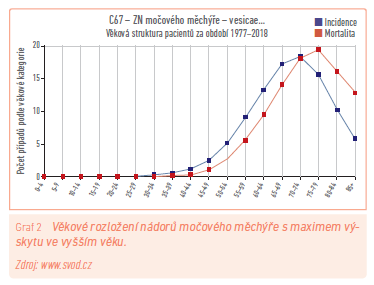
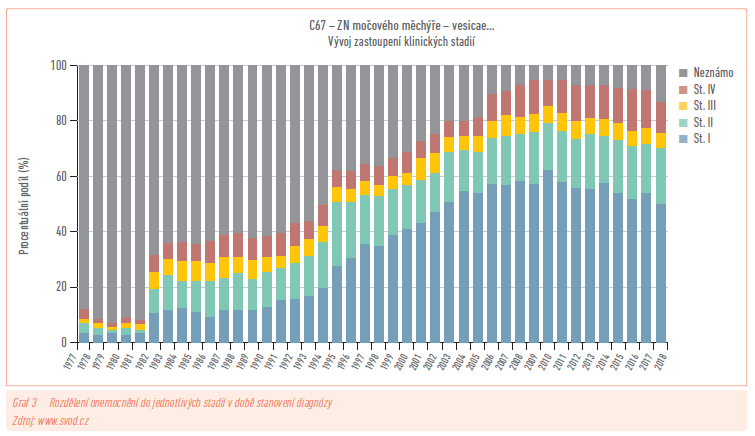
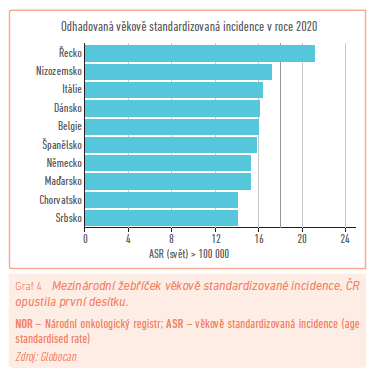
Nádory močového měchýře v naší populaci relativně ustupují; zatímco ještě před několika lety zaujímala Česká republika incidencí tohoto onemocnění páté místo ve světě, díky postupnému poklesu se v současnosti pohybujeme kolem průměru zemí Evropské unie a tyto přední pozice jsme vyklidili (graf 4). Zatímco výskyt tohoto onemocnění sleduje nepatrný trend poklesu, mortalita zůstává dlouhodobě beze změny (graf 1), což naznačuje, že přes pokroky medicíny dosažené v posledních letech zatím nové a efektivnější nástroje pro diagnostiku a léčbu nemáme. Došlo však k zastavení prudkého nárůstu výskytu těchto nádorů na počátku tohoto století. Nemůžeme být spokojeni ani se skutečností, že počty onemocnění zachycených v I. stadiu nestoupají, spíše naopak a ve stadiích pokročilejších se nemění (graf 3). Onemocnění je mnohem častější u mužů – objevuje se třikrát více v porovnání se ženskou populací a vrcholu výskytu dosahuje ve starším věku kolem 75 let (graf 2). Neexistuje žádný efektivní screening a jedinou výhodou proti dobám dřívějším tak je lepší vybavení urologických ordinací a snaha urologů v rámci kontrol nemocných s jakoukoliv diagnózou a pravidelné sonografické zhodnocení ledvin a močového měchýře. To by mohlo v brzké době pomoci tyto výsledky poněkud zlepšit.
Charakteristika nádorů močového měchýře
Etiologicky lze potvrdit několik faktorů, které při vzniku onemocnění hrají významnější roli. Jedním a bezpochyby nejdůležitějším z nich je kouření, které vede ke čtyřnásobnému zvýšení počtu nádorů, především vlivem přispění působení metabolitů na sliznici močového měchýře s následkem transformace epitelu. Kouřením indukované tumory (představují nadpoloviční většinu zhoubných nádorů u mužů a zhruba třetinu u žen, k poklesu o 40 % vede interval nekouření alespoň 4 roky a po 25 letech abstinence je incidence snížena o 60 %) jsou často většího rozsahu a agresivnějšího chování. Karcinogenně však působí také množství dalších chemických sloučenin, včetně léčiv vylučovaných ledvinami. Mezi tyto profesní rizikové skupiny patří pracující v textilním, kožedělném nebo petrochemickém průmyslu zpracovávající gumu či ve výrobě pneumatik. Onemocnění se typicky vyskytuje ve starším věku, což znamená, že působení většiny změn musí být dlouhodobé, třeba 15–30 let. Do této skupiny spadají i lidé dlouhodobě užívající fenacetin v léčbě bolesti. Negativně působí opakované záněty měchýře a snížení možností imunitního dohledu, které s nimi může souviset. Proti jiným onemocněním je naopak dosti zanedbatelný genetický původ tumoru (cca jen v 1 % případů). Předchozí radioterapie v oblasti pánve riziko vzniku nádoru zvyšuje dvakrát až čtyřikrát a chemoterapie – např. cyklofosfamidem používaným u hematologických malignit nebo nádorů prsu – dokonce až devětkrát. Parazitární postižení schistosomiázou je v našich podmínkách naštěstí velmi vzácné.
Symptomatologie onemocnění je po dlouhou dobu nevýrazná a imituje potíže podobné zánětu – bolesti při močení, zhoršené vyprazdňování, dysurie a strangurie. U většiny nemocných lze pozorovat intermitentní nebo trvalou hematurii, která se až velmi pozdě projevuje anemizací s narůstají únavou, nechutenstvím nebo hmotnostním úbytkem.
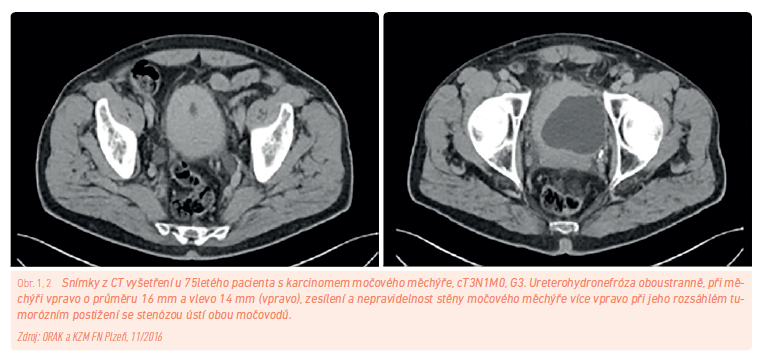
K diagnostice vlastního nádoru jsou obvyklé grafické metody využívány poměrně zřídka, jisté vodítko může přinést i běžné mikroskopické vyšetření moči. Řada pacientů je obézních a pro ultrasonografii obtížně dostupných, vyšetření pomocí výpočetní tomografie (computer tomography, CT) a pomocí magnetické rezonance (MR) pánve ukáže již rozsáhlejší a pokročilejší nálezy v podobě masivního rozšíření stěny měchýře nebo na ně navazující změny – postižení lymfatických uzlin, ureterohydronefrózu, invazi tumoru do prostaty nebo rekta apod. (obr. 1, 2). Vyšetření pomocí pozitronové emisní tomografie a CT (PET/CT) s fluorodeoxyglukózou je kvůli jejímu vylučování močovými cestami a kumulaci aktivity v měchýři nevhodné. Všechny tyto metody mají tedy hlavní uplatnění pro stanovení stadia nádoru a přítomnosti generalizace. Pro záchyt onemocnění již v iniciální fázi je tedy zapotřebí časné provedení endoskopie. Právě cystoskopie dokáže tumor nejenom odhalit, ale díky doplněné biopsii také histologicky ověřit a samozřejmě díky transuretrální resekci (TUR) v řadě případů i kompletně vyřešit. Podmínkou je pak dosažení R0 resekce do zdravých okrajů a potvrzení postižení pouze vrstvy epitelu bez invaze do hlubších vrstev svaloviny měchýře. Vyšší míru rizika recidivy mají tumory vícečetné, plošně rozsáhlejší – nad 3 cm, již recidivující a hůře diferencované.
Histopatologicky se v naprosté většině jedná o uroteliální karcinomy, jen výjimečně se objevují adenokarcinomy a nediferencovaný nebo spinocelulární (často v souvislosti s infekcí schistosomiázou) karcinom. Neinvazivní prekancerózy ve formě nádoru in situ jsou zachyceny vzácně. Nejčastější formou je uspořádání papilární a nádorové změny obvykle postihující měchýř víceložiskově. Infiltrace uzlinová je běžná v pánvi, ale může postihnout i oblast retroperitonea. Metastázy vzdálené jsou proti ostatním nádorům méně časté, vyskytnout se však mohou v jakékoli lokalizaci.
Terapie
Podobně jako u ostatních nádorových onemocnění je i u tumorů močového měchýře terapie většinou multidisciplinární. U lokalizovaných a neinvazivních lézí jednoznačně dominuje chirurgie, u nálezů pokročilejších je však nutno i radikální operaci doplnit o zbylé metody onkologické léčby – radioterapii a systémovou léčbu. Ty jsou samozřejmě základem u nádorů diseminovaných, kdy chemoterapii bude postupně nahrazovat imunoterapie, avšak i trimodální léčba má velký význam, kdy může umožnit zachování močového měchýře při nezhoršení léčebných výsledků a udržení kvality života.
Chirurgická léčba
Terapeutickým základem pro neinvazivní nebo iniciálně invazivní, byť víceložiskové nádory je chirurgická léčba. Dobře provedená TUR představuje dostatečný, přitom však bezpečný a funkci měchýře nepoškozující výkon. Drobné změny lze ošetřit elektrokoagulací nebo laserem. Jelikož nádory zcela běžně recidivují, kromě pečlivé dispenzarizace je rovněž často u multifokálních lézí vhodné doplnit adjuvantní léčbu proplachy močového měchýře cytostatikem nebo BCG vakcínou. Rozsáhlejší nádory infiltrující do svaloviny je nutno řešit přinejmenším parciální cystektomií, při vícečetném postižení ale spíše cystektomií radikální (RC). V rámci tohoto výkonu je doplněna i pánevní lymfadenektomie, u mužů bývá odstraněna kromě měchýře i prostata a u žen tento zákrok zahrnuje hysterektomii s oboustrannou adnexektomií. Současně je třeba tedy vyřešit derivaci moči, ta má nejčastěji podobu ureteroileostomie pomocí exkludované střevní kličky s odvodem moči do stomického sáčku na břiše. Méně častá je oboustranná ureterostomie, při které není třeba výkonu na střevě, ale lepení dvou urostomických sáčků je nevýhodou. V některých případech lze ze střeva vytvořit náhradní neoveziku a napojit ji na ponechanou uretru. Její vyprázdnění je třeba natrénovat. Radikální výkon je velmi náročný, dlouhý a může být spojen s významnou pooperační morbiditou, není tedy vhodný pro každého pacienta. Jde však o jedinou metodu kurativní léčby, radioterapie – byť rovněž radikální – není optimální alternativou.
Je však nutno si přiznat, že lepší výsledky RC proti RT při jejich vzájemném porovnání jsou nejspíše ovlivněny odlišným stavem nemocných zařazovaných k těmto léčebným modalitám. Zatímco k radikální operaci jsou směrováni pacienti mladší, zdravější a v lepším celkovém stavu, ti horší, kteří by výkon zvládali hůře, podstupují spíše léčbu zářením. Přesto je RC základem léčby u nádorů stadia II a III, ale využívána je i u lokálně pokročilých a/nebo metastatických tumorů IV. stadia, pokud je pacient radikální výkon schopen podstoupit a dá se předpokládat jeho přínos.
Radioterapie samostatná a v kombinačních strategiích
Tato metoda lokální léčby patří u nádorů močového měchýře k méně využívaným, ale její pozice je přesto stabilní a v rámci trimodálních kombinovaných postupů nabízí pro pacienty nové možnosti. Naopak samostatná předoperační RT používána není – podle metaanalýzy šesti publikovaných randomizovaných studií byla sice spojena s vyšším počtem patologických kompletních remisí (9 % vs. 34 %), ale ke zlepšení přežití v porovnání pouze s operačním řešením nevedla. V této indikaci je nahrazována spíše chemoterapií, jejíž výsledky sice nejsou podle 11 studií (n = 3 005) nikterak závratné, jsou dosti heterogenní, avšak souhrnně vedla ke zlepšení pětiletého přežití o 5 % (z 50 % na 55 %).
Kombinovaná předoperační RT a CHT je založena na třech možných konceptech: RT s režimem M‑VAC vs. cisplatina s operací, RT v kombinaci s cisplatinou a operací nebo RT spolu s cisplatinou a fluorouracilem a operací. Nedávná britská studie již dokonce prokázala, že dva cykly chemoterapie s následnou radiochemoterapií jsou spojeny se zlepšeným dvouletým přežitím bez progrese (progression free survival, PFS) 67 % vs. 54 % (p = 0,03) a s pětiletým celkovým přežitím (overall survival, OS) 48 % vs. 35 % (p = 0,16) – výsledky se tedy zdají totožné s výsledky operační radikální cystektomie. Není to však metoda vhodná pro všechny. Podle stavu pacienta ji lze zvažovat u nádorů lokálně pokročilých (T1 a G3 nebo T2–4N0M0) nebo po TUR u recidivujících nádorů a cílem je právě dosažení výsledků srovnatelných s radikální léčbou při zachování kvality života.
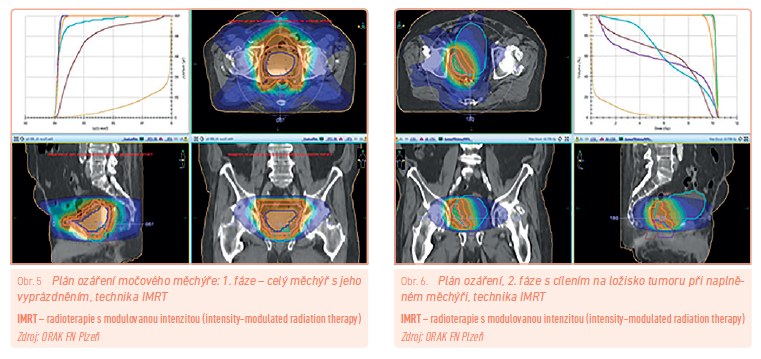
Plánování RT využívá nejčastěji dat z CT vyšetření a v dnešní době je založeno na technice radioterapie s modulovanou intenzitou (intensity‑modulated radiation therapy, IMRT). Využívána je standardní frakcionace s dávkou/frakcí 1,8–2,0 Gy denně, nejčastěji v první fázi s vyprázdněným měchýřem a se zahrnutím nebo bez zahrnutí pánevních uzlin podle jejich postižení a dalších charakteristik do dávky cca 50,4 Gy, následně s jejím plánovaným zvýšením redukovaným objemem s naplněným močovým měchýřem do celkové dávky 66 Gy či maximálně 70–74 Gy (obr. 5, 6). Zatímco jiné, alternativní režimy (např. 55 Gy/20 frakcí) jsou používány minimálně, pokud není kontraindikace, měla by aktinoterapie být z důvodu vyšší účinnosti vždy doplněna o konkomitantní chemoterapii. I když léčebný záměr může být radikální, výsledky nejsou optimální, zřejmě i vlivem horších vstupních parametrů, jelikož většina nemocných v lepším stavu – jak je uvedeno výše – je indikována k cystektomii.
Možnosti systémové léčby
Nejjednodušší formou je intravezikální chemoterapie nebo imunoterapie. Instilace cytostatika (nejčastěji epirubicinu, ev. mitomycinu C) či BCG vakcíny by měla navazovat na provedenou TUR v brzkém termínu, nejlépe v následujících hodinách, a u rizikovějších pacientů je prováděna i opakovaně zavedeným močovým katétrem, aby splnila požadavky kladené na adjuvanci u rozsáhlejších, ale přesto stále stěnu měchýře neinfiltrujících nálezů, zejména po zachycení jejich časné recidivy. Lokální použití je spojeno se zcela mizivou toxicitou. Instilační režimy se odlišují podle typu použité léčby, výchozího nálezu a rizikovosti recidivování.
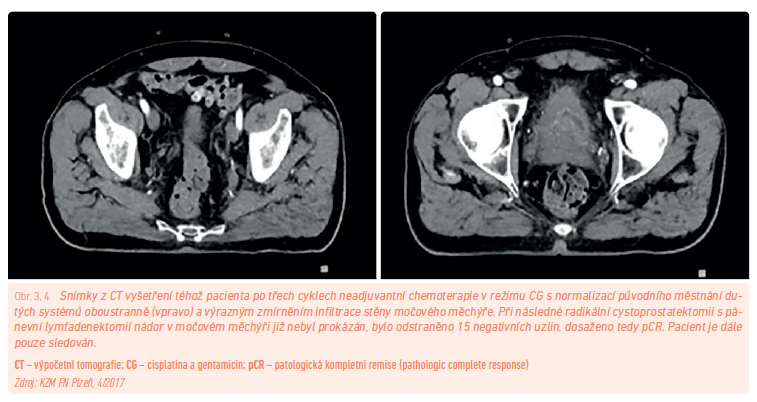
Chemoterapie (viz výše) má tedy lepší postavení v neoadjuvanci (obr. 3, 4). Při zařazení adjuvantním a zejména paliativním jsou její možnosti značně omezené, studie používající režimy M‑VAC (lépe ve své dávkově denzní podobě, s ohledem na značnou klasiku je tento režim v klasické podobě považován za obsoletní), CISCA (cisplatina, cyklofosfamid, doxorubicin) nebo CAP (cisplatina, doxorubicin, cyklofosfamid) byly ve svých výsledcích víceméně negativní a neprokázaly zlepšení přežití, takže léčbu je možné podat spíše jen u pacientů s nádory po cystektomii hodnocenými jako pT3 a 4 s lymfovaskulární propagací.
Bylo rovněž potvrzeno, že náhrada cisplatiny za karboplatinu není optimální. Její efekt je totiž suboptimální, takže např. při zjištění renální insuficience je přesto vhodnější podat cisplatinu třeba rozděleně (den 1 a 2 nebo 1 a 8). Nejsou rovněž data na využití nízkodávkované cisplatiny v týdenním režimu.
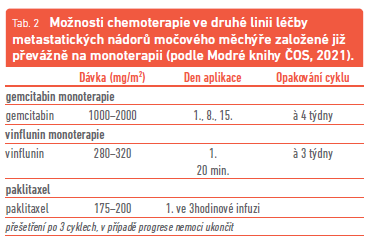
Problémem je, že cytostatik účinných u nádorů měchýře je málo a dosažená léčebná odpověď není nikterak závratná ani dlouhodobá. Ve většině případů se vlivem zhoršujícího celkového stavu a narůstající symptomatologie (ureterohydronefróza, selhávání ledvin, hematurie, bolesti v pánvi) nemocný s pokročilým či recidivujícím nádorem v běžné klinické praxi ve většině případů dočká jen druhé linie paliativní léčby. Data o své účinnosti v ní měl dosud především vinflunin, je tedy patrné, že v rámci chemoterapie mnoho možností skutečně nemáme. Jedinou alternativou je již jen monoterapie taxanem, gemcitabinem nebo karboplatinou, poslední dva přípravky však často již selhaly v předchozí linii. Doporučené režimy shrnují tabulky 1 a 2. Nelze se tedy divit, že v současné době je velká pozornost věnována imunoterapii.
Imunoterapie
Nejnovější léčebná metoda se postupně posouvá z pozdějších linií léčby pokročilých a metastatických nádorů měchýře a měla by brzy najít uplatnění i v jejich terapii primární. Je však zapotřebí stanovení pozitivity PD‑L1 (ligand membránového proteinu programované buněčné smrti, programmed cell death ligand 1) v tumoru. Větší šanci na její podání mají pacienti, u kterých je kontraindikace podání cisplatiny. Aplikace imunoterapie probíhá v komplexních onkologických centrech, neboť je provázena proti chemoterapii zcela odlišnou toxicitou. Ta postihuje spíše funkci různých orgánů (v podobě pneumonitidy, pankreatitidy, hypotyreózy nebo hypertyreózy apod., zatímco alopecie, nauzea, zvracení, průjmy, neurotoxicita či hematotoxicita jsou doménou chemoterapie). Tyto nežádoucí účinky mohou být i život ohrožující a alespoň některý z těchto projevů se v alespoň mírnější formě vyskytuje prakticky u každého z pacientů.
Imunoterapie je podávána infuzně po dvou, třech nebo šesti týdnech podle typu léčiva v časově omezeném počtu cyklů nebo do progrese či nezvladatelné toxicity. K dispozici jsou nyní check‑point inhibitory atezolizumab, pembrolizumab, avelumab a nivolumab, z hlediska využití je však nutno dbát na aktuální kritéria pro schválení jejich úhrady a respektovat indikační omezení. Dojít může k pseudoprogresi nálezu, i hodnocení dosažené léčebné odpovědi podle iRECIST kritérií je tedy složitější a mělo by být prováděno zkušeným radiodiagnostikem. Dá se však očekávat, že v multimodálních postupech imunoterapie nahradí dosud běžnější chemoterapii.
Diskuse
Pro nádory močového měchýře platí, že velmi záleží na synchronizaci nebo naopak volbě optimální léčebné sekvence. Velká variabilita je patrná především u pokročilých onemocnění, kdy může být provedení RC hraniční, a lze proto zvažovat neoadjuvantní chemoterapii s cílem dosažení downstagingu a downsizingu (optimálním stavem je dosažení patologické kompletní regrese). Naopak není‑li tato metoda použita před výkonem, je obvykle indikována pooperačně v adjuvanci. Pokud není výkon radikální a je přítomno nádorové reziduum, je vhodné naopak zvažovat zařazení radioterapie.
Problematika provádění radikálních cystektomií je spojena s nutnou centralizací. Výzkum České urologické společnosti JEP prokázal, že většina těchto výkonů je uskutečněna v několika největších zdravotnických zařízeních, která jsou tedy dostatečně zkušená a výsledky v nich dosažené jsou zdaleka nejlepší. Část operací je však vykázána na menších pracovištích, kde je tento rozsáhlý zákrok prováděn velmi zřídka, nebo dokonce po mnoha letech, a tím dochází k navýšení rizika pooperační morbidity a mortality a ke zhoršení prognózy nemocných, kteří jsou tam léčeni.
V rámci radioterapie lze uvést i vzácnější metody léčby, např. brachyterapie v podobě prošití stěny měchýře vláknem obsahujícím radioizotop nebo techniky založené na záření neionizujícím, fotodynamické léčbě. Její podstatou je podání fotosenzibilizátoru a po jeho vychytání v nádorových buňkách terapeutické ozáření těchto míst laserem. Jde o elegantní, vesměs nezatěžující a opakovaně proveditelnou terapii, v podmínkách ČR však dnes žádná z těchto metod dostupná není.
Závěr
Většina zhoubných nádorů močového měchýře je v důsledku nepřehlédnutelné hematurie naštěstí zachycena v časné fázi. U těchto neinvazivních nádorů jsou dostatečně radikálním léčebným postupem endoresekční výkony ve formě transuretrální resekce. Jelikož tyto nálezy mají značnou tendenci recidivovat, je třeba pečlivého a pravidelného cystoskopického sledování s provedením reresekce. Při přítomnosti dalších rizikových parametrů je po výkonu vhodné zajištění adjuvantní intravezikální instilací cytostatika nebo BCG vakcíny. U pokročilejších nálezů je metodou volby rovněž chirurgie, radikální cystektomie je však náročným výkonem a přes více možností následné derivace moči je spojena se zásadní změnou kvality života. Stále více se tedy uplatňují metody založené na souběhu tří metod protinádorové léčby (CHT, RT a parciální resekční zákrok), po kterých je možno dokonce se zlepšenými výsledky přistoupit k výkonu zachovávajícímu měchýř. Při diseminaci onemocnění má zásadní význam systémová léčba. Doposud užívanou chemoterapii, v první linii kombinovanou, v další pak již spíše jen v podobě monoterapie, má tendenci v brzké době nahradit imunoterapie. Navíc lze předpokládat, že své místo si tato metoda najde také v uvedených multimodálních postupech a nejspíše i v adjuvanci po neradikálních operacích, vždyť i výplachy měchýře BCG vakcínou jsou založeny na imunomodulačním principu.
Literatura
Advanced Bladder Cancer (ABC) Meta‑analysis Collaboration. Neoadjuvant chemotherapy in invasive bladder cancer: Update of a systematic review and meta‑analysis of individual patient data advanced bladder cancer (ABC) meta‑analysis collaboration. Eur Urol 2005;48:202–205.
Balar AV, Galsky MD, Rosenberg JE, et al. IMvigor210 Study Group. Atezolizumab as first‑line treatment in cisplatin‑ineligible patients with locally advanced and metastatic urothelial carcinoma: a single‑arm, multicentre, phase 2 trial. Lancet 2017;389:67–76.
Bellmunt J, de Wit R, Vaughn DJ, et al. Pembrolizumab as Second‑Line Therapy for Advanced Urothelial Carcinoma. N Engl J Med 2017;376:1015–1026.
Gartrell BA, He T, Sharma J, et al. Update of systemic immunotherapy for advanced urothelial carcinoma. Urol Oncol 2017;35:678–686.
Grossman HB, Natale RB, Tangen CM, et al. Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer. N Engl J Med 2003;349:859–866. International Collaboration of Trialists; Medical Research Council Advanced Bladder Cancer Working Party (now the National Cancer Research Institute Bladder Cancer Clinical Studies Group); European Organisation for Research and Treatment of Cancer Genito‑Urinary Tract Cancer Group. International phase III trial assessing neoadjuvant cisplatin, methotrexate, and vinblastine chemotherapy for muscleinvasive bladder cancer: Long‑term results of the BA06 30894 trial. J Clin Oncol 2011;29:2171–2177.
Kitamura H, Tsukamoto T, Shibata T, et al. Randomised phase III study of neoadjuvant chemotherapy with methotrexate, doxorubicin, vinblastine and cisplatin followed by radical cystectomy compared with radical cystectomy alone for muscle‑invasive bladder cancer: Japan Clinical Oncology Group Study JCOG0209. Ann Oncol 2014;25:1192–1198.
Krause F, Ott O, Haeberle B, et al. Validation of a trimodalitiy treatment and selective organ preservation for bladder cancer: Influence of clinical different parameters on the 15‑year long‑term outcome. J Clin Oncol 2010;28:15s: suppl; abstr 4575.
Matoušková M, Svoboda T. Multimodální přístup k nádorům močového měchýře a prostaty. Praha, Solen, 2018.
Modrá kniha ČOS, 27. aktualizace. Brno, 2021.
Petrelli F, Coinu A, Cabiddu M, et al. Correlation of pathologic complete response with survival after neoadjuvant chemotherapy in bladder cancer treated with cystectomy: A meta‑analysis. Eur Urol 2014; 65:350–357.
Plimack ER, Hoffman‑Censitz JH, Viterbo R, et al. Accelerated methotrexate, vinblastine, doxorubicin, and cisplatin is safe, effective, and efficient neoadjuvant treatment for muscle‑invasive bladder cancer: results of a multicenter phase II study with molecular correlates of response and toxicity. J Clin Oncol 2014;32:1895–1901.
Rosenblatt R, Sherif A, Rintala E, et al. Pathologic downstaging is a surrogate marker for efficacy and increased survival following neoadjuvant chemotherapy and radical cystectomy for muscleinvasive urothelial bladder cancer. Eur Urol 2012;61:1229–1238.
Sharma P, Retz M, Siefker‑Radtke A, et al. Nivolumab in metastatic urothelial carcinoma after platinum therapy (CheckMate 275): a multicentre, single‑arm, phase 2 trial. Lancet Oncol 2017;18:312–322.
Sherif A, Holmberg L, Rintala E, et al. Neoadjuvant cisplatinum based combination chemotherapy in patients with invasive bladder cancer: A combined analysis of two Nordic studies. Eur Urol 2004;45:297–303.
ÚZIS ČR, HYPERLINK “http://www.svod.cz” www.svod.cz. Novotvary 2015, Národní onkologický registr, ÚZIS, Praha 2017.
Witjes JA, Comperat E, Cowan NC, et al. EAU guidelines on muscle‑invasive and metastatic bladder cancer: Summary of the 2013 guidelines. Eur Urol 2014;65:778–792.
Yin M, Joshi M, Meuer RP, et al. Neoadjuvant chemotherapy for Muscle‑Invasive Bladder Cancer: A Systemic review and two‑step meta‑analysis. The Oncologist 2016;21:1–7.
Zargar H, Espiritu PN, Fairey AS, et al. Multicenter assessment of neoadjuvant chemotherapy for muscle invasive bladder cancer. Eur Urol 2015;67:241–249.