Proč je management deficitu železa v guidelines ESC?
Srdeční selhání je často doprovázeno anémií, respektive deficitem železa, který má na prognózu nemocných významný vliv. Na současné možnosti řešení tohoto problému se zaměřilo sympozium společnosti Swixx Biopharma, které bylo součástí letošního XXX. výročního sjezdu České kardiologické společnosti.
Sympoziu předsedal prof. MUDr. Aleš Linhart, DrSc., přednosta II. interní kliniky kardiologie a angiologie 1. LF UK a VFN v Praze, který úvodem zdůraznil, že deficit železa je jednou z velmi důležitých komorbidit srdečního selhání. Predikce prognózy pacientů se srdečním selháním vychází právě z počtu přidružených onemocnění – čím více komorbidit, tím samozřejmě horší prognóza. Anémie samotná však riziko úmrtí u srdečního selhání zvyšuje až dvakrát. K deficitu železa vede řada procesů a ovlivnění anémie musí být prováděno komplexně.
Anémie je v doporučeních přesně definována jako pokles hemoglobinu pod hranici 120 g/l u žen a 130 g/l u mužů. Absence anémie však nevylučuje deficit železa. Deficit železa je definován jako koncentrace feritinu pod 100 µg/l nebo koncentrace feritinu v pásmu 100–299 µg/l a zároveň saturace transferinu železem (TSAT) nižší než 20 procent. U pacientů se srdečním selháním je proto doporučen screening stanovením hodnoty hemoglobinu, feritinu a TSAT. Podle recentních studií se ukazuje, že saturace transferinu je důležitým faktorem ukazujícím na prognózu pacienta.
Nedostatek železa a srdeční selhání
Prof. MUDr. Vojtěch Melenovský, CSc., vedoucí Oddělení srdečního selháníKliniky kardiologie IKEM, rozebral roli železa v patofyziologii srdečního selhání. Lidské tělo obsahuje 3 až 4 g železa a denně dochází k resorpci jen minimálního množství železa (1–2 mg), takže jeho doplnění je dlouhodobý proces. I přes malé vstřebávání dochází v těle dennodenně k jeho interní recyklaci kostní dření, játry a dalšími orgány. Železo je v krvi vázáno na transportní protein transferinu a intracelulárně je deponováno ve formě feritinu. Regulace železa v těle je zprostředkována hormonem hepcidinem, který je syntetizován v játrech. Hepcidin řídí export z buněk. Ke zvyšování koncentrace hepcidinu dochází při nadbytku železa či probíhajícím zánětlivém onemocnění, tím se snižuje interní recyklace železa.
Železo je v těle důležité nejen pro přenos kyslíku (jako součást hemoglobinu), ale podílí se na řadě imunitních reakcí, syntéze DNA, mitochondriálním metabolismu atd. Porucha mitochodriálního metabolismu při deficitu železa se projevuje v srdečním i kosterním svalu.
Sérová koncentrace železa má výkyvy na základě diurnálních jevů, na základě diety a dalších faktorů. Laboratorní diagnostika deficitu se opírá o hodnotu saturace transferinu železem, jakožto ukazatele mobility železa, a o koncentraci feritinu, která je ukazatelem zásob železa v organismu (viz tabulku 1).
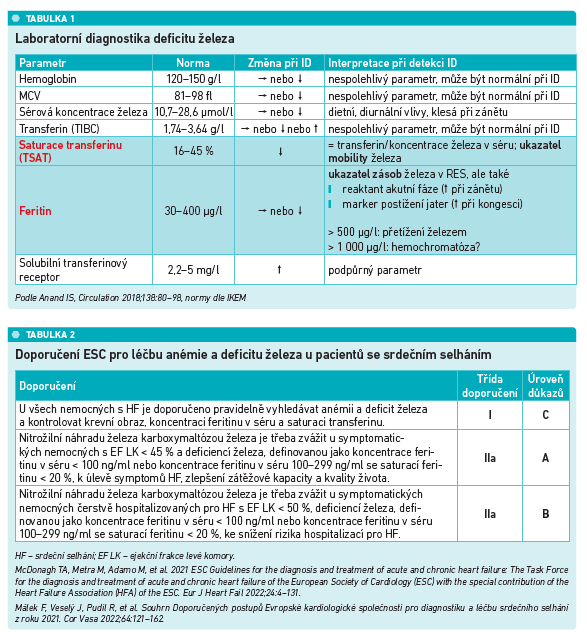
Deficit železa se vyskytuje ve dvou formách. První je absolutní deficit železa, kdy jsou sníženy zásoby železa, a tím je snížen i sérová koncentrace feritinu (hodnota pod 100 µg/l). Mezi nejčastější příčiny tohoto deficitu patří malnutrice, malabsorpce železa, krevní ztráty. Druhou formou je relativní nebo také funkční deficit, kdy jsou zásoby železa vázaného na feritin normální, či dokonce zvýšené, ale špatně funguje jeho interní recyklace. Pro tuto podskupinu nejčastěji platí, že koncentrace feritinu je v rozmezí 100–299 µg/l, avšak saturace transferinu je pod 20 procent. Příčinou tohoto stavu může být zánětlivý stav nebo zvýšená koncentrace hepcidinu.
U pacientů s chronickým srdečním selháním se vyskytuje deficit železa u 30–50 procent pacientů, jedná se tedy o jednu z nejčastějších komorbidit. U pacientů s akutní dekompenzací srdečního selhání podíl pacientů s deficitem dosahuje až 70 procent.
Obecně mezi hlavní příčiny sideropenie patří ženské pohlaví, renální insuficience, chronický zánět (elevace CRP), malnutrice, kongesce, hypoalbuminémie, antitrombotická léčba způsobující častější okultní krvácení u pacientů s antikoagulační či antiagregační terapií.
U pacientů s chronickým srdečním selháním je doporučeno provádět screening deficitu železa minimálně jednou ročně. Většina pacientů s deficitem nemá anémii a časté jsou de novo incidence.
Jak bylo již dříve uvedeno, deficit železa zhoršuje prognózu srdečního selhání a hraje důležitou roli v symptomech srdečního selhání. Jedním z nich je i svalová únava. Subjektivní i objektivní únava byla zlepšena podáním železa pacientům se srdečním selháním. Intolerance námahy u pacientů se srdečním selháním může mít původ ve specifické skeletální myopatii, která je zhoršována nedostatkem železa. Při deficitu železa lze ve svalu prokázat in vivo deficit makroergních fosfátů.
V buňkách myokardu byl též prokázán deficit železa a s tím spojená dysfunkce mitochondriálních enzymů. V recentní studii IRON‑CRT bylo prokázano, že korekce deficitu železa zlepšuje funkci pravé komory bez zvyšujícího efektu na plicní hypertenzi a zlepšuje systolickou funkci LK.
Perorální substituce účinek nemá. Studie IRONOUT HF zkoumající výsledky podávání perorálního železa ukázala, že ani po 16 týdnech se nezměnila koncentrace feritinu ani saturace TSAT. To je zřejmě způsobeno faktem, že nemocní s chronickým srdečním selháním mají vstřebávání železa z gastrointestinálního traktu výrazně sníženo kvůli zvýšené koncentraci hepcidinu a krevní kongesci.
Pro intravenózní léčbu je k dispozici několik přípravků. Starší přípravky jsou výrazně omezeny maximální denní dávkou. Naproti tomu karboxymaltózu železa (FCM, přípravek Ferinject) lze podat i ve vysokých dávkách (500–1 000 mg pomalu intravenózně). Mimo to má velmi nízké riziko vzniku alergické reakce. Korekci deficitu tímto přípravkem lze díky tomu provádět pomocí jedné až dvou dávek. Celková dávka se upravuje dle koncentrace hemoglobinu, hmotnosti a pohlaví pacienta.
Při intravenózním podání železa je nutné dát pozor, aby u pacientů neprobíhala aktivní infekce (sepse) nebo nekontrolovatelné nádorové onemocnění, nesmí být podáváno při známé alergii na přípravky železa, při koncentraci hemoglobinu vyšší než 150 g/l, při anémii či poruše metabolismu železa jiné etiologie (např. myelodysplastický syndrom). Pokud je i přes léčbu pacient anemický nebo u něj došlo k recidivě deficitu železa, je nutné pátrat po okultním krvácení v gastrointestinálním traktu. Během léčby je nutno kontrolovat koncentrace feritinu, neboť hemochromatóza není vzácným onemocněním.
Co doporučují guidelines
Jako další se ujal slova prof. MUDr. Miloš Táborský, CSc., FESC, MBA, přednosta I. interní kliniky FN Olomouc. Jeho přednáška se zabývala doporučenými postupy ESC a shrnovala postoj oficiálních doporučení k deficitu železa. Poslední evropské guidelines z roku 2021 přímo doporučují základní diagnostické testy u pacientů se srdečním selháním (EKG, RTG, BNP, NT‑proBNP…) a další laboratorní testy včetně parametrů železa jako vyšetření. Ve fázi diagnostiky srdečního selhání by mělo vždy dojít ke stanovení koncentrací TSAT a feritinu. Jak již bylo uvedeno výše, pacienti se známým srdečním selháním by měli být opakovaně screenováni na anémii a deficit železa (viz tabulku 2).
Již před propuštěním z lůžkového zařízení při záchytu primárního onemocnění (srdečního selhání) by měl být pacientovi vyšetřen metabolismus železa a zjištěn případný nedostatek. Po propuštění by měla proběhnout časná kontrola (do 1–2 týdnů od propuštění) u kardiologa či v ambulanci srdečního selhání. Při této kontrole by mělo dojít k optimalizaci terapie na základě pacientova klinického stavu, volumového statusu, tlaku krve, srdeční frekvence, laboratorních vyšetření. Z dalších vyšetření je doporučováno právě vyšetření metabolismu železa, pokud tak nebylo učiněno již v rámci hospitalizace. Retrospektivní studie prokázaly nižší míru 30denních rehospitalizací pro dekompenzaci srdečního selhání při dodržování tohoto algoritmu.
Poslední doporučení se mimo jiné také zmiňují o solubilních receptorech transferinu jako dalším budoucím možném markeru anémie, potažmo deficitu železa.
Dále připomínají, že deficit železa se vyskytuje i nezávisle na anémii a je přítomen až u 55 procent pacientů s chronickým srdečním selháním a až u 80 procent s akutním srdečním selháním. Deficit železa zhoršuje funkční kapacitu, vyvolává oběhovou dekompenzaci, dysfunkci srdečního svalstva a křehkost (frailty) bez vztahu k anémii. Doporučené postupy také uvádějí, že intravenózní podávání FCM je bezpečné a zlepšuje symptomatiku srdečního selhání, oproti tomu perorální formy železa jsou neúčinné.
Zvýšená úhrada FCM je indikačně vázána na srdeční selhání třídy NYHA II–III s ejekční frakcí levé komory (EF LK) pod 45 procent, které je současně léčeno ACEI. Srdeční selhání nemusí být primární diagnózou a FCM nemusí být aplikována specializovaným kardiologickým pracovištěm, ale je nutné mít v dekursu či ambulantní kartě uvedeno, že došlo ke splnění indikačních podmínek.
Aplikace FCM v ambulantní péči
Posledním řečníkem byl MUDr. Jiří Veselý, vedoucí lékař kardiologie EDUMED s. r. o., který si připravil krátkou přednášku s názvem „Pohled z kardiologické ambulance: srdeční selhání a kvalita života“. Ukazuje se, že při relativním časném zaléčení srdečního selhání se zlepší nejen přežívání pacienta, ale i jeho celkový stav – zlepšení třídy NYHA, zlepšení tolerance zátěže a hlavně snížení množství hospitalizací. K této léčbě patří i právě zmiňované intravenózní podávání přípravků železa, jak je uvádějí platná doporučení.
Avšak v ambulantní péči může být tato léčba komplikována několika „překážkami“. Řešení těchto „překážek“ se dr. Veselý snažil přiblížit ve své přednášce. První bariérou může být to, že ještě není zcela zvykem diagnostikovat deficit železa v ambulantní sféře. Toto vyšetření by mělo být provedeno u každého pacienta se srdečním selháním s EF LK pod 45 procent. Někdy je nutno parametry železa (feritin, TSAT) i proaktivně doplnit do laboratorní žádanky.
Další „překážkou“ je někdy objednání přípravku (v režimu ZÚLP) v lékárně přes řádně vyplněnou žádanku, neboť nelze vydat na klasický eRecept. FCM se dodává jako ampule o objemu 10 ml s obsahem 500 mg železa, kterou lze aplikovat přímo pomalou intravenózní injekcí či v malé infuzi s fyziologickým roztokem. Při jednom podání by dávka neměla být vyšší než 15 mg železa na kilogram tělesné hmotnosti v případě i.v. injekce či 20 mg železa na kilogram při i.v. infuzi. Celkově by nemělo být podáno více než 1 000 mg železa za týden.
Po samotné aplikaci je nutné pacienta sledovat po dobu minimálně 30 minut z hlediska možnosti vzniku anafylaktické reakce – ačkoli jsou tyto reakce velmi vzácné.
Závěrem prof. Linhart nastínil budoucnost léčby a poukázal na studie, které dále budou probíhat a budou se zaměřovat na téma deficitu železa u pacientů se srdečním selháním – mezi tyto studie patří studie FAIR‑HF 2, HEART‑FID, IRONMAN, FAIR HFpEF. V léčbě je nutné se i nadále snažit o co největší zlepšení kvality života nejen optimální farmakologií a korekcí deficitu železa, ale i léčbou komorbidit, vakcinací, psychoterapií a dalšími přístupy.