Rok léčby atogepantem v České republice
Migréna je neurologické onemocnění s vysokou prevalencí na celém světě. V roce 2023 trpěly bolestmi hlavy 3 miliardy jedinců s globální věkově standardizovanou prevalencí 34,6 procenta (31,6–37,5) a mírou YLD (years lived with disability) 541,9 (373,4–739,9) na 100 000 obyvatel, přičemž 487,5 (323,0–678,8) na 100 000 obyvatel bylo připsáno migréně (90 %) [1]. Migréna zásadním způsobem mění kvalitu života pacientů, v praxi bývá často podceňována, a to přesto, že již existuje účinná léčba. Proto jsou vítány počiny, které rozšíří povědomí o diagnostice a terapii této velmi obtěžující choroby. Takovou příležitostí bylo i sympozium, které uspořádala společnost AbbVie o moderním způsobu preventivní léčby migrény atogepantem. Odbornému setkání předsedal MUDr. Tomáš Nežádal, Ph.D. (ÚVN Praha, předseda Sekce pro diagnostiku a léčbu bolestí hlavy České neurologické společnosti ČLS JEP).
Profesor Piero Barbanti (San Raffaele University, Řím) v online připojení podrobně rozebral probíhající multicentrickou prospektivní studii z reálné praxe GIANT (A prospective multicenter, realworld study on the effectiveness, safety, and tolerability of atogepant in migraine patients with multiple therapeutic failures). Profesor Brabanti je současně hlavním řešitelem a prvním autorem této studie, jejíž předběžné výsledky byly uveřejněny v květnu 2025 [2].
Tato studie z reálné praxe byla uspořádána, protože atogepant, první perorální antagonista receptoru CGRP schválený pro prevenci migrény, prokázal účinnost a bezpečnost v randomizovaných klinických studiích (RCT), ale prospektivní data z reálného světa chyběla. Cílem zmíněné studie bylo prozkoumat účinnost, bezpečnost a snášenlivost atogepantu 60 mg ve 12. týdnu u pacientů s epizodickou migrénou s vysokou frekvencí (HFEM, 8–14 dnů/měsíc) nebo chronickou migrénou (CM) s mnohočetnými předchozími terapeutickými selháními. Do studie probíhající v 16 centrech byli zařazeni po sobě jdoucí dospělí s HFEM nebo CM, u kterých selhaly ≥ 3 předchozí preventivní léčby podle kritérií AIFA (Italská léková agentura). Účastníci dostávali atogepant 60 mg denně v plánované léčbě po dobu 12 měsíců.
Primárním cílem byla změna od výchozího stavu do 12. týdne v počtu dnů s migrénou v měsíci (MMD) pro HFEM a v počtu dnů s bolestí hlavy v měsíci (MHD) pro CM.
Sekundární cílové parametry představovaly změny v měsíčním užívání analgetik (MAI), v intenzitě bolesti (NRS), disabilitě (HIT‑6, MIDAS), v zátěži mezi atakami (MIBS‑4), tj. reziduální bolesti hlavy, vyhýbání se fyzické zátěži apod., spokojenost s léčbou (PGI‑C), podíl respondentů (zlepšení ≥ 50 %, ≥ 75 %, 100 %) a změny ve frekvenci migrén během prvního týdne léčby ve srovnání s posledním týdnem před léčbou. Nežádoucí účinky byly sledovány po celou dobu.
Studijní populace 82 pacientů – účinnost
 Výchozí hodnoty hodnocené studijní populace:
Výchozí hodnoty hodnocené studijní populace:
- HFEM 42,7 procenta
- CM 57,3 procenta
- MO (Medication Overuse) 41,5 procenta
- Konkomitantní profylaxe 33 procent
- Průměrný počet předchozích léčebných selhání 4,4
- Předchozí selhání alespoň jedné anti‑CGRP MoA 41,5 procenta
- Psychiatrické komorbidity 32,9 procenta
Dodatečně bude účinnost hodnocena u zbylých pacientů, kteří zatím pokračují ve studii.
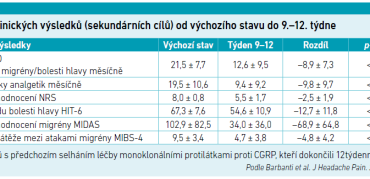
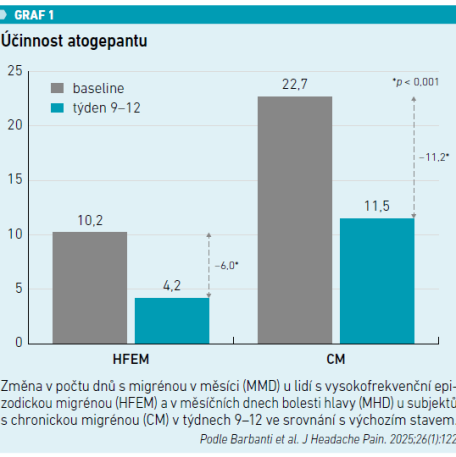 Celkem bylo zařazeno 183 pacientů a 82 dokončilo ≥ 12 týdnů sledování. Z nich 41,5 procenta mělo dříve selhání léčby monoklonálními protilátkami proti CGRP. V celé hodnocené studijní populaci bylo ve 12. týdnu pozorováno významné snížení (p < 0,001) MMD u HFEM (–6,0) a MHD u CM (–11,2) (viz graf 1). Došlo ke statisticky významnému zlepšení i v případě sekundárních cílových parametrů (p < 0,001): MAI (–10,9), NRS (–2,7), HIT‑6 (–13,2), MIDAS (–61,1) a MIBS‑4 (–5,4) (viz tabulku).
Celkem bylo zařazeno 183 pacientů a 82 dokončilo ≥ 12 týdnů sledování. Z nich 41,5 procenta mělo dříve selhání léčby monoklonálními protilátkami proti CGRP. V celé hodnocené studijní populaci bylo ve 12. týdnu pozorováno významné snížení (p < 0,001) MMD u HFEM (–6,0) a MHD u CM (–11,2) (viz graf 1). Došlo ke statisticky významnému zlepšení i v případě sekundárních cílových parametrů (p < 0,001): MAI (–10,9), NRS (–2,7), HIT‑6 (–13,2), MIDAS (–61,1) a MIBS‑4 (–5,4) (viz tabulku).
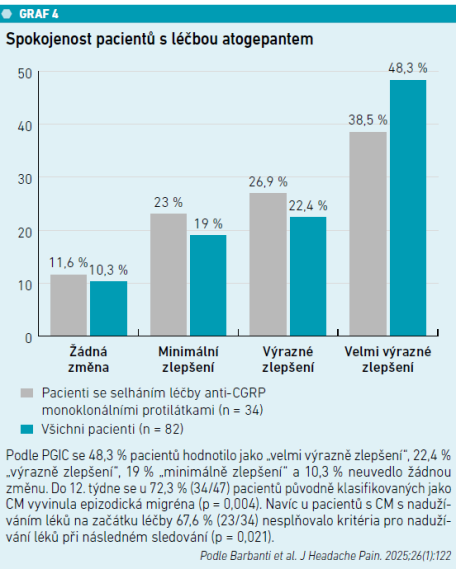
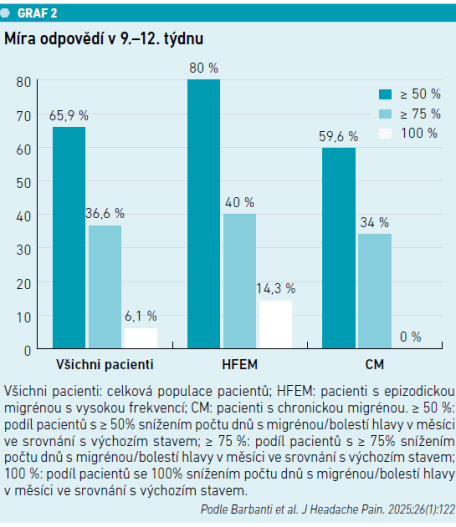 Podíl respondentů byl 65,9 procenta (≥ 50% zlepšení), 36,6 procenta (≥ 75% zlepšení) a 6,1 procenta (100%, tj. úplné vymizení migrény/bolesti hlavy) (viz graf 2). Skóre PGIC dokumentovalo vysokou spokojenost (výrazné/velmi výrazné zlepšení: 70,7 %). Významný pokles frekvence migrén byl patrný již v 1. týdnu (všichni: –2,5 dne, HFEM: –1,5, CM: –3,1; p < 0,001).
Podíl respondentů byl 65,9 procenta (≥ 50% zlepšení), 36,6 procenta (≥ 75% zlepšení) a 6,1 procenta (100%, tj. úplné vymizení migrény/bolesti hlavy) (viz graf 2). Skóre PGIC dokumentovalo vysokou spokojenost (výrazné/velmi výrazné zlepšení: 70,7 %). Významný pokles frekvence migrén byl patrný již v 1. týdnu (všichni: –2,5 dne, HFEM: –1,5, CM: –3,1; p < 0,001).
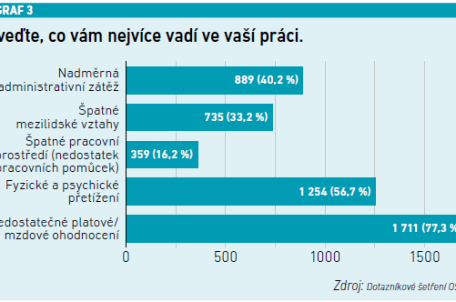
V podskupině pacientů se selháním monoklonálních protilátek proti CGRP byl podíl respondentů 52,9 procenta v kategorii ≥ 50% zlepšení a 23,5 procenta s ≥ 75% zlepšením a též s významným zlepšením všech primárních a sekundárních cílových parametrů (p < 0,001) (viz graf 3). Nežádoucí účinky se vyskytly u 5,5 procenta pacientů (zácpa, nauzea, hypertenze) a 1,6 procenta léčbu ukončilo.
Studie GIANT tedy poskytuje reálné důkazy o účinnosti, bezpečnosti a snášenlivosti atogepantu u pacientů s HFEM a CM s mnohočetnými terapeutickými selháními a komorbiditami. Prokazuje rychlý nástup účinku, významné snížení intenzity bolesti a disability v období mezi atakami, vysokou spokojenost pacientů (viz graf 4) a účinnost i u pacientů se selháním monoklonálních protilátek proti CGRP [2].
MUDr. Michal Bajaček, Ph.D., z ÚVN Praha svou prezentaci uvedl tím, že atogepant je indikován k profylaxi migrény u dospělých, kteří mají nejméně čtyři dny s migrénou za měsíc (MMD). Doporučená dávka je 60 mg atogepantu jednou denně s jídlem nebo bez jídla. Podávání atogepantu se nedoporučuje při těžkém jaterním selhání [3]. Od 1. 7. 2024 je atogepant (Aquipta) hrazen ze zdravotního pojištění pro pacienty, kteří mají minimálně čtyři dny s migrénou za měsíc, po selhání minimálně dvou tříd profylaktik, z nichž alespoň jedno je antiepileptikum (topiramát, valproát – pokud k nim není kontraindikace).
 „S atogepantem máme již delší zkušenosti než jeden rok, protože jsme v roce 2020 zařadili první pacienty do studie PROGRESS/ELEVATE,“ uvedl doktor Bajaček. Klinických studií s open label fází se účastnilo 30 pacientů po tři roky až do registrace atogepantu. Léčbu dokončilo 95 procent pacientů.
„S atogepantem máme již delší zkušenosti než jeden rok, protože jsme v roce 2020 zařadili první pacienty do studie PROGRESS/ELEVATE,“ uvedl doktor Bajaček. Klinických studií s open label fází se účastnilo 30 pacientů po tři roky až do registrace atogepantu. Léčbu dokončilo 95 procent pacientů.
Vstupní kritérium do studie PROGRESS/ELEVATE bylo vysazení anti‑CGRP přípravků více než šest měsíců před zařazením, přičemž nemuselo jít o selhání, ale i o switch. Aktuálně se v ambulanci dr. Bajačeka léčí atogepantem s možnou přestávkou 25 pacientů již pět let; dva pacienti neodpovídali na léčbu a jeden ukončil léčbu pro zácpu.
V klinické studii PROGRESS byla nejčastějším nežádoucím účinkem zácpa (kolem 10 % léčených), která se však vyskytla i v placebové skupině (3,1 %) [4]. „Z mé zkušenosti vyplývá, že jde o nezávažné a málo časté nežádoucí účinky, takže nemám pochyby o efektivitě a bezpečnosti léčby,“ komentoval doktor Bajaček.
Po perorálním podání je účinné plazmatické koncentrace dosaženo do necelých 30 minut, maximální koncentrace za 2 hodiny. Není nutná titrace a relativně rychle dochází k eliminaci – po podání je eliminační poločas přibližně 11 hodin [5], u subkutánních anti‑CGRP monoklonálních protilátek však činí minimálně 28 dnů [6]. Krátká doba eliminace atogepantu je výhodou u rizikových pacientů a u žen ve fertilním věku.
Pacienti v centru bolestí hlavy v ÚVN Praha
„Na Akademii bolestí hlavy v září 2025 v Žilině představila MUDr. Dana Čtrnáctá přehled účinnosti léčby u souboru 58 pacientů s migrénou léčených v ÚVN,“ řekl doktor Bajaček. Ve skupině k biologické léčbě naivních bylo 65 procent pacientů se 75% odpovědí a 22 procent se 100% odpovědí, tj. celkem zde bylo 87 procent superrespondérů. Ve skupině switchovaných bylo 30 procent superrespondérů a v 70 procentech byla odpověď 50%.
Rozhodování o léčbě atogepantem vs. monoklonální protilátkou
Záleží na preferenci pacienta, jakému způsobu aplikace dává přednost, což má význam především u nepředléčených, kteří zatím nemají zkušenosti s nežádoucími účinky. Aktuální statistika doktora Bajačeka svědčí o poměru způsobu aplikace tablety: subkutánní injekce: intravenózní infuze 7 : 5 : 1. Zde však šlo i o switchované nemocné (kromě pacientů s výraznými nežádoucími účinky nebo selháním při léčbě monoklonální protilátkou proti CGRP). Je zapotřebí určité opatrnosti u pacientů léčených silnými inhibitory OATP (atorvastatin, telmisartan, rifampicin, cyklosporin, ritonavir) a silnými inhibitory CYP3A4 (klaritromycin), které mohou zvýšit systémovou expozici atogepantu.
Kazuistika ženy (nar. 1980)
Doktor Bajaček ilustroval problematiku kazuistikou pacientky, která má migrény od 13 let s aktuálním počtem 15 dnů s migrénou v měsíci. Anamnesticky dostávala profylaktickou léčbu (bez efektu a s nežádoucími účinky) cinarizinem, topiramátem, valproátem, amitryptilinem, venlafaxinem, pregabalinem, metoprololem, lamotriginem a následně jí byla aplikována anti‑CGRP monoklonální protilátka – taktéž bez efektu.
Diagnóza uzavřena jako chronická migréna a bylo žádáno, aby revizní lékař pojišťovny schválil atogepant. V listopadu 2024 dostává první dávku atogepantu a četnost migrén pozvolna klesá. V posledním měsíci měla jen dva dny s migrénou a sporadické bolesti hlavy; intenzita bolesti se snižuje o 50 % (na škále VAS).
Atogepant v klinické praxi: přehled nejnovějších publikací 2024/2025
Primářka MUDr. Jolana Marková, FEAN, z Neurologické kliniky 3. LF UK a Fakultní Thomayerovy nemocnice, Praha, uvedla: „Víme, že riziko migrény je vyšší u lidí s obezitou, což potvrzují i literární data.“ Epidemiologické studie ukázaly, že riziko migrény je u osob s obezitou zvýšeno o 27 procent [7]. Úbytek hmotnosti v důsledku chirurgických nebo nechirurgických výkonů může snížit frekvenci a závažnost migrény u pacientů s migrénou [8,9].
Zvýšené koncentrace CGRP jsou pozorovány jak u pacientů s migrénou, tak u obézních. CGRP se kromě jiného podílí na procesech souvisejících s chováním při příjmu potravy a s metabolickými funkcemi. „Atogepantem byli v klinických studiích léčeni pacienti s epizodickou i chronickou migrénou a u některých z nich byl – kromě příznivého terapeutického efektu na závažnost migrény – pozorován úbytek hmotnosti,“ upozornila primářka Marková na nečekaný účinek [10]. Vzhledem k tomu, že atogepant nemá schválenou indikaci léčba obezity, více na tomto místě neuvádíme.
Snášenlivost, bezpečnost a účinnost atogepantu proti topiramátu u dospělých účastníků s migrénou: výsledky studie TEMPLE
Doktor Tomáš Nežádal představil výsledky studie TEMPLE recentně publikované na Mezinárodním kongresu o bolestech hlavy (International Headache Congress 2025), který se konal uprostřed září v Sao Paulu. Na této studii se podílela i česká centra. Autoři porovnávali snášenlivost, bezpečnost a účinnost atogepantu a topiramátu u účastníků vyžadujících preventivní léčbu migrény [11].
Studie TEMPLE byla 24týdenní, randomizovaná, dvojitě zaslepená, dvojitě maskovaná, aktivně kontrolovaná studie s 52týdenním otevřeným prodloužením pro sledování bezpečnosti, jejímž cílem bylo vyhodnotit snášenlivost, bezpečnost a účinnost atogepantu 60 mg jednou denně ve srovnání s nejvyšší tolerovanou dávkou topiramátu (50, 75 nebo 100 mg/den) k preventivní léčbě migrény u účastníků s epizodickou nebo chronickou migrénou. Do studie byli zařazeni dospělí pacienti (18–80 let) s migrénou trvající minimálně rok před zařazením s frekvencí alespoň čtyři dny s migrénou v měsíci (MMD). Žádný z účastníků neměl zkušenosti s atogepantem ani s topiramátem. Průměrný věk účastníků byl 39,6 roku, v 88,7 procenta šlo o ženy, průměrný MMD činil 11,0 dnů. Zkušenost s preventivní léčbou migrény v anamnéze mělo 39,6 procenta probandů. Mezi pacienty s chronickou migrénou nebylo 71,7 procenta nikdy preventivně léčeno.
Primárním cílovým parametrem bylo ukončení léčby z důvodu nežádoucích účinků vzniklých v souvislosti s léčbou (treatment‑emergent adverse events, TEAEs) v populaci bez rizikových faktorů (atogepant: n = 273; topiramát: n = 267) během 24týdenního dvojitě zaslepeného období. Sekundární klinické cílové parametry se týkaly účinnosti a zahrnovaly podíl účastníků s ≥ 50% snížením průměrného počtu dnů migrény za měsíc (MMDs) a změnou průměrného MMD oproti výchozímu stavu v průběhu 4. až 6. měsíce ve dvojitě zaslepené fázi v populaci intent‑to‑treat (atogepant: n = 270; topiramát: n = 257).
Atogepant prokázal lepší snášenlivost ve srovnání s topiramátem s významně nižším počtem ukončení léčby v důsledku TEAEs (atogepant 12,1 %; topiramát 29,6 %; RR 0,41 [0,28–0,59]; p < 0,0001) během 24 týdnů. Vyšší podíl účastníků zaznamenal nežádoucí účinky u topiramátu ve srovnání s atogepantem (88,8 % vs. 76,9 %) a TEAEs při léčbě topiramátem ve srovnání s atogepantem (77,9 % vs. 56,0 %). U topiramátu byly nejčastějšími nežádoucími účinky parestezie, nevolnost, únava (možný nocebo efekt) a u atogepantu nevolnost, únava a snížená chuť k jídlu.
Atogepant prokázal lepší účinnost ve srovnání s topiramátem, přičemž významně vyšší podíl účastníků dosáhl ≥ 50% odpovědi (atogepant 64,1 %; topiramát 39,3 %; RR 1,63 [1,37–1,95]; p < 0,0001) a významného průměrného snížení MMD (atogepant –6,27; topiramát –4,49; RR –1,78 [–2,52 až –1,04]; p < 0,0001) v průběhu 4. až 6. měsíce.
Atogepant v dávce 60 mg jedenkrát denně prokázal lepší snášenlivost a účinnost ve srovnání s topiramátem. Atogepant byl obecně bezpečný a dobře snášen a nebyly identifikovány žádné nové bezpečnostní signály. Ještě bude zhodnocena otevřená fáze studie (s atogepantem).
Naplnilo se očekávání?
Další příspěvek byl věnován monocentrickým datům z Městské nemocnice Ostrava, přednesl jej primář jmenovaného zdravotnického zařízení MUDr. Lukáš Klečka.
„Kromě dat z naší nemocnice a teoretických informací o atogepantu bych se chtěl zabývat i otázkou, proč pacienti preferují atogepant a proč se pro něj rozhodujeme my. Současně bych rád uvedl, zda se naplnilo naše očekávání za rok od vstupu atogepantu do naší klinické praxe,“ uvedl svou prezentaci doktor Klečka. První pacient v Městské nemocnici Ostrava dostal atogepant 10. října 2024.
Je anti‑CGRP terapie volbou, nebo doporučením?
Na tuto otázku doktor Klečka odpověděl, že o způsobu léčby rozhoduje informovaný pacient. Záleží však i na možnostech pracoviště, zejména na prostorech k intravenózní aplikaci, dostupnosti místnosti pro edukaci, možnostech skladování a likvidace odpadu, což se vztahuje zejména k monoklonálním protilátkám.
Z klinických studií (ADVANCE a PROGRESS) je známo, že perorální atogepant podávaný jednou denně v dávce 60 mg byl účinný ve snižování počtu dnů s migrénou (HFEM a CM) a dnů s bolestí hlavy jak po dobu 12 týdnů [4,12], tak po dobu jednoho roku, kdy dochází u 48,8 procenta pacientů v posledním měsíci prvního roku léčby ke 100% odpovědi. Superrespondérů (snížení MMD alespoň o 75 %) bylo v posledním měsíci této studie 69,9 % [13]. „Atogepant volíme také u pacientů, kteří poměrně významně selhali na monoklonálních protilátkách, a tudíž nemůžeme čekat úplně stoprocentní redukci počtu dní s migrénou,“ komentoval studie doktor Klečka.
V časopise Headache byla recentně uveřejněna práce, která se zaměřila na preference způsobu aplikace anti‑CGRP terapie u pacientů s EM [14]. Odhady relativní důležitosti naznačují, že respondenti s EM (n = 300) v průměru preferovali perorální léčbu před měsíčními nebo čtvrtletními injekcemi a infuzemi. „Zajímavé je, že při rozhodování zde není na prvním místě bolest hlavy, ale nepřítomnost obtěžujících faktorů, především absence nevolnosti, potom způsob podání, až na třetím místě hraje roli účinnost léku,“ vysvětlil doktor Klečka. Podle jeho slov diskuse s pacientem o jeho preferenci významně zlepšuje adherenci. Snášenlivost je stejně důležitá jako samotná účinnost a lékař by měl realisticky zohlednit očekávání ohledně efektu a možných nežádoucích účinků. Limitací této studie je zařazení pouze pacientů s EM.
Atogepant má výhodné farmakokinetické vlastnosti: krátký eliminační poločas, což se jeví jako výhoda u komorbiditních pacientů s rizikem výskytu nežádoucích účinků (například lékových interakcí) nebo u žen, které vbrzku plánují graviditu. Další pozitivní vlastností je, že atogepant nevyžaduje titraci dávky [3].
První generace gepantů vykazovala jaterní toxicitu. „Nabídli jsme pacientům odběr krevního vzorku na vyšetření jaterních testů ve třetím a šestém měsíci. Další sledování jsme ukončili, protože jsme neprokázali elevaci transamináz. Pátráme jen anamnesticky, zda nemohlo dojít dříve k rozvoji hepatopatie,“ řekl doktor Klečka.
Sledování v Městské nemocnici Ostrava (MnO)
Byla provedena dvě sledování: u 24 pacientů, kteří byli v době hodnocení již určitou dobu léčeni, a u souboru pacientů s jakýmkoli kontaktem s atogepantem, včetně těch, kteří již léčbu ukončili, tedy celkem u 37 pacientů. Tomuto druhému souboru se následně doktor Klečka věnoval podrobněji. Celkem 92 procent tvoří ženy, nejpočetnější věkovou skupinu nemocní mezi 40–50 lety, nejčastějšími komorbiditami byly úzkost, deprese a panická porucha (29 %) a hypotyreóza (19 %).
Z úhradové vyhlášky vyplývá, že anti‑CGRP přípravky lze nasadit pacientům po selhání alespoň dvou jiných profylaktik. „Máme však switchované pacienty, kteří vyzkoušeli úplně všecko, včetně všech monoklonálních protilátek,“ upozornil doktor Klečka. U jedné pacientky došlo k selhání devíti typů profylaktické terapie (4 anti‑CGRP molekuly, 4 standardní profylaktika a studijní polypeptid aktivující pituitární adenylátcyklázu).
Počet sledovaných pacientů v souboru se zvyšuje, a s tím bude klesat i podíl switchovaných pacientů. V současnosti soubor tvoří 62 procent anti‑CGRP naivních vs. 38 procent převedených z jiné anti‑CGRP molekuly. Ve sledovaném souboru je pozorována redukce o ≥ 50 procent v MMD u 58 procent pacientů switchovaných na atogepant.
Data z registru ReMig, která v roce 2024 prezentoval MUDr. Tomáš Nežádal na European Headache Congress v Nizozemsku, svědčí o tom, že switch mezi jednotlivými anti‑CGRP monoklonálními protilátkami je účinný ve třetím měsíci v 70 procentech u nedostatečné účinnosti předchozí léčby a ve 40 procentech u nežádoucích účinků. „Myslím, že brzy budeme moci podobné statistické údaje potvrdit i u atogepantu,“ vyhodnotil přednášející.
Minimum pacientů sledovaného souboru v MnO mělo na vstupu epizodickou nefrekventní migrénu (4–7 MMD), většina pacientů (95 %) měla HFEM (8–14 MMD) nebo CM (≥ 15 MMD), často i s MOH. I u těchto pacientů s těžkou disabilitou dochází k výborné redukci MMD. Ke 100% redukci MMD za tři měsíce došlo u 13,5 procenta a dalších pět pacientů má tři MMD za tři měsíce. K redukci MMD o 75–100 procent došlo u 40 procent pacientů.
Pacienti bez efektu léčby s účinností pod 50 procent po třech měsících léčby: jeden z pacientů, kteří měli 30% redukci, byl pozdní respondér s 50% odpovědí po šesti měsících (po schválení revizním lékařem lze prodloužit léčbu na 6 měsíců). Jedna pacientka měla třicetiprocentní redukci, ale u ní došlo k selhání na veškeré terapii, takže má zaveden stimulátor okcipitálního nervu, kombinaci psychiatrické medikace, a dokonce možná přechází ke cluster headache. Tři pacienti byli zcela bez efektu, u jednoho došlo k agravaci migrény. Teoreticky se nabízí, že jde o non‑adherenci k léčbě. Dva z těchto pacientů byli po vícenásobném switchi.
Téměř tři čtvrtiny pacientů pokračují v léčbě. K ukončení léčby bylo přistoupeno osmkrát: jedna pacientka se nedostavila na kontrolu, jedna pacientka ukončila léčbu pro významné zhoršení psychiky při dobrém efektu na migrénu. Pro neefektivitu byl atogepant vysazen třikrát a třikrát pro nežádoucí účinky.
Účinnost atogepantu ilustroval doktor Klečka dvěma kazuistikami. Muž (nar. 1991) po selhání dvou antiepileptik dostal jako jeden z prvních pacientů v říjnu 2024 atogepant, který se ukázal jako účinný s malým výkyvem v době virózy. Druhá kazuistika představuje ženu (nar. 1995) s anamnézou migrény od 16 let. Profylakticky užívala topiramát a cinarizin. V únoru 2024 nasazen eptinezumab s dobrým počátečním, ale pouze dočasným efektem. Po jeho vysazení dochází k významnému zhoršení. Po třech měsících dostává atogepant (květen 2025) a pacientka je nyní naprosto bez migrén.
Závěr: atogepant naplnil očekávání
Data reálné praxe MnO potvrzují závěry klinických studií o vysoké účinnosti atogepantu, který navíc vykazuje vysokou adherenci. Bezpečnostní profil je v souladu s klinickými studiemi. Pacienti preferují perorální terapii před injekcemi a infuzemi. Účinnost je pozorována i u pacientů, kteří přešli na atogepant z jiné profylaktické léčby, a to včetně monoklonálních protilátek. Léčba je komfortní jak pro pacienta, tak pro lékaře. „Atogepant zcela naplnil naše očekávání,“ uzavřel doktor Klečka.
Hmotnost, fertilita, kojení
Další přednášející, MUDr. Andrea Bártková, Ph.D., Neurologická klinika FN Olomouc a brněnská Centra pro léčbu bolestí hlavy, se na základě publikovaných studií zabývala léčbou migrény atogepantem u pacientů s obezitou a jeho bezpečností u kojících žen.
V éře epidemie obezity je nutné zvažovat toto onemocnění jako závažnou komorbiditu nejen kardiovaskulárních a metabolických onemocnění, ale i migrény. Epidemiologické studie ukázaly, že riziko migrény je u osob s obezitou zvýšeno o 27 procent [7,10]. „Měli bychom se zaměřit nejen na léčbu migrény, ale brát toto onemocnění komplexně, a tedy zvážit, jaké máme možnosti k ovlivnění obezity,“ řekla doktorka Bártková.
Základní výzkum naznačuje, že CGRP je velmi důležitou molekulou, která se účastní procesů jak při bolesti hlavy, tak u obezity. Tuková tkáň exprimuje nejen CGRP, ale také značné množství dalších prozánětlivých cytokinů. Například leptin je spojován se zvýšeným uvolňováním TNFα nebo IL‑6 a jimi vyvolaný chronický zánět přispívá k bolesti. Blokádou CGRP lze pravděpodobně ovlivnit i obezitu. U atogepantu bylo pozorováno v některých studiích u pacientů s EM i CM [4,12, 13,16] mírné snížení hmotnosti (zhruba o 7 %). Ve všech citovaných studiích atogepant vedl k statisticky významnému snížení MMD u EM i CM [4,12, 13,16,17]. „Atogepant v dávce 60 mg denně začíná působit velmi brzy, již ve druhém týdnu byly oproti placebu patrné rozdíly v počtu dnů s migrénou či bolestí hlavy,“ komentovala doktorka Bártková. Ke snížení hmotnosti zřejmě vede poměrně častý nežádoucí účinek – snížená chuť k jídlu.
Dále se doktorka Bártková věnovala problematice žen ve fertilním věku, gravidním a kojícím. Podle SPC přípravku Aquipta nejsou dostatečná data prokazující jak bezpečnost, tak toxicitu u těhotných [3].
Od května 2025 je v SPC přípravku Aquipta zahrnuto bezpečnostní hledisko u kojících žen ve smyslu přestupu atogepantu do mateřského mléka. Ve studii fáze I s 12 zdravými kojícími ženami, kterým byla podána jednorázová perorální dávka atogepantu 60 mg mezi 1. a 6. měsícem po porodu, bylo vrcholových koncentrací atogepantu v mateřském mléce dosaženo 1 až 3 hodiny po podání. Cmax a AUC atogepantu v mateřském mléce byly významně nižší – přibližně o 93 procent ve srovnání s plazmatickou koncentrací žen. Průměrná relativní dávka pro kojence byla přibližně 0,19 procenta (rozmezí 0,06 až 0,33 %) dávky upravené podle hmotnosti matky s průměrným poměrem mléka k plazmě 0,08 (0,02 až 0,10). Kumulativní množství atogepantu vyloučeného do mateřského mléka během 24 hodin bylo minimální, méně než 0,01 mg [3].
Závěr
Podle všech prezentací je atogepant účinný léčivý přípravek, který efektivně snižuje MMD, s dobrým bezpečnostním profilem. Atogepant v roční klinické praxi tak naplnil počáteční očekávání.
Literatura
[1] GBD 2023 Headache Collaborators. Global, regional, and national burden of headache disorders, 1990–2023: a systematic analysis for the Global Burden of Disease Study 2023. Lancet Neurol. 2025;24(12):1005–1015. [2] Barbanti P, Egeo G, Pistoia F, et al.; Italian Migraine Registry (I‑GRAINE) study group. GIANT: a prospective, multicenter, real‑world study on the effectiveness, safety, and tolerability of atogepant in migraine patients with multiple therapeutic failures. J Headache Pain. 2025;26(1):122. [3] SPC Aquipta. [online]. Dostupné z: https://ec.europa.eu/health/documents/community‑register/2023/20230811159911/anx_159911_cs.pdf. [cit. 2025‑12‑01]. [4] Pozo‑Rosich P, Ailani J, Ashina M, et al. Atogepant for the preventive treatment of chronic migraine (PROGRESS): a randomised, double‑blind, placebo‑controlled, phase 3 trial. Lancet. 2023;402(10404):775–785. [5] Min KC, Kraft WK, Bondiskey P, et al. Atogepant Is Not Associated With Clinically Meaningful Alanine Aminotransferase Elevations in Healthy Adults. Clin Transl Sci. 2021;14(2):599–605. [6] Romozzi M, García‑Azorín D, Rubio‑Beltran E, et al. Generative chatbots in headache education and research: A narrative review. Cephalalgia. 2025;45(9):3331024251372117. [7] Gelaye B, Sacco S, Brown WJ, et al. Body composition status and the risk of migraine: A meta‑analysis. Neurology. 2017;88(19):1795–1804. [8] Bond DS, Vithiananthan S, Nash JM, et al. Improvement of migraine headaches in severely obese patients after bariatric surgery. Neurology. 2011;76(13):1135–1138. [9] Bond DS, Thomas JG, Lipton RB, et al. Behavioral Weight Loss Intervention for Migraine: A Randomized Controlled Trial. Obesity (Silver Spring). 2018;26(1):81–87. [10] Peterlin BL, Bond DS, Ailani J, et al. Weight loss with atogepant during the preventive treatment of migraine: A pooled analysis. Cephalalgia. 2024;44(12):3331024241299753. [11] Reuter U, Van Dycke A, Tepper SJ, et al. Tolerability, Safety, and Efficacy of Atogepant Versus Topiramate in Participants Requiring Preventive Treatment for Migraine: Results From the Head‑To‑Head TEMPLE Trial. IHC, 2025. [12] Ailani J, Lipton RB, Goadsby PJ, et al.; ADVANCE Study Group. Atogepant for the Preventive Treatment of Migraine. N Engl J Med. 2021;385(8):695–706. [13] Ashina M, Tepper SJ, Reuter U, et al. Once‑daily oral atogepant for the long‑term preventive treatment of migraine: Findings from a multicenter, randomized, open‑label, phase 3 trial. Headache. 2023;63(1):79–88. [14] Lipton RB, Gandhi P, Myers K, et al. Patient preferences for the preventive treatment of episodic migraine in the United States: A discrete‑choice experiment. Headache. 2025;65(9):1541–1553. [15] Gelaye B, Sacco S, Brown WJ, et al. Body composition status and the risk of migraine: A meta‑analysis. Neurology. 2017;88(19):1795–1804. [16] Klein BC, Miceli R, Severt L, et al. Safety and tolerability results of atogepant for the preventive treatment of episodic migraine from a 40‑week, open‑label multicenter extension of the phase 3 ADVANCE trial. Cephalalgia. 2023;43(1):3331024221128250. [17] Goadsby PJ, Dodick DW, Ailani J, et al. Safety, tolerability, and efficacy of orally administered atogepant for the prevention of episodic migraine in adults: a double‑blind, randomised phase 2b/3 trial. Lancet Neurol. 2020;19(9):727–737.