Semaglutid mění pravidla hry
Jsou nějaké rozdíly mezi liraglutidem a semaglutidem při léčbě obezity a nadváhy u pacientů bez diabetu?
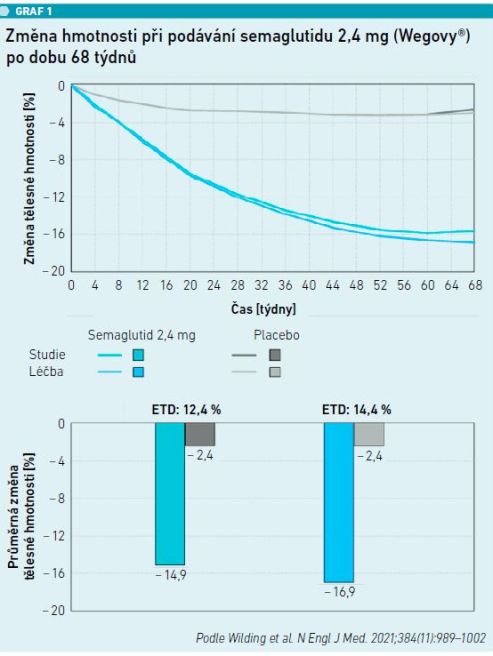 Na český trh v těchto dnech přichází nové injekční antiobezitikum semaglutid – Wegovy®. Jedná se o dalšího agonistu GLP‑1 receptorů, tentokrát s prodlouženou eliminací, tedy s podáváním jednou týdně subkutánně. Je určen k léčbě obezity, a to i u pacientů bez diabetu (na rozdíl od staršího přípravku semaglutid 0,25/0,5/1,0 mg – Ozempic®, který je určen k terapii diabetu). Přípravek se podává injekčně subkutánně jednou týdně v předplněném peru. Poločas rozpadu semaglutidu je 165 hodin, což je výsledkem náhrady aminokyselin (zabraňující degradaci dipeptidylpeptidázou 4) a přidání C18 mastné kyseliny. Počáteční dávka je 0,25 mg, která se po čtyřech týdnech zvyšuje na 0,5 mg, resp. na 1 mg jednou týdně a dále přes dávku 1,7 mg na 2,4 mg jednou týdně s.c. Klinické studie pro použití semaglutidu v léčbě obezity (program klinických studií STEP) přinesly přesvědčivé výsledky [1,2]. Dosažená redukce oproti placebu byla 14,9 vs. 2,9 procenta. Navíc došlo k signifikantnímu zlepšení kardiometabolických rizik. Použitá dávka semaglutidu byla 1,0 a 2,4 mg při aplikaci jednou týdně s.c. Obdobný pokles byl potvrzen i ve studii autorů Wilding et al. [3] (viz graf 1). Po semaglutidu došlo k redukci tělesné hmotnosti o 14,9 procenta, při aplikaci placeba to bylo 2,4 procenta. Semaglutid působil účinněji než liraglutid, uplatnil se příznivě i po bariatrických výkonech jako prevence relapsu hmotnostního vzestupu [4]. Semaglutid byl zkoušen i u pacientů od 12 let s obezitou [5], kdy na dávce 2,4 mg 1× týdně zredukovali tito pacienti hmotnost o 16,1 procenta vs. 0,6 procenta na placebu.
Na český trh v těchto dnech přichází nové injekční antiobezitikum semaglutid – Wegovy®. Jedná se o dalšího agonistu GLP‑1 receptorů, tentokrát s prodlouženou eliminací, tedy s podáváním jednou týdně subkutánně. Je určen k léčbě obezity, a to i u pacientů bez diabetu (na rozdíl od staršího přípravku semaglutid 0,25/0,5/1,0 mg – Ozempic®, který je určen k terapii diabetu). Přípravek se podává injekčně subkutánně jednou týdně v předplněném peru. Poločas rozpadu semaglutidu je 165 hodin, což je výsledkem náhrady aminokyselin (zabraňující degradaci dipeptidylpeptidázou 4) a přidání C18 mastné kyseliny. Počáteční dávka je 0,25 mg, která se po čtyřech týdnech zvyšuje na 0,5 mg, resp. na 1 mg jednou týdně a dále přes dávku 1,7 mg na 2,4 mg jednou týdně s.c. Klinické studie pro použití semaglutidu v léčbě obezity (program klinických studií STEP) přinesly přesvědčivé výsledky [1,2]. Dosažená redukce oproti placebu byla 14,9 vs. 2,9 procenta. Navíc došlo k signifikantnímu zlepšení kardiometabolických rizik. Použitá dávka semaglutidu byla 1,0 a 2,4 mg při aplikaci jednou týdně s.c. Obdobný pokles byl potvrzen i ve studii autorů Wilding et al. [3] (viz graf 1). Po semaglutidu došlo k redukci tělesné hmotnosti o 14,9 procenta, při aplikaci placeba to bylo 2,4 procenta. Semaglutid působil účinněji než liraglutid, uplatnil se příznivě i po bariatrických výkonech jako prevence relapsu hmotnostního vzestupu [4]. Semaglutid byl zkoušen i u pacientů od 12 let s obezitou [5], kdy na dávce 2,4 mg 1× týdně zredukovali tito pacienti hmotnost o 16,1 procenta vs. 0,6 procenta na placebu.
Studie STEP 8
Studie STEP 8 [6] přímo porovnávala semaglutid 2,4 mg (Wegovy®) podávaný subkutánně jednou týdně oproti liraglutidu 3,0 mg (Saxenda®) podávanému jednou denně pro regulaci hmotnosti u dospělých s nadváhou nebo obezitou. Jednalo se o randomizovanou, otevřenou, 68týdenní studii fáze 3b, provedenou v 19 amerických centrech od září 2019 do května 2021. Zahrnuto bylo 338 dospělých s BMI ≥ 30 kg/m2 nebo s BMI ≥ 27 kg/m2 a s alespoň jednou komorbiditou související s hmotností, bez diabetu. Účastníci byli randomizováni (3 : 1 : 3 : 1) tak, aby dostávali jednou týdně subkutánně podávaný semaglutid 2,4 mg (16týdenní eskalace; n = 126) nebo placebo, nebo jednou denně subkutánně podávaný liraglutid 3,0 mg (4týdenní eskalace; n = 127) nebo placebo. Všichni účastníci byli edukováni o nutnosti dodržovat dietní plán a fyzickou aktivitu. Účastníci, kteří nebyli schopni tolerovat 2,4 mg semaglutidu, mohli dostat 1,7 mg.
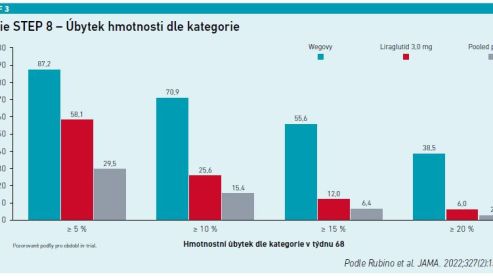
Primárním cílem byla procentuální změna hmotnosti, porovnávalo se dosažení úbytku 10 procent hmotnosti nebo více, 15% úbytek hmotnosti nebo více a 20% úbytek hmotnosti a více. Srovnání semaglutidu a liraglutidu bylo otevřené, ale proti odpovídajícím placebo skupinám bylo dvojitě zaslepené. Sekundárním cílovým parametrem bylo srovnání obou skupin s placebem. Dále byly sledovány vlivy metabolické.
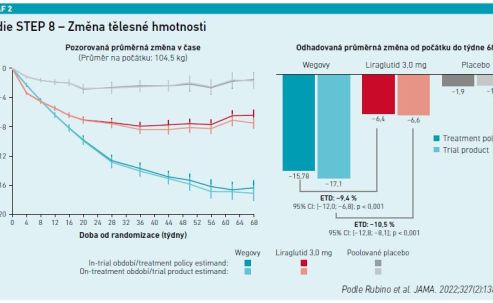 U 338 randomizovaných účastníků (průměrný věk 49 let; 265 žen [78,4 %]; průměrná tělesná hmotnost 104,5 kg; průměrný BMI 37,5 kg/m2) došlo po 68 týdnech léčby ke změně hmotnosti oproti výchozí hodnotě –15,8 procenta u semaglutidu (n = 126) a –6,4 procenta u liraglutidu (n = 127), P < 0,001; změna hmotnosti za použití placeba (n = 85) byla –1,9 procenta (viz graf 2). Účastníci měli výrazně vyšší pravděpodobnost dosažení úbytku hmotnosti 10 % nebo více, 15 % nebo více a 20 % nebo více se semaglutidem než s liraglutidem (viz graf 3). Navíc se ukázalo, že semaglutid významněji snížil v 68. týdnu obvod pasu, celkovou koncentraci cholesterolu, koncentraci LDL cholesterolu, koncentraci triglyceridů, úroveň HbA1c, koncentraci glukózy v plazmě nalačno i koncentraci C‑reaktivního proteinu. Semaglutid měl silnější pozitivní vliv na změnu hodnot diastolického krevního tlaku než liraglutid.
U 338 randomizovaných účastníků (průměrný věk 49 let; 265 žen [78,4 %]; průměrná tělesná hmotnost 104,5 kg; průměrný BMI 37,5 kg/m2) došlo po 68 týdnech léčby ke změně hmotnosti oproti výchozí hodnotě –15,8 procenta u semaglutidu (n = 126) a –6,4 procenta u liraglutidu (n = 127), P < 0,001; změna hmotnosti za použití placeba (n = 85) byla –1,9 procenta (viz graf 2). Účastníci měli výrazně vyšší pravděpodobnost dosažení úbytku hmotnosti 10 % nebo více, 15 % nebo více a 20 % nebo více se semaglutidem než s liraglutidem (viz graf 3). Navíc se ukázalo, že semaglutid významněji snížil v 68. týdnu obvod pasu, celkovou koncentraci cholesterolu, koncentraci LDL cholesterolu, koncentraci triglyceridů, úroveň HbA1c, koncentraci glukózy v plazmě nalačno i koncentraci C‑reaktivního proteinu. Semaglutid měl silnější pozitivní vliv na změnu hodnot diastolického krevního tlaku než liraglutid.
 Podíl účastníků, kteří přerušili léčbu z jakéhokoli důvodu, byl 13,5 procenta se semaglutidem a 27,6 procenta s liraglutidem. Nežádoucí účinky hlásilo 95,2 procenta účastníků se semaglutidem, 96,1 procenta s liraglutidem a 95,3 procenta s placebem (gastrointestinální nežádoucí účinky byly hlášeny v 84,1 % se semaglutidem, v 82,7 % s liraglutidem a v 55,3 % s placebem a byly mírného charakteru). Závažné nežádoucí účinky nahlásilo 7,9 procenta pacientů se semaglutidem, 11,0 procenta s liraglutidem a 7,1 procenta s placebem. Trvalé přerušení léčby pro tyto nežádoucí účinky bylo častější u liraglutidu (12,6 %) proti semaglutidu (3,2 %) a placebu (3,5 %).
Podíl účastníků, kteří přerušili léčbu z jakéhokoli důvodu, byl 13,5 procenta se semaglutidem a 27,6 procenta s liraglutidem. Nežádoucí účinky hlásilo 95,2 procenta účastníků se semaglutidem, 96,1 procenta s liraglutidem a 95,3 procenta s placebem (gastrointestinální nežádoucí účinky byly hlášeny v 84,1 % se semaglutidem, v 82,7 % s liraglutidem a v 55,3 % s placebem a byly mírného charakteru). Závažné nežádoucí účinky nahlásilo 7,9 procenta pacientů se semaglutidem, 11,0 procenta s liraglutidem a 7,1 procenta s placebem. Trvalé přerušení léčby pro tyto nežádoucí účinky bylo častější u liraglutidu (12,6 %) proti semaglutidu (3,2 %) a placebu (3,5 %).
Diskuse
Z uvedeného vyplývá, že semaglutid podávaný jednou týdně s.c. pro léčbu obezity u nediabetiků se jeví jako účinnější než liraglutid podávaný injekčně denně. Semaglutid je velmi dobře snášen a má vliv na mnoho metabolických parametrů, a tím na celkové kardiovaskulární zdraví [7]. Zároveň se jedná o lék velmi bezpečný. Výhodou liraglutidu může být krátký poločas rozpadu (13 hodin), což může být výhodné při rychlém odeznění případných nežádoucích účinků a můžeme si dovolit pružněji reagovat zpomalenou titrací. Kratší poločas je výhodnější i pro předoperační vysazení liraglutidu, resp. u ukončení podávání v prekoncepční péči apod. Zároveň liraglutid umožňuje flexibilní podávání ráno, odpoledne či večer, a respektovat tak individualitu pacienta. V neposlední řadě máme možnost oba tyto léky podávat adolescentům.
Závěr
Zcela jistě má lékař v rukou dva velmi potentní léky s prověřeným bezpečnostním profilem. Wegovy® otevírá nový horizont v léčbě nadváhy a obezity. Vzhledem k velmi komfortnímu podání jedenkrát týdně předpokládáme vyšší compliance k léčbě. Aplikační pero je velmi sofistikované a přináší další výhodu při užívání. Pacienti navíc mohou obdržet při začátku aplikace startovací sadu s vysoce kvalitními materiály, které mohou zodpovědět pacientovi mnohé otázky a rozptýlit počáteční nejistotu. Wegovy® přináší další možnost individualizace léčby nadváhy a obezity podle potřeb každého pacienta.
MUDr. Dita Pichlerová, Ph.D.,
Interní klinika 2. LF UK a FN Motol, Praha
Sponzorované sdělení
Literatura
- Kushner RF, Calanna S, Davies M, et al. Semaglutide 2.4 mg for the Treatment of Obesity: Key Elements of the STEP Trials 1 to 5. Obesity (Silver Spring). 2020;28(6): 1050–1061.
- Singh G, Krauthamer M, Bjalme‑Evans M. Wegovy (semaglutide): a new weight loss drug for chronic weight management. J Investig Med. 2022;70(1):5–13.
- Wilding JPH, Batterham RL, Calanna S, et al.; STEP 1 Study Group. Once‑Weekly Semaglutide in Adults with Overweight or Obesity. N Engl J Med. 2021;384(11): 989–1002.
- Murvelashvili N, Xie L, Schellinger JN, et al. Effectiveness of semaglutide versus liraglutide for treating post‑metabolic and bariatric surgery weight recurrence. Obesity (Silver Spring). 2023;31(5):1280–1289.
- Weghuber D, Barrett T, Barrientos‑Pérez M, et al.; STEP TEENS Investigators. Once‑Weekly Semaglutide in Adolescents with Obesity. N Engl J Med. 2022;387(24): 2245–2257.
- Rubino DM, Greenway FL, Khalid U, et al.; STEP 8 Investigators. Effect of Weekly Subcutaneous Semaglutide vs Daily Liraglutide on Body Weight in Adults With Overweight or Obesity Without Diabetes: The STEP 8 Randomized Clinical Trial. JAMA. 2022;327(2):138–150.
- Lincoff AM, Brown‑Frandsen K, Colhoun HM, et al.; SELECT Trial Investigators. Semaglutide and Cardiovascular Outcomes in Obesity without Diabetes. N Engl J Med. 2023;389(24):2221–2232.
Zkrácená informace o léčivém přípravku Wegovy® 0,25 mg, 0,5 mg, 1 mg, 1,7 mg, 2,4 mg FlexTouch® injekční roztok v předplněném peru
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz SPC, bod 4.8.
Složení: pero Wegovy® 0,25 mg obsahuje 1,0 mg semaglutidu v 1,5 ml roztoku. 1 ml obsahuje 0,68 mg semaglutidu. Jedno předplněné pero obsahuje 4 dávky po 0,25 mg. Wegovy® 0,5 mg obsahuje 2,0 mg semaglutidu v 1,5 ml roztoku. 1 ml obsahuje 1,34 mg semaglutidu. Jedno předplněné pero obsahuje 4 dávky po 0,5 mg. Wegovy® 1,0 mg obsahuje 4,0 mg semaglutidu ve 3 ml roztoku. 1 ml obsahuje 1,34 mg semaglutidu. Jedno předplněné pero obsahuje 4 dávky po 1 mg. Wegovy® 1,7 mg obsahuje 6,8 mg semaglutidu ve 3 ml roztoku. 1 ml obsahuje 2,27 mg semaglutidu. Jedno předplněné pero obsahuje 4 dávky po 1,7 mg. Wegovy® 2,4 mg obsahuje 9,6 mg semaglutidu ve 3 ml roztoku. 1 ml obsahuje 3,2 mg semaglutidu. Jedno předplněné pero obsahuje 4 dávky po 2,4 mg. Indikace: Dospělí: doplňková léčba k dietě se sníženým obsahem kalorií a zvýšené fyzické aktivitě k úpravě tělesné hmotnosti, včetně úbytku a udržování těl. hmotnosti u dospělých s počátečním BMI ≥30 kg/m2 (obezita) nebo ≥27 kg/m2 až <30 kg/m2 (nadváha) za přítomnosti alespoň jedné komorbidity související s hmotností. Výsledky studií týkající se snížení kardiovaskulárního rizika, srdečního selhání souvisejícího s obezitou a studované populace viz SPC, bod 5.1. Dospívající: doplňková léčba k dietě se sníženým obsahem kalorií a zvýšené fyzické aktivitě za účelem úpravy tělesné hmotnosti u dospívajících ve věku od 12 let s: obezitou a tělesnou hmotností nad 60 kg. Léčba má být přerušena a přehodnocena, pokud se u dospívajících pacientů po 12 týdnech léčby dávkou 2,4 mg nebo maximální tolerovanou dávkou nesníží BMI alespoň o 5 %. Dávkování a způsob podání: Dospělí: udržovací dávky semaglutidu 2,4 mg jednou týdně se dosahuje zahájením dávkou 0,25 mg. Aby se snížila pravděpodobnost GI příznaků, má být dávka po 16týdenním období zvýšena na udržovací dávku 2,4 mg jednou týdně. Dospívající: U dospívajících ve věku od 12 let je třeba použít stejný postup navyšování dávky jako u dospělých. Dávka má být zvyšována až do dosažení 2,4 mg (udržovací dávka) nebo do dosažení maximální tolerované dávky. Týdenní dávky převyšující 2,4 mg se nedoporučují. Při zahájení léčby u pacientů s diabetem 2. typu zvažte snížení dávky souběžně podávaného inzulinu nebo inzulinových sekretagog, aby se snížilo riziko hypoglykemie. Dojde‑li k opomenutí dávky, je třeba ji podat co nejdříve, a to do 5 dnů po vynechání dávky. Subkutánní podání. Wegovy® se podává jednou týdně v kteroukoli denní dobu, s jídlem nebo bez jídla. Wegovy® se aplikuje subkutánní injekcí do břicha, stehna nebo horní části paže. Místo vpichu lze změnit. Nesmí se podávat intravenózně ani intramuskulárně. Zvláštní skupiny pacientů: z důvodu věku není nutná žádná úprava dávkování. Terapeutické zkušenosti u pacientů ve věku ≥ 85 let jsou omezené. Porucha funkce ledvin: u pacientů s lehkou či středně těžkou poruchou funkce ledvin není nutná žádná úprava dávkování. Zkušenosti s podáváním semaglutidu pacientům s těžkou poruchou funkce ledvin jsou omezené. Nedoporučuje se používat u pacientů s těžkou poruchou funkce ledvin. Porucha funkce jater: u pacientů s lehkou či středně těžkou poruchou funkce jater není doporučená žádná úprava dávkování. Zkušenosti s podáváním semaglutidu pacientům s těžkou poruchou funkce jater jsou omezené. Nedoporučuje se používat u pacientů s těžkou poruchou funkce jater a u pacientů s lehkou nebo středně těžkou poruchou funkce jater má být používán s opatrností. Pediatrická populace: bezpečnost a účinnost semaglutidu u dětí a dospívajících ve věku do 12 let nebyla dosud stanovena. Kontraindikace: hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku. Zvláštní upozornění: *u pacientů, kterým byli podáváni agonisté receptoru GLP‑1 a kteří podstoupili celkovou anestezii nebo hlubokou sedaci, byly hlášeny případy plicní aspirace. Před provedením zákroků s celkovou anestezií nebo hlubokou sedací je proto zapotřebí zvážit zvýšené riziko reziduálního obsahu žaludku v důsledku opožděného vyprazdňování žaludku. Použití agonistů GLP‑1 může být spojeno s GI nežádoucími účinky, které mohou způsobit dehydrataci, což může ve vzácných případech vést ke zhoršení funkce ledvin. Při použití agonistů receptoru GLP‑1 byla pozorována akutní pankreatitida. Je‑li podezření na pankreatitidu, je třeba semaglutid vysadit; pokud se pankreatitida potvrdí, nesmí být léčba semaglutidem znovu zahájena. Semaglutid se nemá používat jako náhrada za inzulin u pacientů s diabetem 2. typu. Pacienti léčení semaglutidem v kombinaci s deriváty sulfonylurey nebo inzulinem mohou mít zvýšené riziko hypoglykemie. U pacientů s diabetickou retinopatií léčených semaglutidem bylo pozorováno zvýšené riziko rozvoje komplikací diabetické retinopatie. Pacienty s diabetickou retinopatií je třeba pečlivě monitorovat. Významné interakce: semaglutid zpožďuje vyprazdňování žaludku a mohl by potenciálně ovlivnit absorpci současně podávaných perorálních léčivých přípravků. Semaglutid se musí používat s opatrností u pacientů, kteří dostávají perorální léčivé přípravky vyžadující rychlou GI absorpci. *Při současném užívání acenokumarolu a semaglutidu byly hlášeny případy snížení INR. Více viz SPC. Těhotenství a kojení: semaglutid se nesmí v těhotenství používat. Pokud si pacientka přeje otěhotnět nebo otěhotní, léčba se musí přerušit. Nežádoucí účinky: velmi časté: bolest hlavy, GI poruchy, únava; časté: hypoglykemie, závrať, diabetická retinopatie, cholelitiáza, vypadávání vlasů, *dysgeuzie, *dysestezie; méně časté: zvýšená tepová frekvence, akutní pankreatitida, opožděné vyprazdňování žaludku; není známo: *intestinální obstrukce. Více viz SPC. Předávkování: může být spojeno s GI poruchami, které mohou vést k dehydrataci. Balení: FlexTouch® 0,25 mg, 0,5 mg: 1,5ml skleněná zásobní vložka (FlexTouch® 1 mg, 1,7 mg, 2,4 mg: 3ml skleněná zásobní vložka) na jednom konci uzavřená pryžovým pístem a na druhém konci hliníkovým víčkem s laminovaným pryžovým uzávěrem. Zásobní vložka se vkládá do jednorázového předplněného pera. 1 předplněné pero a 4 jednorázové jehly NovoFine® Plus. Doba použitelnosti: Před použitím: 3 roky. Po prvním použití: 6 týdnů. Uchovávejte při teplotě do 30 °C nebo v chladničce (2 ºC až 8 ºC). Uchovávání: uchovávejte v chladničce (2 ºC – 8 ºC). Neuchovávejte v blízkosti chladicího zařízení. Chraňte před mrazem. Pokud pero nepoužíváte, ponechte na něm uzávěr, aby bylo chráněno před světlem. Způsob výdeje: výdej vázán na lékařský předpis. Způsob hrazení: přípravek není hrazen z prostředků veřejného zdravotního pojištění. Datum schválení: 6. ledna 2022. Datum revize textu: 10/2024. Držitel rozhodnutí o registraci: Novo Nordisk A/S, Novo Allé, DK‑2880 Bagsvaerd, Dánsko. Reg. číslo: EU/1/21/1608/006‑010. Další informaci získáte z SPC, příbalové informace nebo na adrese firmy Novo Nordisk: Novo Nordisk s.r.o., Karolinská 706/3, 186 00, Praha 8 – Karlín. * Všimněte si prosím změny v informacích o léčivém přípravku