Sideropenická anémie
Anémie z nedostatku železa představuje nejčastější typ chudokrevnosti a v celosvětovém měřítku se jedná o nejčastější onemocnění vůbec. Je definována jako pokles hodnoty hemoglobinu nebo hematokritu v jednom litru periferní krve pod fyziologickou mez. Klinické projevy jsou vyjádřeny většinou při hlubším nedostatku železa a zahrnují možné projevy anemického syndromu a nehematologické projevy deficitu, zvláště poruchy epiteliálních struktur. Podle Světové zdravotnické organizace (WHO) tento typ chudokrevnosti postihuje více než 30 % světové populace, v České republice se prevalence odhaduje na 20 %. Nejvíce zasaženy jsou ženy v reprodukčním věku, těhotné ženy, starší osoby a v rozvojových zemích také děti ve věku do pěti let.
Železo v organismu
 Železo (Fe) představuje základní mikronutrient našeho organismu. Nedostatek prvku Fe narušuje funkci mnoha systémů v těle. Ze stravy přijímáme železo hemové (dvojmocné), které je biologicky dostupnější (vstřebá se 15–30 %), a železo nehemové (trojmocné) s nižší biologickou dostupností (vstřebají se 2–10 %). Doporučený denní příjem železa činí 10–20 mg. Nároky organismu jsou však odlišné napříč věkem, pohlavím, zdravotním stavem, dietními omezeními či výživovými směry. Denně se vstřebává pouze 10 % přijatého železa (1–2 mg). K jeho absorpci dochází v duodenální a částečně v jejunální části tenkého střeva na apikální straně enterocytu. Hemové železo je do enterocytu přenášeno specifickým hemovým přenašečovým proteinem (HCP). Železo nehemové (trojmocné) však musí být nejprve redukováno pomocí duodenálního cytochromu B (Dcytb), a až poté se do buňky vstřebává transportérem pro bivalentní kovy (DMT1). Tento transportér je však nespecifický, procházejí tudy i jiné dvojmocné kationty. Vstřebávání této formy železa je proto velmi omezené. Na intracelulární úrovni je železo vyštěpeno na volné dvojmocné železo. Takto může setrvávat uvnitř buňky ve formě feritinu anebo se dostává transportním systémem feroportinu do krve. Zde je pomocí hefestinu oxidováno zpět na trojmocnou formu, navázáno na transferin a následně přenášeno do cílových tkání. Tento mechanismus je regulován hepcidinem. Jedná se o peptidový hormon syntetizovaný v játrech, který interaguje s feroportinem. Pokud se hepcidin na tento transmembránový exportní protein naváže, dojde k inhibici uvolňování železa z buněk. Přehled klíčových proteinů v metabolismu železa shrnuje tabulka 1.
Železo (Fe) představuje základní mikronutrient našeho organismu. Nedostatek prvku Fe narušuje funkci mnoha systémů v těle. Ze stravy přijímáme železo hemové (dvojmocné), které je biologicky dostupnější (vstřebá se 15–30 %), a železo nehemové (trojmocné) s nižší biologickou dostupností (vstřebají se 2–10 %). Doporučený denní příjem železa činí 10–20 mg. Nároky organismu jsou však odlišné napříč věkem, pohlavím, zdravotním stavem, dietními omezeními či výživovými směry. Denně se vstřebává pouze 10 % přijatého železa (1–2 mg). K jeho absorpci dochází v duodenální a částečně v jejunální části tenkého střeva na apikální straně enterocytu. Hemové železo je do enterocytu přenášeno specifickým hemovým přenašečovým proteinem (HCP). Železo nehemové (trojmocné) však musí být nejprve redukováno pomocí duodenálního cytochromu B (Dcytb), a až poté se do buňky vstřebává transportérem pro bivalentní kovy (DMT1). Tento transportér je však nespecifický, procházejí tudy i jiné dvojmocné kationty. Vstřebávání této formy železa je proto velmi omezené. Na intracelulární úrovni je železo vyštěpeno na volné dvojmocné železo. Takto může setrvávat uvnitř buňky ve formě feritinu anebo se dostává transportním systémem feroportinu do krve. Zde je pomocí hefestinu oxidováno zpět na trojmocnou formu, navázáno na transferin a následně přenášeno do cílových tkání. Tento mechanismus je regulován hepcidinem. Jedná se o peptidový hormon syntetizovaný v játrech, který interaguje s feroportinem. Pokud se hepcidin na tento transmembránový exportní protein naváže, dojde k inhibici uvolňování železa z buněk. Přehled klíčových proteinů v metabolismu železa shrnuje tabulka 1.
Sideropenická anémie
 Sideropenická anémie je vůbec nejčastějším typem chudokrevnosti. Hlavní příčinou jejího vzniku je nerovnováha mezi absorpcí a výdejem železa v organismu, což může být zaviněno samotným sníženým příjmem železa ze stravy. V tomto ohledu hrají velkou roli stravovací návyky či geografické faktory. Rizikovou skupinou jsou především vegetariáni či vegani, zde se prevalence anémie odhaduje až na 30 %. Porucha absorpce železa se vyskytuje zejména u pacientů s nemocemi zažívacího traktu. V dospělosti může být sideropenická anémie prvním, nebo také jediným příznakem celiakie. V období růstu či v těhotenství se zvyšují nároky organismu na železo, proto je potřeba navýšit jeho příjem. U těhotných žen stoupá potřeba železa na 20–25 mg za den. Ve třetím trimestru se sideropenie vyskytuje až u 70 % gravidních žen. V praxi představují hlavní příčinu sideropenické anémie krevní ztráty. Fyziologické ztráty železa jsou významné u žen ve fertilním věku (menstruací až 25 mg Fe měsíčně), přirozené epiteliální ztráty činí 1–2 mg železa za den. Z klinického pohledu je zásadní časné rozpoznání krevních ztrát při nádorových onemocněních. Přehled příčin nedostatku železa v organismu shrnuje tabulka 2.
Sideropenická anémie je vůbec nejčastějším typem chudokrevnosti. Hlavní příčinou jejího vzniku je nerovnováha mezi absorpcí a výdejem železa v organismu, což může být zaviněno samotným sníženým příjmem železa ze stravy. V tomto ohledu hrají velkou roli stravovací návyky či geografické faktory. Rizikovou skupinou jsou především vegetariáni či vegani, zde se prevalence anémie odhaduje až na 30 %. Porucha absorpce železa se vyskytuje zejména u pacientů s nemocemi zažívacího traktu. V dospělosti může být sideropenická anémie prvním, nebo také jediným příznakem celiakie. V období růstu či v těhotenství se zvyšují nároky organismu na železo, proto je potřeba navýšit jeho příjem. U těhotných žen stoupá potřeba železa na 20–25 mg za den. Ve třetím trimestru se sideropenie vyskytuje až u 70 % gravidních žen. V praxi představují hlavní příčinu sideropenické anémie krevní ztráty. Fyziologické ztráty železa jsou významné u žen ve fertilním věku (menstruací až 25 mg Fe měsíčně), přirozené epiteliální ztráty činí 1–2 mg železa za den. Z klinického pohledu je zásadní časné rozpoznání krevních ztrát při nádorových onemocněních. Přehled příčin nedostatku železa v organismu shrnuje tabulka 2.
Klinický obraz
 Projevy sideropenické anémie závisejí na jejím stupni, rychlosti vzniku a na adaptaci organismu. Pokud dochází k postupnému poklesu hodnoty hemoglobinu a organismus je adaptovaný, může být pacient zcela asymptomatický. Do obrazu anemického syndromu patří skupina nespecifických příznaků, jako jsou únava, poruchy koncentrace, závratě, snížená fyzická výkonnost spojená s dušností, palpitace, tachykardie, poruchy termoregulace a v neposlední řadě bledost kůže a sliznic. U těžkých forem jsou typické známky tkáňové sideropenie v podobě zvýšeného padání vlasů a fragilita nehtů, jelikož nedostatek železa negativně ovlivňuje tvorbu keratinu. V některých případech můžeme pozorovat až koilonychie – lžičkovité nehty. Slizniční známky sideropenie se mohou projevit jako glositida, v oblasti jícnu dále může vést až k poruchám polykání (Plummerův–Vinsonův syndrom). Velmi vzácně se vyskytuje tzv. pica syndrom – chuť na neobvyklé látky (hlína, křída, led). Klinický obraz rozvinuté sideropenické anémie shrnuje tabulka 3.
Projevy sideropenické anémie závisejí na jejím stupni, rychlosti vzniku a na adaptaci organismu. Pokud dochází k postupnému poklesu hodnoty hemoglobinu a organismus je adaptovaný, může být pacient zcela asymptomatický. Do obrazu anemického syndromu patří skupina nespecifických příznaků, jako jsou únava, poruchy koncentrace, závratě, snížená fyzická výkonnost spojená s dušností, palpitace, tachykardie, poruchy termoregulace a v neposlední řadě bledost kůže a sliznic. U těžkých forem jsou typické známky tkáňové sideropenie v podobě zvýšeného padání vlasů a fragilita nehtů, jelikož nedostatek železa negativně ovlivňuje tvorbu keratinu. V některých případech můžeme pozorovat až koilonychie – lžičkovité nehty. Slizniční známky sideropenie se mohou projevit jako glositida, v oblasti jícnu dále může vést až k poruchám polykání (Plummerův–Vinsonův syndrom). Velmi vzácně se vyskytuje tzv. pica syndrom – chuť na neobvyklé látky (hlína, křída, led). Klinický obraz rozvinuté sideropenické anémie shrnuje tabulka 3.
Laboratorní diagnostika
Prvním bodem je správné vyhodnocení parametrů krevního obrazu s diferenciálním rozpočtem leukocytů a stanovení počtu retikulocytů. Hodnota hemoglobinu bývá snížená – pod 120 g/l u žen a pod 135 g/l u mužů. Střední objem erytrocytu (MCV) je snížen pod 82 fl a střední hmotnost hemoglobinu v erytrocytu (MCH) klesá pod 28 pg. Červená krvinka je tak mikrocytární, hypochromní. V biochemických parametrech hodnotíme jako ukazatele zásob železa v organismu hladinu feritinu, vazebnou kapacitu transferinu pro železo, saturaci transferinu a cirkulující solubilní transferinový receptor (sTfR). Tyto parametry odpovídají fázi deficitu železa. Ve stadiu prelatentní fáze dochází k postupnému vyčerpávání zásob železa, avšak jeho dodávka pro potřeby erytropoezy je ještě dostatečná, nejsou rozvinuty klinické známky sideropenické anémie. V latentní fázi je hodnota feritinu snížena pod 12 µg/l, zvyšuje se vazebná kapacita transferinu pro železo a saturace transferinu klesá pod 12 %. Je snížena dodávka železa do erytroblastů v kostní dřeni, avšak proliferace buněk zatím není limitována. Ve stadiu manifestní sideropenie dochází k útlumu proliferace. Vzniká obraz anémie jako důsledek neschopnosti erytropoezy kompenzovat normální či zvýšený zánik erytrocytů. Feritin v séru klesá pod 5 µg/l a saturace transferinu pod 10 % (obr. 1).
 Po stanovení diagnózy sideropenické anémie je zásadní zjistit příčinu jejího vzniku. Proto doplníme další vyšetření, jako jsou hlavní biochemické parametry, vyšetření moči, krevní srážlivosti, vyšetření stolice na okultní krvácení, endoskopické vyšetření gastrointestinálního traktu (GIT) (gastroskopie, rektoskopie, kolonoskopie) včetně vyšetření na Helicobacter pylori, gynekologické vyšetření apod. Hlavním vodítkem je především správný odběr anamnézy.
Po stanovení diagnózy sideropenické anémie je zásadní zjistit příčinu jejího vzniku. Proto doplníme další vyšetření, jako jsou hlavní biochemické parametry, vyšetření moči, krevní srážlivosti, vyšetření stolice na okultní krvácení, endoskopické vyšetření gastrointestinálního traktu (GIT) (gastroskopie, rektoskopie, kolonoskopie) včetně vyšetření na Helicobacter pylori, gynekologické vyšetření apod. Hlavním vodítkem je především správný odběr anamnézy.
Diferenciální diagnostika
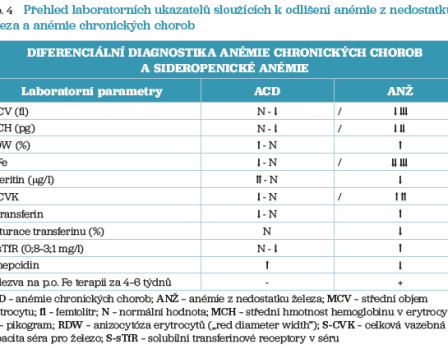 Je nutné odlišit pravou sideropenii od distribučních poruch železa při chronických onemocněních a od stavů, kdy hypochromie a mikrocytóza nejsou projevem sideropenie (např. talasemie, sideroblastické anémie). U anémie chronických chorob (ACD) je snížená koncentrace železa v séru, vazebná kapacita transferinu pro železo je však normální, nebo dokonce snížená. Saturace transferinu je většinou v normě, stejně tak jako koncentrace feritinu v séru. Pokles jeho hodnoty může poukazovat na kombinovanou ACD a sideropenii. Kompletní přehled nálezů a odlišení anémie chronických chorob shrnuje tabulka 4.
Je nutné odlišit pravou sideropenii od distribučních poruch železa při chronických onemocněních a od stavů, kdy hypochromie a mikrocytóza nejsou projevem sideropenie (např. talasemie, sideroblastické anémie). U anémie chronických chorob (ACD) je snížená koncentrace železa v séru, vazebná kapacita transferinu pro železo je však normální, nebo dokonce snížená. Saturace transferinu je většinou v normě, stejně tak jako koncentrace feritinu v séru. Pokles jeho hodnoty může poukazovat na kombinovanou ACD a sideropenii. Kompletní přehled nálezů a odlišení anémie chronických chorob shrnuje tabulka 4.
Terapie
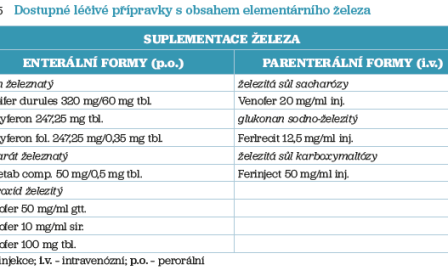 Léčba sideropenické anémie stojí třech pilířích – zvýšení příjmu železa ze stravy, řešení příčiny jeho ztráty a příslušná suplementace. Volba správného léčivého přípravku obsahujícího elementární železo je individuální. Na trhu existují přípravky s obsahem dvojmocného železa, nejčastěji v perorální formě. Jsou vhodné pro pacienty s mírným až středně těžkým deficitem železa a bez potíží se zažíváním. Dvojmocné železo se vyznačuje dobrou farmakokinetikou, je dobře účinné pro rychlou nápravu a je cenově dostupnější. Nevýhodou je však častý výskyt gastrointestinálních vedlejších účinků. Přípravky je nutné užívat nalačno nebo dvě hodiny po jídle, interagují s jinými potravinami či s léky. Trojmocné železo je obsaženo především v intravenózních (i.v.) přípravcích. Tyto volíme u pacientů s velmi těžkou a závažnou anémií nebo u nemocných s poruchou vstřebávání železa (malabsorpce). Užívání léčivých přípravků s obsahem trojmocného železa s sebou nese méně gastrointestinálních nežádoucích účinků a lze je užívat s jídlem. Nevýhodou u perorálních forem je nižší absorpce, u i.v. forem potom vyšší cena a riziko alergie či rozvoj anafylaxe. Při zahájení terapie perorálními přípravky podáváme 150–200 mg železa denně, očekávaný vzestup hodnoty hemoglobinu za 1–2 týdny je o 10 g/l. Parenterální substituci železa volíme u pacientů s neúčinností či netolerancí perorální léčby nebo v situacích, kdy je nutné rychlé zajištění přísunu železa. Indikace parenterální substituce musí být náležitě zdůvodněna, mj. z důvodu možného rizika rozvoje alergické či anafylaktoidní reakce, proto při i.v. podávání přípravků železa musí být dostupné zajištění kardiopulmonální resuscitace. U přípravků podávaných i.v. jsme schopni za jedné aplikace podat vysoké dávky železa. Například u přípravku Ferinject až 1 000 mg Fe za 15 minut. Tento léčivý přípravek je hojně využíván v oblasti kardiologie a má svá indikační omezení. V současné době je plně hrazen ze zdravotního pojištění u pacientů s deficitem železa a chronickým srdečním selháním s vyšší funkční třídou (NYHA II–III), s ejekční frakcí levé komory pod 45 %, kteří jsou současně léčení inhibitory angiotenzin konvertujícího enzymu (ACE). Přehled dostupných léčivých přípravků s obsahem elementárního železa shrnuje tabulka 5.
Léčba sideropenické anémie stojí třech pilířích – zvýšení příjmu železa ze stravy, řešení příčiny jeho ztráty a příslušná suplementace. Volba správného léčivého přípravku obsahujícího elementární železo je individuální. Na trhu existují přípravky s obsahem dvojmocného železa, nejčastěji v perorální formě. Jsou vhodné pro pacienty s mírným až středně těžkým deficitem železa a bez potíží se zažíváním. Dvojmocné železo se vyznačuje dobrou farmakokinetikou, je dobře účinné pro rychlou nápravu a je cenově dostupnější. Nevýhodou je však častý výskyt gastrointestinálních vedlejších účinků. Přípravky je nutné užívat nalačno nebo dvě hodiny po jídle, interagují s jinými potravinami či s léky. Trojmocné železo je obsaženo především v intravenózních (i.v.) přípravcích. Tyto volíme u pacientů s velmi těžkou a závažnou anémií nebo u nemocných s poruchou vstřebávání železa (malabsorpce). Užívání léčivých přípravků s obsahem trojmocného železa s sebou nese méně gastrointestinálních nežádoucích účinků a lze je užívat s jídlem. Nevýhodou u perorálních forem je nižší absorpce, u i.v. forem potom vyšší cena a riziko alergie či rozvoj anafylaxe. Při zahájení terapie perorálními přípravky podáváme 150–200 mg železa denně, očekávaný vzestup hodnoty hemoglobinu za 1–2 týdny je o 10 g/l. Parenterální substituci železa volíme u pacientů s neúčinností či netolerancí perorální léčby nebo v situacích, kdy je nutné rychlé zajištění přísunu železa. Indikace parenterální substituce musí být náležitě zdůvodněna, mj. z důvodu možného rizika rozvoje alergické či anafylaktoidní reakce, proto při i.v. podávání přípravků železa musí být dostupné zajištění kardiopulmonální resuscitace. U přípravků podávaných i.v. jsme schopni za jedné aplikace podat vysoké dávky železa. Například u přípravku Ferinject až 1 000 mg Fe za 15 minut. Tento léčivý přípravek je hojně využíván v oblasti kardiologie a má svá indikační omezení. V současné době je plně hrazen ze zdravotního pojištění u pacientů s deficitem železa a chronickým srdečním selháním s vyšší funkční třídou (NYHA II–III), s ejekční frakcí levé komory pod 45 %, kteří jsou současně léčení inhibitory angiotenzin konvertujícího enzymu (ACE). Přehled dostupných léčivých přípravků s obsahem elementárního železa shrnuje tabulka 5.
Závěr
Sideropenická anémie představuje velmi častý medicínský problém. V našich podmínkách patří mezi nejčastější příčiny ztrát železa menstruační krvácení, krvácení při benigních i maligních nemocech GIT, nutriční deficit v graviditě, při laktaci a u kojenců. Klinický obraz může být pestrý, závisí na rychlosti rozvoje, na stupni anémie a na adaptaci organismu. Diagnostika tohoto onemocnění vychází především ze správného vyhodnocení souboru laboratorních parametrů. Její včasnost může vést k časnému odhalení a léčbě maligního onemocnění. U většiny případů vystačíme s perorální substituční terapií. Máme na výběr mezi přípravky obsahujícími dvojmocné či trojmocné železo. Tyto se liší především ve farmakokinetice a mají jiný profil vedlejších nežádoucích účinků. Nitrožilní podání využíváme individuálně, pokud má pacient poruchu vstřebávání nebo z jakéhokoliv jiného důvodu netoleruje perorální substituci. U vybraných skupin pacientů lze včasnou indikací substituce rozvoji sideropenie i předejít.
MUDr. Karolína Široká, MUDr. Antonín Hluší, Ph.D.
Hemato‑onkologická klinika LF UPa FN Olomouc
Korespondenční adresa: karolina.siroka@fnol.cz