Sirtuiny jako nový terapeutický cíl v léčbě karcinomu žaludku
Rakovina žaludku představuje celosvětově velkou zdravotní zátěž. Mezi všemi novotvary je rakovina žaludku pátým nejčastějším a třetím nejsmrtelnějším typem rakoviny. Je známo, že sirtuiny (SIRT) jsou NAD+‑dependentní histonové deacetylázy regulující důležité metabolické dráhy. Vysoká exprese SIRT v lidském těle může regulovat metabolické procesy; zabraňují zánětům, ale také odolávají procesům buněčné smrti a stárnutí. Sedm členů této rodiny enzymů může také hrát zásadní roli v procesu karcinogeneze tím, že ovlivňují životaschopnost buněk, apoptózu a metastazování. Tento článek diskutuje úlohu všech sedmi sirtuinů (SIRT1–7) v patogenezi karcinomu žaludku (KŽ) a jejich možného terapeutického využití.
Karcinom žaludku
Karcinom žaludku (KŽ) je onemocnění žaludeční stěny, které metastazuje do plic, kostí, jater a lymfatických uzlin. V současnosti se jedná o čtvrtou nejčastější příčinu úmrtí na rakovinu v Evropě a páté nejčastější onkologické onemocnění na světě. Jen v roce 2018 bylo diagnostikováno více než jeden milion nových případů a 783 000 úmrtí, což z ní činí třetí nejsmrtelnější typ rakoviny. Adenokarcinom je nejčastějším druhem zhoubného nádoru žaludku, který tvoří 90–97 % všech zhoubných nádorů žaludku.1,2
Nejčastějšími příčinami vzniku KŽ jsou věk, gastroezofageální refluxní choroba, infekce bakterií H. pylori a potrava. Konzumace teplých jídel, solených, smažených, nakládaných nebo uzených potravin, stejně jako dusíkatých látek a aromatických uhlovodíků jsou významnými faktory vzniku onemocnění. Ukázalo se, že zavedení zeleniny a ovoce do jídelníčku může snížit riziko vzniku tohoto onemocnění až o 66–75 %.3
Hlavní léčbou KŽ je chirurgická resekce patologií, nicméně data o pětiletém přežití nevypadají uspokojivě. Předoperační a adjuvantní léčba (chemoterapie, radioterapie a chemoradioterapie), která se v mnoha zemích stala zlatým standardem, představuje první krok před hlavní intervencí, chirurgickým zákrokem, nebo její doplněk, což prodlužuje míru přežití. Hlavní léčbou pokročilého KŽ zůstává kombinace neoadjuvantní chemoradioterapie, molekulárně cílené léčby a imunoterapie, přičemž chemoterapie je založena na infuzích epirubicinu, cisplatiny, mitomycinu nebo 5‑fluorouracilu.4
Přes veškerá opatření zůstává onemocnění zátěží pro společnost, a pro-
to je důležitý výzkum potenciální léčby a nových terapeutických cílů.5
Role sirtuinů u karcinomu žaludku
Sirtuiny (SIRT) jsou rodinou enzymů, které hrají klíčovou roli v regulaci buněčných procesů, jako jsou stárnutí, metabolismus a stres. Jsou typem NAD+‑dependentní proteinové deacetylázy odstraňující acetylové skupiny jiných proteinů. Je známo sedm typů sirtuinů, označovaných SIRT1 až SIRT7. Každý SIRT má jedinečný způsob exprese a substrátovou specifitu. SIRT1 a SIRT2 se nacházejí v jádře a/nebo v cytoplazmě s možností přesahu do systémového oběhu, SIRT3–5 se nalézají v mitochondriích, zatímco SIRT6 a SIRT7 v jádře buněk.6
 Mnoho buněčných procesů je regulováno deacetylačními reakcemi a SIRT mohou být exprimovány v imunitních buňkách u nádorového onemocnění. SIRT ovlivňují aktivitu T lymfocytů prostřednictvím inhibice aktivity PPARγ. Data naznačují, že účast SIRT v patogenezi novotvarů včetně KŽ může být významná a jednotlivé typy enzymů budou prezentovány v další části.7
Mnoho buněčných procesů je regulováno deacetylačními reakcemi a SIRT mohou být exprimovány v imunitních buňkách u nádorového onemocnění. SIRT ovlivňují aktivitu T lymfocytů prostřednictvím inhibice aktivity PPARγ. Data naznačují, že účast SIRT v patogenezi novotvarů včetně KŽ může být významná a jednotlivé typy enzymů budou prezentovány v další části.7
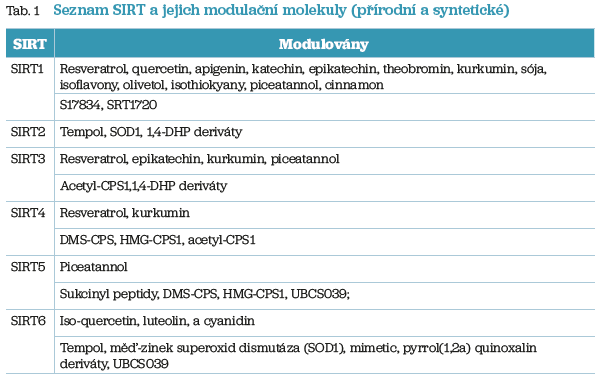
Velice zajímavý je fakt, že celá skupina SIRT může být modulována různými faktory včetně buněčného stresu, signálních proteinů a různých přírodních a syntetických látek, jejichž přehled je prezentován v tabulce 1.8
Sirtuin 1
Sirtuin 1 (SIRT1) je nejlépe prozkoumaným proteinem, u kterého bylo prokázáno, že reguluje aktivitu transkripčních faktorů, včetně těch, které se podílejí na energetickém metabolismu a zánětlivých procesech. Vysoké hladiny SIRT1 již byly identifikovány u nádorových onemocnění, jako je například kolorektální adenokarcinom9, KŽ10,11, a byl popsán jako dobrý prognostický ukazatel progrese onemocnění.8
Zhang a kol. navrhli označit SIRT1 za raný diagnostický a prognostický marker KŽ. Tým popsal korelaci mezi expresí genu SIRT1, stadiem onemocnění, pokročilostí stadia žaludečního adenokarcinomu a špatnou prognózou. SIRT1 indukuje yes‑associated protein (Yap) a aktivuje mitofusin 2, který reguluje mitofagii, což je proces, při kterém jsou eradikovány poškozené mitochondrie. Tato dráha blokuje apoptózu a snižuje oxidační stres, z čehož vyplývá zvýšená migrace nádorových buněk.12 Aktivace SIRT1 resveratrolem působila proti STAT3 a NF‑κB. STAT3 hraje roli při zprostředkování extracelulárních signálů a regulaci transkripce genů zodpovědných za angiogenezi, buněčnou proliferaci a přežití a jeho blok představuje atraktivní strategii pro terapeutický zásah v léčbě rakoviny.13
Dalším faktorem je p53, transkripční faktor potlačující vznik nádorů. Protein p53 může být SIRT1 buď deacetylován, nebo destabilizován, což inhibuje jeho schopnost zastavit buněčný cyklus a apoptózu. U pacientů s adenokarcinomem žaludku bylo prokázáno, že SIRT1 hraje roli nádorového supresoru prostřednictvím interakce s β‑kateninem a vysoká exprese SIRT1 korelovala s lepší mírou přežití.14 SIRT1 působí jako negativní regulátor metastázy KŽ a vyšší exprese SIRT1 koreluje s delším celkovým přežitím. Studie in vitro a in vivo postulovaly, že SIRT1 potlačuje migraci a invazi buněk KŽ a omezuje metastázy do plic.15 Cha a kol. v roce 2009 prokázali, že jaderná exprese SIRT1 byla zjištěna u 73 % pacientů s KŽ a korelovala s invazí nádoru do lymfatických uzlin.10 Myší model KŽ ukázal, že exprese SIRT1 byla významně vyšší u obézních myší s KŽ než u štíhlých myší, což poukazuje na to, že kalorická restrikce a/nebo hladovění mají vliv na expresi SIRT1.16
Sirtuin 2
Sirtuin 2 (SIRT2) se podílí na regulaci buněčného dělení. Výzkum prokázal, že SIRT2 podporuje migraci a invazi buněk KŽ. Jeho zvýšená exprese korelovala se špatnou prognózou onemocnění a s kratší dobou přežití (OS). Navíc SIRT2 knockout nebo použití selektivního inhibitoru SirReal2 snížilo migraci a invazi buněk KŽ.17
Sirtuin 3
Sirtuin 3 (SIRT3) hraje roli v regulaci metabolismu aminokyselin, oxidace mastných kyselin, cyklu trikarboxylových kyselin a cyklu močoviny. Stejně jako SIRT1 je tento enzym dvojího charakteru a může být promotorem i supresorem KŽ. Pacienti s KŽ měli sníženou expresi SIRT3, což bylo dáno do souvislostí s patologiemi včetně diferenciace nádoru, stadia a infiltrace onemocnění. Naproti tomu knockout SIRT3 vedlo k dělení buněk a růstu nádoru.18
Sirtuin 4
Sirtuin 4 (SIRT4) plní důležitou funkci během zánětlivých onemocnění. Jeho cíle zahrnují malonyl CoA dekarboxylázu, pyruvátdehydrogenázu a další významné metabolické enzymy. U KŽ byla rovněž prokázána snížená regulace SIRT419–21, a dále nadměrná exprese SIRT4 významně snížila počet kolonií in vitro. Exprese SIRT4 zastavila buněčný cyklus KŽ a ovlivnila jejich apoptózu.22
Sirtuin 5
Sirtuin 5 (SIRT5) rovněž reguluje metabolismus ovlivněním β‑oxidace mastných kyselin, cyklu trikarboxylových kyselin a glykolýzy a bylo prokázáno, že posttranslační modifikace mají pro‑ nebo protirakovinnou aktivitu v závislosti na typu a lokalizaci rakoviny.23 Studie in vivo popsala sníženou expresi SIRT5 na většině buněčných linií KŽ.24 Další studie ukázala, že SIRT5 inhibuje proliferaci buněk KŽ a schopnost tvořit kolonie. Vysoká exprese SIRT5 inhibovala objem nádorů a usnadnila apoptózu.25
Sirtuin 6
Sirtuin 6 (SIRT6) se podílí na metabolismu mastných kyselin, ovlivňuje sekreci tumor nekrotizujícího faktoru (TNF), který hraje roli v patogenezi rakoviny, a moduluje metabolické dráhy související s nukleárním faktorem kappa B (NF‑κB).26 SIRT6 může působit jako promotor i supresor karcinogeneze. SIRT6 působí jako transkripční represor a udržuje stabilitu genomu. Podílí se na opravě zlomů DNA pomocí sekundárních poslů.27 Studie naznačila, že SIRT6 inhibuje růst KŽ prostřednictvím dráhy JAK2/STAT3. Dále se ukázala korelace mezi nižšími hladinami SIRT6 a velikostí nádorů a pokročilejším stadiem rakoviny.28
Sirtuin 7
Sirtuin 7 (SIRT7) se také podílí na regu-
laci aktivity řady transkripčních faktorů a jeho hodnota je podstatně vyšší v buňkách KŽ. Studie popsala, že exprese SIRT7 koreluje s velikostí nádoru, metastázami, stadiem onemocnění a špatnou prognózou onemocnění včetně OS. Navíc vyřazení genu pro SIRT7 snížilo in vitro a in vivo růst KŽ. Regulace tohoto procesu byla popsána v souvislosti s dráhami miR‑34a, deacetylací H3K18ac, Sirt7/miR‑34a a aktivitou proteinu p53.29
Využití tohoto mechanismu v léčbě rakoviny žaludku
V současné době nejsou k dispozici žádné léky, které by byly specificky zaměřeny na SIRT v léčbě KŽ. Bylo však zjištěno, že některé molekuly nebo léky mají vliv na aktivitu SIRT a mohou mít potenciál v léčbě KŽ.8 Dále navazuje stručný přehled popisující základy mechanismů látek spojených s aktivitou SIRT, které z nich činí potenciální cíl ve studiu terapie KŽ.
Metformin
Jedním z příkladů je metformin, u něhož byly dříve zjištěny protirakovinné účinky a který inhibuje SIRT1 a SIRT2.30 Metformin prokázal inhibici růstu buněk KŽ a in vitro a in vivo podpořil apoptózu.31 In silico analýza potvrdila přímý efekt metforminu na aktivitu SIRT1.32
Resveratrol (RSV)
Resveratrol je přírodní látka obsažená v červeném víně, která má antioxidační aktivitu a inhibuje SIRT1 a SIRT2, čímž inhibuje růst buněk KŽ in vitro a in vivo. RSV navozená aktivace SIRT1 má terapeutický potenciál v souvislosti s patogenezí KŽ.33–36
Poprvé byly protinádorové účinky RSV popsány v roce 1997 a postupně se ukázal jako látka schopná potlačovat proliferaci různých typů rakoviny skrze různé molekulární cíle (SIRT, EGF, H. pylori). Navíc strava bohatá na RSV vykazuje u buněk KŽ apoptózu a autofagii. Podobně bylo zjištěno, že RSV inhibuje proliferaci buněk KŽ.37,38
RSV v dávce 50–200 μmol/l po dvou dnech významně indukoval apoptózu u buněk KŽ. Data ukázala, že RSV inhibuje KŽ v závislosti na SIRT1 a pozitivně ovlivňuje prevenci a terapii onemocnění.39 Chemopreventivní účinky RSV byly prokázány i u buněk kolorektálního karcinomu ovlivněním proliferace nádorových buněk.40
Další potenciální látky
Mezi další látky řadíme sirtinol, inhibitor SIRT1. Molekula prokázala in vitro protinádorové účinky u kolorektálního karcinomu. Léčba snížila aktivitu SIRT1 a způsobila poškození DNA, zástavu buněčného cyklu a spustila apoptózu.39,41 Další slibná molekula, EX‑527, inhibitor SIRT2, prokázala inhibici růstu buněk KŽ in vitro. Látka fungovala navzdory rezistenci na protinádorová léčiva a zvýšila citlivost na chemoterapii.42
Závěr
Chronický zánět je obecným rysem většiny onemocnění spojených se stárnutím včetně rakoviny. Sirtuiny (SIRT) se mohou podílet na patogenezi karcinomu žaludku (KŽ) včetně reakce na infekci H. pylori, vzniku nádoru, růstu, angiogeneze a inhibice apoptózy. SIRT1 je v reakci na poškození DNA nejvíce popsanou molekulou, ale významná je i role dalších šesti látek (SIRT2–7). Citované výzkumy považují SIRT za potenciální biomarkery nebo přímo terapeutické cíle tohoto onemocnění.
Literatura
- Johnston FM, Beckman M. Updates on Management of Gastric Cancer. Curr Oncol Rep 2019;21:67.
- Tkacz M, et al. A. Role of prometastatic factors in gastric cancer development. Postep Hig Med Dosw Online 2016;70:1367–77.
- Maddineni G, et al. Diet and carcinogenesis of gastric cancer. Curr Opin Gastroenterol 2022;38:588–591.
- Song Z, et al. Progress in the treatment of advanced gastric cancer. Tumour Biol 2017; 39:1010428317714626.
- Giampieri R, et al. Optimal management of resected gastric cancer. Cancer Manag Res 2018;10:1605–1618.
- Gyamfi J, et al. Cancer as a Metabolic Disorder. Int J Mol Sci 2022;23:1155.
- Rasha F, et al. The Versatility of Sirtuin‑1 in Endocrinology and Immunology. Front Cell Dev Biol 2020;8:1370.
- Qiu G, et al. SIRT1 is a regulator of autophagy: Implications in gastric cancer progression and treatment. FEBS Lett 2015;589:2034–2042.
- Lv L, et al. Clinicopathological significance of SIRT1 expression in colorectal adenocarcinoma. Med Oncol 2014;31:965.
- Cha EJ, et al. Expression of DBC1 and SIRT1 is associated with poor prognosis of gastric carcinoma. Clin Cancer Res 2009;15:4453–4459.
- Feng AN, et al. Expression of SIRT1 in gastric cardiac cancer and its clinicopathologic significance. Int J Surg Pathol 2011;19:743–750.
- Zhang S, et al. Co‑ordinated overexpression of SIRT1 and STAT3 is associated with poor survival outcome in gastric cancer patients. Oncotarget 2017;8:18848–18860.
- Papierska K, Krajka‑Kuźniak V. STAT3 as a therapeutic target. Farm Współczesna 2020;13:29–34.
- Kang Y, et al. Expression of SIRT1 and DBC1 in Gastric Adenocarcinoma. Korean J Pathol 2012;46:523–531.
- Dong G, et al. SIRT1 suppresses the migration and invasion of gastric cancer by regulating ARHGAP5 expression. Cell Death Dis 2018;9:977.
- Li H, et al. Diet‑induced obesity promotes murine gastric cancer growth through a nampt/sirt1/c‑myc positive feedback loop. Oncol Rep 2013;30:2153–2160.
- Li Y, et al. SIRT2 Promotes the Migration and Invasion of Gastric Cancer through RAS/ERK/JNK/MMP‑9 Pathway by Increasing PEPCK1‑Related Metabolism. Neoplasia 2018;20:745–756.
- Huang KH, et al. SIRT3 expression as a biomarker for better prognosis in gastric cancer. World J Surg 2014;38:910–917.
- Huang G, et al. Sirtuin‑4 (SIRT4) is downregulated and associated with some clinicopathological features in gastric adenocarcinoma. Biomed Pharm 2015;72:135–139.
- Sun H, et al. SIRT4 acts as a tumor suppressor in gastric cancer by inhibiting cell proliferation, migration, and invasion. Onco Targets Ther 2018;11:3959–3968.
- Costa‑Machado LF, Fernandez‑Marcos PJ. The sirtuin family in cancer. Cell Cycle 2019;18:2164–2196.
- Hu Y, et al. Overexpression of SIRT4 inhibits the proliferation of gastric cancer cells through cell cycle arrest. Oncol Lett 2019;17:2171–2176.
- Wang F, et al. SIRT5 desuccinylates and activates pyruvate kinase M2 to block macrophage IL‑1β production and to prevent DSS‑induced colitis in mice. Cell Rep 2017;19:2331–2334.
- Gu W, et al. SIRT5 regulates autophagy and apoptosis in gastric cancer cells. J Int Med Res 2021;49:1–15.
- Tang Z, et al. CDK2 positively regulates aerobic glycolysis by suppressing SIRT5 in gastric cancer. Cancer Sci 2018;109:2590–2598.
- Mostoslavsky R, et al. Genomic instability and aging‑like phenotype in the absence of mammalian SIRT6. Cell 2006;124:315–329.
- Desantis V, et al. The role of SIRT6 in tumors. Hematologica. 2008;103:1–4.
- Zhou J, et al. SIRT6 inhibits growth of gastric cancer by inhibiting JAK2/STAT3 pathway. Oncol Rep 2017;38:1059–1066.
- Zhang X, et al. Resveratrol Protects against Helicobacter pylori‑Associated Gastritis by Combating Oxidative Stress. Int J Mol Sci 2015;16:27757–27769.
- Lee BB, et al. Metformin and tenovin‑6 synergistically induces apoptosis through LKB1‑independent SIRT1 down‑regulation in non‑small cell lung cancer cells. J Cell Mol Med 2019;23:2872–2889. doi: 10.1111/jcmm.14194.
- Chen S, et al. Metformin in aging and aging‑related diseases: clinical applications and relevant mechanisms. Theranostics 2022;12:2722–2740. doi: 10.7150/thno.71360.
- Cuyàs E, et al. Metformin Is a Direct SIRT1‑Activating Compound: Computational Modeling and Experimental Validation. Front Endocrinol (Lausanne). 2018;9:657. doi: 10.3389/fendo.2018.00657.
- Mahady GB, Pendland SL. Resveratrol inhibits the growth of Helicobacter pylori in vitro. Am J Gastroenterol 2000;95:1849.
- Lin Z, Fang D. The Roles of SIRT1 in Cancer. Genes Cancer 2013;4:97–104.
- Zhang S, et al. Sirt7 promotes gastric cancer growth and inhibits apoptosis by epigenetically inhibiting miR‑34a. Sci Rep 2015;5:9787.
- Yang G, et al. Resveratrol Alleviates Rheumatoid Arthritis via Reducing ROS and Inflammation, Inhibiting MAPK Signaling Pathways, and Suppressing Angiogenesis. J Agric Food Chem 2018;66:12953–12960.
- Yang Q, et al. SIRT1 is downregulated in gastric cancer and leads to G1‑phase arrest via NF‑κB/Cyclin D1 signaling. Mol Cancer Res 2013;11:1497–1507.
- Zulueta A, et al. Resveratrol: A potential challenger against gastric cancer. World J Gastroenterol 2015;21:10636–10643.
- Wang Z, et al. Resveratrol induces gastric cancer cell apoptosis via reactive oxygen species, but independent of sirtuin1. Clin Exp Pharmacol Physiol 2012;39:227–232.
- Buhrmann C, et al. Sirt1 Is Required for Resvera‑trol‑Mediated Chemopreventive Effects in Colorectal Cancer Cells. Nutrients 2016;8:145.
- Kang YJ, et al. MHY2245, a Sirtuin Inhibitor, Induces Cell Cycle Arrest and Apoptosis in HCT116 Human Colorectal Cancer Cells. Int J Mol Sci 2022;23:1590. doi: 10.3390/ijms23031590.
- Zhu H, et al. Activating transcription factor 4 confers a multidrug resistance phenotype to gastric cancer cells through transactivation of SIRT1 expression. PLoS One 2012;7:e31431. doi: 10.1371/journal.pone.0031431.