Skríning kardiovaskulárnych ochorení a onkologické ochorenie
Súhrn
Pokroky vo včasnej diagnostike a liečbe nádorových ochorení významne prispeli k vyliečeniu alebo zlepšeniu prežívania onkologických pacientov. Dlhšie ako päť rokov po stanovení diagnózy žije 70 % dospelých a 80 % detských pacientov s nádorovými ochoreniami. Mnohí z týchto pacientov častejšie zomierajú na kardiovaskulárne (KV) choroby ako na malignity, čo zdôrazňuje dôležitosť survivorshipu. K poškodeniu srdca a ciev u pacientov po onkologickej liečbe môžu prispievať kardiotoxické účinky protinádorovej liečby, rizikové faktory spoločné pre onkologické a KV ochorenia (KVO), ako aj chronický zápal asociovaný s onkologickým ochorením. Diagnostika a manažment dyslipidémie u onkologických pacientov počas aktívnej onkologickej liečby, ale aj po jej skončení sú značne podceňované a vyžadujú si multidisciplinárny prístup. (Kap Kardiol 2023; 15: 17–21)
Kľúčové slová
· dyslipidémia · kardioonkológia · kardiotoxicita · prevencia · survivorship
Úvod
Onkologické ochorenie generuje unikátnu populáciu pacientov, ktorí majú myriádu chronických komorbidít, pričom kardiovaskulárne ochorenia (KVO) sú najdôležitejšie. Pokroky vo včasnej diagnostike a liečbe nádorových ochorení významne prispeli k vyliečeniu alebo zlepšeniu prežívania onkologických pacientov. V Spojených štátoch amerických žije 16,9 milióna tzv. cancer survivors, čo predstavuje 5 % populácie, a do roku 2030 sa očakáva nárast na 22 miliónov;1 70 % týchto pacientov má očakávanú dĺžku života viac ako päť rokov, pričom 50 % mužov a 40 % žien vo veku nad 50 rokov bude mať KVO počas zvyšku života.2 V populácii detských pacientov s onkologickým ochorením je 80 % cancer survivors, ktorí sa dožívajú dospelého veku a sú vo zvýšenom riziku kardiovaskulárnej (KV) morbidity a mortality.
Kardioonkológia si kladie ambiciózny cieľ, a to udržať dobrú kvalitu KV systému onkologických pacientov pri zachovaní efektivity protinádorovej liečby. Snaží sa predovšetkým o definíciu rizika poškodenia srdca a ciev pred podávaním kardiotoxickej liečby, počas nej aj po jej ukončení (survivorship). K poškodeniu srdca a ciev u pacientov po protinádorovej liečbe môžu prispievať: kardiotoxické účinky protinádorovej liečby, rizikové faktory spoločné pre onkologické aj KV ochorenia, ako aj chronický zápal asociovaný s onkologickým ochorením.3
V súvislosti s KV prevenciou existuje u pacientov s nádorovým ochorením stále veľa mýtov, ktoré tvrdia, že sa treba sústrediť výlučne na liečbu onkologického ochorenia a KV prevencia môže byť postponovaná, pritom pacienti po prekonaní onkologického ochorenia a s KVO majú jednoznačne najhoršiu prognózu prežívania (obr. 1).4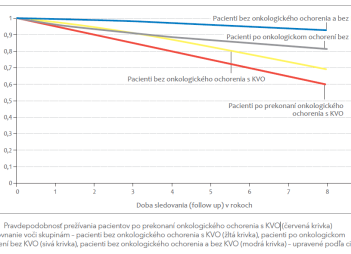
Rizikové faktory KV a onkologických ochorení
Mnohé rizikové faktory pre KV aj onkologické ochorenia sú spoločné. Ide o tzv. duálne rizikové faktory, ktoré zvyšujú riziko tzv. duálnej diagnózy u toho istého pacienta. V súvislosti so starnutím populácie sa počet pacientov s duálnou diagnózou, t. j. onkologickým a KV ochorením, značne zvyšuje.5 Ide predovšetkým o vyšší vek, chronický zápal, obezitu, nevhodné zloženie diéty, dyslipidémiu, artériovú hypertenziu, diabetes mellitus, fajčenie a fyzickú inaktivitu. Prevencia a terapeutické ovplyvnenie týchto rizikových faktorov sú jednoznačne prospešné ako pri znižovaní rizika KVO, tak aj rizika karcinogenézy. U mnohých pacientov s onkologickým ochorením môže úmrtnosť na KVO v konečnom dôsledku prevýšiť úmrtnosť na väčšinu foriem onkologických ochorení.6,7
Protinádorová liečba a KVO
Výrazný pokrok v onkológii vedie k rýchlo sa rozširujúcemu armamentáriu nových protinádorových liekov a adjuvantných terapií, ktoré však majú aj veľké spektrum včasných aj neskorých nežiaducich účinkov na KV systém, vrátane kardiomyopatie, dysfunkcie ľavej komory, srdcového zlyhania, artériovej hypertenzie, koronárnej choroby srdca, rizika arytmií. Preto sú mimoriadne dôležité účinné stratégie na predikciu a prevenciu KV toxicity protinádorovej liečby. Latencia a závažnosť kardiotoxicity pri rádioterapii, ako aj akcelerovaná ateroskleróza a cerebrálne vaskulárne ochorenie súvisia s viacerými faktormi, vrátane celkovej dávky žiarenia, objemu ožiareného srdca, súbežného podávania iných kardiotoxických liekov (najmä antracyklínov) a faktorov pacienta (mladší vek, prítomné tradičné rizikové faktory aterosklerózy a KVO v anamnéze).8,9
Diagnóza a skríning KVO u onkologických pacientov
Symptómy srdcovej dysfunkcie sa majú monitorovať pred protinádorovou liečbou a pravidelne počas protinádorovej liečby a po nej, aby sa včas odhalili abnormality u pacientov, ktorí dostávajú potenciálne kardiotoxickú liečbu. V súčasnosti sa odporúča nielen echokardiografické meranie ejekčnej frakcie ľavej komory, ale aj detekcia subklinických abnormalít pomocou zobrazovacích metodík, ako aj laboratórne meranie cirkulujúcich biomarkerov (ako sú srdcové troponíny a natriuretické peptidy). Echokardiografické meranie zaťaženia myokardu (myocardial strain), najmä systolického globálneho pozdĺžneho napätia (systolic global longitudinal strain), totiž môžu predchádzať významnému poklesu ejekčnej frakcie ľavej komory.10,11
Odporúča sa, aby dôsledným skríningom KV dysfunkcie prešli pacienti, ktorí spĺňajú ktorékoľvek z nasledujúcich kritérií:3
- Liečba akoukoľvek nižšie uvedenou kombináciou protinádorovej terapie:
- vysokými dávkami antracyklínu (napr. doxorubicín ≥ 250 mg/m2, epirubicín ≥ 600 mg/m2);
- vysokodávkovanou rádioterapiou (RT; ≥ 30 Gy), keď je srdce v liečebnom poli;
- nižšími dávkami antracyklínu (napr. doxorubicín < 250 mg/m2, epirubicín < 600 mg/m2) v kombinácii s nižšou dávkou RT (< 30 Gy), keď je srdce v liečebnom poli.
- Liečba nižšou dávkou antracyklínu (napr. doxorubicín < 250 mg/m2, epirubicín < 600 mg/m2) alebo samotným trastuzumabom a prítomný je ktorýkoľvek z nasledujúcich rizikových faktorov:
- viac kardiovaskulárnych rizikových faktorov (≥ 2), vrátane fajčenia, hypertenzie, cukrovky, dyslipidémie a obezity, počas liečby alebo po jej ukončení;
- vyšší vek (≥ 60 rokov počas liečby onkologického ochorenia);
- zhoršená funkcia srdca (napr. hranične nízka ejekčná frakcia ľavej komory [50 – 55 %], infarkt myokardu v anamnéze, stredne závažné chlopňové ochorenie srdca) kedykoľvek pred liečbou alebo počas liečby.
- Liečba nižšou dávkou antracyklínu (napr. doxorubicín < 250 mg/m2, epirubicín < 600 mg/m2), po ktorej nasleduje trastuzumab (sekvenčná liečba).
Aktuálne platné odporúčania na skríning KV toxicity pred začatím liečby onkologického ochorenia prehľadne zobrazuje obr. 2.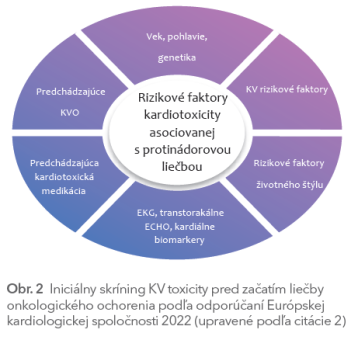
Prevencia kardiotoxicity a KV rizikových faktorov
Klinické randomizované štúdie s inhibítormi renín‑angiotenzín‑aldosterónového systému (RAAS) a/alebo s betablokátormi po liečbe trastuzumabom alebo antracyklínoch priniesli protichodné výsledky.10,12,13 Hlavným benefitom liečby bola nižšia miera remodelácie ľavej komory a menší pokles ejekčnej frakcie ľavej komory dokázanej vyšetrením magnetickou rezonanciou, ale translácia do lepších KV výsledkov zostala špekulatívna. Pacientom s onkologickým ochorením sa však dôrazne odporúča fyzická aktivita a úprava diéty. Najmä aeróbne cvičenie sa považuje za sľubnú nefarmakologickú stratégiu na prevenciu a/alebo liečbu kardiotoxicity chemoterapie.14 Významne vyššie riziko KVO je u pacientov, ktorí prežili onkologické ochorenie v detstve, ako u dospelých bez onkologického ochorenia, a najmä u pacientov, ktorí prekonali onkologické ochorenie v dospelosti a už mali prítomné základné rizikové faktory aterosklerózy. Preto sa v tejto populácii odporúča agresívny manažment rizikových faktorov aterosklerózou podmienených KVO. Niekoľko prebiehajúcich štúdií (PROACT, ICOS‑ONE) skúma úlohu enalaprilu pri prevencii kardiotoxicity vyvolanej antracyklínmi. Štúdia Southwest Oncology Group (SWOG) skúma účinnosť karvedilolu oproti placebu u pacientiek s metastatickým HER2+ karcinómom prsníka, ktoré dostávajú kardiotoxickú liečbu, a štúdia PRADA II hodnotí úlohu sakubitrilu/valsartanu pri zmierňovaní poklesu ejekčnej frakcie ľavej komory po 18 mesiacoch. Štúdie STOP‑CA a PREVENT hodnotia účinnosť statínov ako primárnu preventívnu stratégiu u pacientov s non‑Hodgkinovým lymfómom a karcinómom prsníka. Prebieha niekoľko štúdií, ktoré hodnotia úlohu diétnych a cvičebných intervencií. Štúdia CARDAPAC skúma vplyv individualizovaných cvičebných intervencií u pacientiek s karcinómom prsníka liečených trastuzumabom na metabolické a hormonálne odpovede vrátane ejekčnej frakcie ľavej komory.
Hyperlipidémia u onkologických pacientov
Úloha lipidov v karcinogenéze nie je úplne objasnená. Predpokladá sa úloha SREBP, ATP binding cassette class A, PI3‑K. Metabolický syndróm u pacientov, ktorí prežili onkologické ochorenie, predstavuje významný rizikový faktor KVO (napr. u detí po akútnej lymfoblastovej leukémii je dvojnásobná prevalencia metabolického syndrómu v porovnaní s ostatnou populáciou). Dyslipidémia je u onkologických pacientov spojená s horším prežívaním. Potenciálne mechanizmy dyslipidémie zahŕňajú inváziu tumoru, metastatický rozsev,15 rezistenciu na protinádorové lieky,16 kardiálnu/vaskulárnu toxicitu protinádorovej terapie.17
Hypolipidemická liečba a onkologické ochorenia
Statíny majú dôkazy v redukcii rizika rozvoja a/alebo progresie onkologického ochorenia, benefit statínovej liečby bol dokázaný u pacientov s kolorektálnym karcinómom. Pacienti, ktorí užívali statín počas viac ako troch rokov pred stanovením diagnózy kolorektálneho karcinómu, mali nižší stage ochorenia v čase diagnózy, nižšiu prevalenciu metastáz, lepšie päťročné prežívanie.18 Popísaný bol aj antiangiogénny efekt statínov.19 Simvastatín v štúdii Aherna a spol. ovplyvňoval rekurenciu a prežívanie na karcinóm prsníka.20 Metaanalýza 26 štúdií ukázala, že dlhoročné užívanie statínu znižuje riziko karcinómu pankreasu.21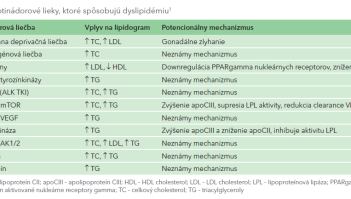
Protinádorové lieky však môžu spôsobiť dyslipidémiu, prehľadne v tab. 1, ktorej závažnosť sa hodnotí stupňami 1 – 5 (tab. 2). Diagnostika závažnej dyslipidémie je dôvodom na prerušenie, alebo dokonca ukončenie onkologickej liečby (napr. pri ALK [anaplastic lymphoma kinase]) TK inhibítormi využívanými v liečbe metastatického nemalobunkového karcinómu pľúc. Lorlatinib je inhibítor ALK 3. generácie indikovaný v liečbe ALK‑pozitívneho metastatického nemalobunkového karcinómu pľúc. Táto špecifická prestavba v géne ALK je prítomná u 0,5 – 3 % pacientov. U 80 % pacientov na liečbe lorlatinibom sa rozvinie hypercholesterolémia, u 60 % hypertriacylglycerolémia (stupeň 3 – 4), a to veľmi skoro po začatí liečby, s mediánom 15 dní (1 – 219 dní). Pri závažnej hypertriacylglycerolémii sa zvyšuje nielen KV riziko, ale hrozí aj rozvoj akútnej pankreatitídy. Liečba lorlatinibom, ktorá je mimoriadne efektívna z hľadiska terapie adenokarcinómu pľúc, musí byť prerušená, niekedy až ukončená. Zásady hypolipidemickej liečby počas protinádorovej terapie prehľadne zobrazuje tab. 3.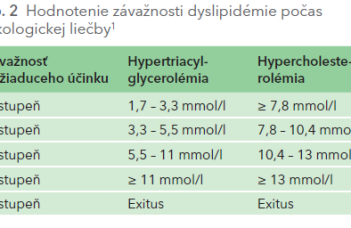
Otvorené otázky kardioonkológie
Napriek odporúčaniam odborných spoločností na niektoré zásadné otázky kardioonkológie stále nemáme odpovede.22 Aký je najlepší nástroj na hodnotenie KV rizika na identifikáciu pacientov, ktorí majú zvýšené riziko rozvoja KVO po prekonaní onkologického ochorenia? Aká je úloha koronárneho kalciového (Agatstonovho) skóre v stratifikácii KV rizika u pacientov s onkologickým ochorením? Má význam testovať sérové koncentrácie lipoproteínu(a), apolipoproteínu B, vysokosenzitívne CRP (hsCRP) u týchto pacientov? Aká je úloha nestatínových terapií, vrátane ezetimibu, inhibítorov PCSK9, kyseliny bempedoovej a kyseliny ikosapentaenovej pri liečbe dyslipidémie u pacientov s onkologickým ochorením?
Záver
Počet vyliečených onkologických pacientov za posledné štyri dekády narástol štvornásobne. Dlhšie ako päť rokov po stanovení diagnózy žije 70 % dospelých a 80 % detských pacientov s nádorovými ochoreniami, ktorí zomierajú častejšie na KVO ako na malignity, čo významne zdôrazňuje dôležitosť survivorshipu a KV prevencie. Diagnostika a manažment dyslipidémie u onkologických pacientov by nemali byť opomínané počas aktívnej onkologickej liečby, ale aj po jej skončení a vyžadujú si multidisciplinárny prístup.
Táto práca bola podporená grantom 011UPJŠ‑4/2023
Literatúra
- de Jesus M, Mohammed T, Singh M, et al. Etiology and Management of Dyslipidemia in Patients With Cancer. Front Cardiovasc Med 2022;9:892335.
- Lyon AR, López‑Fernández T, Couch LS, et al. ESC Scientific Document Group. 2022 ESC Guidelines on cardio‑oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio‑Oncology Society (IC‑OS). Eur Heart J 2022;43:4229–4361. Erratum in: Eur Heart J 2023;44:1621.
- Armenian SH, Lacchetti C, Barac A, et al. Prevention and Monitoring of Cardiac Dysfunction in Survivors of Adult Cancers: American Society of Clinical Oncology Clinical Practice Guideline. J Clin Oncol 2017;35:893–911.
- Armenian SH, Xu L, Ky B, et al. Cardiovascular Disease Among Survivors of Adult‑Onset Cancer: A Community‑Based Retrospective Cohort Study. J Clin Oncol 2016;34:1122–1130.
- Koene RJ, Prizment AE, Blaes A, et al. Shared Risk Factors in Cardiovascular Disease and Cancer. Circulation 2016;133:1104–1114.
- Darby S, McGale P, Peto R, et al. Mortality from cardiovascular disease more than 10 years after radiotherapy for breast cancer: nationwide cohort study of 90 000 Swedish women. BMJ 2003;326:256–257.
- Gulati G, Heck SL, Ree AH, et al. Prevention of cardiac dysfunction during adjuvant breast cancer therapy (PRADA): a 2 × 2 factorial, randomized, placebo‑controlled, double‑blind clinical trial of candesartan and metoprolol. Eur Heart J 2016;37:1671–1680.
- Boekhout AH, Gietema JA, Milojkovic Kerklaan B, et al. Angiotensin II Receptor Inhibition With Candesartan to Prevent Trastuzumab‑Related Cardiotoxic Effects in Patients With Early Breast Cancer: A Randomized Clinical Trial. JAMA Oncol 2016;2:1030–1037.
- Pituskin E, Mackey JR, Koshman S, et al. Multidisciplinary Approach to Novel Therapies in Cardio‑Oncology Research (MANTICORE 101‑Breast): A Randomized Trial for the Prevention of Trastuzumab‑Associated Cardiotoxicity. J Clin Oncol 2017;35:870–877.
- Luo X, Cheng C, Tan Z, et al. Emerging roles of lipid metabolism in cancer metastasis. Mol Cancer 2017;16:76.
- Lochhead P, Chan A. Statins and colorectal cancer. Clin Gastroenterol Hepatol 2013;11:109–118.
- Pose E, Trebicka J, Mookerjee RP, et al. Statins: old drugs as new therapy for liver diseases? J Hepatol 2019;70:194–202.
- Ahern T, Lash T, Christiansen P, et al. Statins and breast cancer prognosis: evidence and opportunities. Lancet Oncol 2014;15:e461–e468.
- Zhang Y, Liang M, Sun C, et al. Statin Use and Risk of Pancreatic Cancer: An Updated Meta‑analysis of 26 Studies. Pancreas 2019;48:142–150.
- Visseren FLJ, Mach F, Smulders YM, et al.; ESC National Cardiac Societies; ESC Scientific Document Group. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J 2021;42:3227–3337. Erratum in: Eur Heart J 2022;43:4468.