Souhra klinické onkologie s chirurgií může některým pacientům s mCRC zajistit dlouhá léta kvalitního života
Možnosti léčby metastatického kolorektálního karcinomu (mCRC) se od přelomu tisíciletí zásadně změnily a tento vývoj dále akceleruje. Objevila se celá řada cílených léčiv, nemocným je vybírána terapie na míru podle molekulárních znaků a v neposlední řadě pro malou skupinu pacientů je indikována imunoterapie. Medián celkového přežití v metastatické fázi se posunul z měsíců na roky, kdy se střídají jednotlivé linie léčby, přechodná období a relapsy v jakémsi kontinuu péče. Stále naléhavěji je proto třeba řešit otázku, co nabídnout pacientům s pokročilým metastatickým onemocněním, kteří vyčerpali léčbu prvních dvou linií. Jednou z možností ve třetí linii je trifluridin/tipiracil. Tento přípravek je schválen také v léčbě pokročilého karcinomu žaludku. Problematice chirurgické a farmakologické léčby mCRC a karcinomu žaludku bylo věnováno satelitní sympozium firmy Servier na letošních Brněnských onkologických dnech.
V onkologii obecně platí, že chirurgická léčba časného onemocnění může být v případné kombinaci s adjuvantní nebo neoadjuvantní léčbou kurabilní, v metastatickém stadiu již chirurgická léčba ztrácí svůj kurabilní význam, nicméně ve vybraných případech, v kombinaci se systémovou terapií, vede k významnému zpomalení progrese onemocnění. V celé řadě indikací přichází v úvahu i metastazektomie, respektive radikálnější resekce metastáz s dobrým výsledkem. Klíčový je v tomto smyslu výběr vhodných kandidátů. O chirurgickém managementu mCRC na setkání hovořil prof. MUDr. Vladislav Třeška, DrSc., z Chirurgické kliniky LF UK a FN v Plzni: „Jaterní metastázy jsou u mCRC vůbec nejčastější, ve IV. klinickém stadiu postihují asi 80 procent pacientů s tím, že u 40 procent se na játra omezují. Synchronní metastázy, tedy přítomné v čase diagnózy, postihují asi 20 až 30 procent pacientů. Využití multimodální léčby s chirurgickou resekcí prodlužuje celkové přežití (OS) na asi pět let, bez resekce se tří let dožívá jen pětina nemocných,“ řekl a pokračoval: „Jaterní metastázy jsou považovány za resekabilní, pokud je splněna radikalita resekce, zůstane dostatečný zbytkový objem jaterní tkáně a nemocný má z operace dlouhodobý profit. To se v současnosti daří asi u pětiny až třetiny pacientů, u kterých jsou jaterní metastázy přítomny. Limity se nicméně posunují a do budoucna by jaterní resekce mohla být možností až u poloviny pacientů. Cílem by měla být resekce s R0 okraji, a tím i lemem zdravé tkáně kolem resekátu. V oblasti kolem velkých cév má ale význam i R1 resekce, pakliže je následována adjuvantní léčbou. Kromě toho pokročilé chirurgické nástroje vlastně odebírají lem kolem ložiska ve velikosti 2–3 mm a ten se sice na histologickém preparátu může jevit jako R1, prakticky se ale jedná o R0.“
Také prof. Třeška zdůraznil, že zásadní je přesná předoperační diagnostika a pečlivý výběr kandidátů pro metastatickou resekabilitu. „Kromě známých negativních prediktivních faktorů se opíráme zejména o zobrazovací metody. Základem je multidetektorové kontrastní CT, uplatňuje se také PET/CT, magnetická rezonance a sonografie, ovšem zcela jednoznačně rovněž s kontrastní látkou. Po jejím podání se totiž senzitivita blíží CT vyšetření. Kromě toho ultrazvuk používáme i intraoperačně. Bohužel při přímém sondování jater během výkonu zachycujeme dosud nezjištěné metastázy až u třetiny nemocných. Naopak do jater intraoperačně podaná fluorescenční látka se zcela neosvědčila, ozřejmí pouze některé povrchové léze. I v chirurgické problematice rozlišujeme pravostranné a levostranné primární CRC, kvůli odlišnému embryonálnímu vývoji pravého a levého tračníku. Vliv stranové lokalizace na úspěšnost chirurgické resekce je zatím nejasný, výsledky studií jsou nejednoznačné. Zajímavá je také otázka systémové léčby v perioperačním období. Zde platí, že pacienti, kteří dobře odpovídají na neoadjuvantní léčbu podle kritérií RECIST, mívají i dobrou prognózu. Na druhou stranu je třeba zdůraznit, že prodlužování neoadjuvance je pro chirurga nepříjemné, protože významně klesá kvalita jaterní tkáně, obtížně se staví krvácení a výrazně stoupá pooperační morbidita. Hranice je u většiny látek šest a více cyklů,“ varoval prof. Třeška.
Trendem moderní chirurgie mCRC jednoznačně jsou jaterní tkáň šetřící výkony jako metastazektomie nebo segmentektomie, velké resekce se uplatňují spíše při mnohočetném rozsáhlém postižení. Šetřící výkony navíc umožňují případnou reresekci po další progresi. Platí přitom, že minimální objem reziduální tkáně je u zdravých jater 20–30 procent, u jater poškozených steatózou nebo chemoterapií 40 procent a více. Funkci jater je třeba otestovat předoperačně specializovanými testy, například dechovými. „Při malém zbytkovém objemu existují techniky, jak ho navýšit. Jedná se například o aplikaci autologních kmenových buněk nebo podvaz portální větve na straně resekce, kdy po 14 dnech dojde k výraznému nárůstu kontralaterální tkáně,“ sdělil prof. Třeška a dodal: „Do portfolia zákroků u mCRC patří rovněž paliativní výkony, prováděné většinou radiofrekvenční nebo mikrovlnnou ablací. Zajímavá je také problematika transplantace jater u neresekovatelných jaterních metastáz bez mimojaterního metastatického poškození. Ta v klinických studiích dosáhla až těžko uvěřitelné účinnosti (například pětileté OS ve studii SECA‑II 75–100 %), prováděna ale byla na maximálně selektované populaci.“
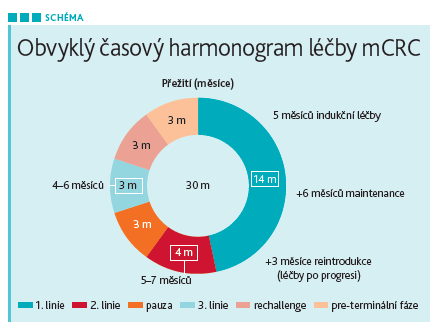
Sekvence paliativních linií u mCRC
Významu sekvence paliativních linií u mCRC se věnoval MUDr. Radim Němeček, Ph.D., z Masarykova onkologického ústavu v Brně: „Výhodou terapie mCRC je, že již máme z čeho vybírat, dostupná je celá řada terapeutických strategií. Ty je třeba zvolit jak na základě vlastností nádoru, včetně histologického typu a přítomnosti molekulárních markerů, tak na základě vlastností pacienta, jeho komorbidit a očekávání. Zároveň musíme zohlednit předléčenost, předpokládanou toxicitu nebo léčebné interakce. Postupy musejí být v souladu s klinickými doporučeními, ať už se jedná o Modrou knihu České onkologické společnosti ČLS JEP, guidelines ESMO, doporučení NCCN nebo další. Zejména guidelines ESMO rozlišují nemocné na ty v celkově v dobrém stavu, tzv. ‚fit‘, a v horším stavu, tedy ‚unfit‘ pro intenzivní systémovou léčbu. Unfit pacientům lze nabídnout šetrnou chemoterapii s fluoropyrimidiny v monoterapii, případně s bevacizumabem, respektive pouze podpůrnou léčbu. Fit pacienti se dále dělí na ty s iniciálně resekabilním onemocněním, u kterých by měla být provedena chirurgická resekce metastatického onemocnění (případně s perioperační chemoterapií při nejasné nebo nepříznivé prognóze), a ostatní. Potenciálně resekabilním pacientům lze nabídnout konverzní léčbu s cílem dosáhnout rychlého downstagingu, její maximální odpověď lze očekávat za tři až čtyři měsíce. Samozřejmostí zde je multidisciplinární přístup a konzultace v rámci MDT setkání, včetně stanovení možných cílů případné terapie,“ vyjmenoval.
U fit pacientů s neresekabilním onemocněním se pokračuje zjištěním molekulárního profilu nádoru a následně se podávají chemoterapeutické sekvence, cílená léčba, respektive jejich kombinace. Dostupné jsou v tomto smyslu inhibitory angiogeneze, inhibitory EGFR nebo HER2 či imunoterapeutika. Cytostatika lze podávat v monoterapii, u pacientů v lepším stavu se obvykle preferuje dvojkombinace označovaná jako dublet (FOLFOX nebo FOLFIRI). Trojkombinace neboli triplet (FOLFOXIRI) sice zlepšuje výsledky jak z hlediska OS, tak čas do progrese (PFS), výrazně ale navyšuje toxicitu, zvažována tak je jen u vysoce selektovaných pacientů ve výborném klinickém stavu, respektive např. u nemocných s mBRAF a podobně. Cílená léčba by měla být zvažována vždy, pokud není kontraindikována. „I zde platí, že kromě samotných biomarkerů je třeba zvážit i optimální výběr pacienta a léčebné sekvence, cílem není jen prodloužení života, ale i zachování jeho kvality. Ve výsledku je tak na základě osobních charakteristik a charakteristik nádoru navrhována osobní a různorodá sekvence léčebných linií, kdy v první a druhé linii pacienti dostávají zpravidla cytostatický dublet nebo triplet doplněný o vhodnou cílenou léčbu, resp. při mikrosatelitární nestabilitě označované jako MSI‑High imunoterapii. Ve třetí linii již variabilita klesá, indikovány jsou dva přípravky – kombinace trifluridin/tipiracilu nebo regorafenib. Čtvrtá a další linie nejsou jasně definovány,“ komentoval MUDr. Němeček.
MUDr. Němeček rovněž upozornil, že řetězení léčebných linií v kontinuu péče je pro zlepšení prognózy nezbytné. Takový postup totiž prodlužuje celkové přežití a již podle práce Hanna et al. (Journal of Clinical Oncology, 2014) platí, že čím více linií léčby mCRC je použito, tím je OS delší. Zároveň se u mCRC medián OS s přibývajícími možnostmi v terapeutickém portfoliu prodloužil od devadesátých let minulého století z jednoho na dva a půl roku, tedy více než dvojnásobně (viz schéma). „Důležité si je uvědomit, že to platí obecně. U vybraných skupin pacientů ale můžeme dosáhnout prodloužení života o mnoho let. Délka podávání jednotlivých linií zpravidla v čase klesá, přesto kumulativně každá další linie život prodlužuje. Reálně do druhé linie vstupuje asi 75 procent nemocných, třetí linie je potom podána asi polovině. V čase se také mění cíle, kterých má léčba dosáhnout. V první linii jde především o prodloužení OS a případně downstaging, v dalších liniích o prodloužení PFS a zlepšení kvality života,“ řekl.
Třetí linii se MUDr. Němeček věnoval podrobněji. Trifluridin/tipiracil i regorafenib dokáží stabilizovat nádorové onemocnění, regrese nádoru se docílí jen ve velmi vybraných klinických případech. Účinek trifluridin/tipiracilu v tomto nastavení byl u mCRC popsán v klinické studii RECOURSE, uveřejněné v roce 2015 v NEJM. Ve dvojitě zaslepené studii III. fáze bylo randomizováno celkem 800 nemocných v poměru 2 : 1 buď k trifluridin/tipiracilu, nebo k placebu. Podávání aktivní látky prodloužilo v této vysoce předléčené populaci primární sledovaný parametr OS z 5,3 měsíce na 7,1 měsíce a HR pro úmrtí v aktivní větvi bylo 0,68 (p < 0,001). Medián času do zhoršení PS skóre byl 5,7 vs. 4,0 měsíce (HR = 0,66, p < 0,001). Podávání regorafenibu ve stejné indikaci se věnovala randomizovaná, placebem kontrolovaná studie CORRECT. Aktivní látka v ní prodloužila medián OS z 5,0 na 6,4 měsíce. „Obě látky tak prodlužují celkové přežití a jsou zcela v souladu s filosofií dlouhodobého kontinua péče o nemocné s mCRC. Rozdílný je jejich profil nežádoucích účinků. Regorafenib má klinicky hmatatelnou toxicitu s kožními reakcemi, průjmy a celkovou slabostí, které výrazně zasahují do kvality života nemocných. Léčbu trifluridinem/tipiracilem provází spíše hematologická toxicita s neutropenií a anémií, která je dobře řešitelná růstovými faktory a podpůrnou léčbou. Četnost obávané febrilní neutropenie je při léčbě touto látkou nízká,“ upozornil MUDr. Němeček.
Ačkoli bylo prodloužení OS ve studii RECOURSE v řádu jednotek měsíců, na individuální úrovni u některých pacientů vedlo podávání trifluridin/tipiracilu k poměrně zásadnímu prodloužení přežití. V tomto smyslu MUDr. Němeček přiblížil exploratorní post hoc analýzu kohorty této studie, která stratifikovala nemocné podle prognostických faktorů. Pacienti byli rozděleni na ty s dobrými prognostickými charakteristikami s maximálně dvěma metastatickými lokalizacemi a časem od diagnózy do prvních metastáz přesahujícím 18 měsíců (n = 386) a na ty se špatnými prognostickými znaky, kteří měli metastáz více a objevily se rychleji (n = 414). Ze skupiny s příznivými znaky byla ještě vyčleněna skupina s nejlepšími znaky, u kterých nebyly přítomny žádné jaterní metastázy (n = 153). „Zatímco ve skupině se špatnými prognostickými znaky byl rozdíl mezi aktivní léčbou a podáváním placeba minimální (5,3 vs. 4,4 měsíce), ve skupině s dobrými znaky se křivky začaly mnohem více separovat (9,3 vs. 6,8 měsíce) a u pacientů s nejlepšími znaky se délka mediánu OS při podávání trifluridin/tipiracilu i v této pokročilé linii téměř zdvojnásobila (16,4 vs. 8,6 měsíce),“ popsal a dodal: „Účinnost podávání trifluridin/tipiracilu v reálné klinické praxi potvrdila jednoramenná klinická studie PRECONNECT. Zúčastnilo se jí celkem 793 subjektů, kterým byla látka podávána po medián 2,84 měsíce. Užívání trifluridin/tipiracilu vedlo k mediánu PFS 2,8 měsíce s tím, že nedošlo k žádnému relevantnímu snížení kvality života.“
Své sdělení ilustroval MUDr. Němeček kazuistikou, která se týkala 63letého muže. Tomu byl v březnu roku 2013 diagnostikován RAS mutovaný adenokarcinom colon transversum s metastatickým rozsevem na peritoneu. O měsíc později byla provedena resekce primárního nádoru a mnohočetná peritoneální metastazektomie. „V první linii obdržel v roce 2016 šest sérií režimu XELOX. Po progresi následovala druhá linie, v období od června do září 2014 dostával FOLFIRI s bevacizumabem, dále do února 2015 jen FOLFIRI a v období únor 2015 až duben 2016 kapecitabin v monoterapii. Po opětovné progresi se přešlo do třetí linie, zvolen pro ni byl trifluridin/tipiracil, na kterém bylo dosaženo stabilizace refrakterního onemocnění s metastázami peritonea. Látka byla podávána po celkem 38 sérií v období červen 2016 až srpen 2019. Celková délka léčby ve třetí linii tak přesáhla neuvěřitelné tři roky,“ dodal.
Možnosti léčby metastatického karcinomu žaludku
O moderních možnostech léčby metastatického karcinomu žaludku hovořila na setkání MUDr. Radka Obermannová, Ph.D., z Masarykova onkologického ústavu v Brně: „Karcinom žaludku představuje páté nejčastější nádorové onemocnění a čtvrtou nejčastější příčinu úmrtí na zhoubný novotvar. Jeho pětileté přežití dosahuje 32,4 procenta. V případě karcinomu žaludku jsou terapeutické možnosti dosud spíše omezené, poslední nová látka, která prokázala prodloužení OS, byl na dlouhou dobu v roce 2010 trastuzumab u HER2 pozitivních nemocných ve studii TOGA. To se nyní změnilo s novou studií CHECKMATE‑649, ve které bylo porovnáváno podávání nivolumabu a chemoterapie nebo ipilimumabu se samotnou chemoterapií.“
Do studie CHECKMATE‑649 byli zařazeni pacienti s pokročilým nebo metastatickým HER2 negativním adenokarcinom žaludku nebo gastroezofageální junkce. Ve větvi s nivolumabem a chemoterapií došlo k signifikantnímu prodloužení OS zejména u pacientů s PD‑L1 CPS (kombinované pozitivní skóre) ≥ 5 (14,4 vs. 11,1 měsíce), imunoterapie by se tak u vybraných pacientů měla stát zlatým standardem v první linii, což již reflektují také indikační kritéria Evropské lékové agentury. Na letošním ESMO byla nově prezentována data z ramene léčeného kombinací nivolumabu a ipilimumabu. Ta nepřinesla z hlediska OS oproti samotné chemoterapii u neselektované populace benefit. Novinkou ale byla také analýza dle přítomnosti deficientního mismatch repair systému MSI‑high, přítomného u asi tří až pěti procent pacientů. Ukázalo se, že tito pacienti jsou k imunoterapii obzvláště citliví; zatímco ve větvi se samotnou chemoterapií dosáhl medián OS jen 10 měsíců, ve větvi s nivolumabem a ipilimumabem ho nebylo během sledování trvajícího více než 50 měsíců dosaženo. „Kromě úspěchu imunoterapie u nemocných s vyšším PD‑L1 CPS nebo MSI‑high byla na letošním ESMO prezentována třeba studie, která popsala superioritu konjugovaného přípravku trastuzumab‑deruxtecan u nemocných s HER2 pozitivním karcinomem žaludku. K inovacím tak i v kontextu této složité diagnózy dochází. Bohužel jejich implementace do českých doporučení a zejména indikací hrazených z veřejného zdravotního pojištění probíhá pomalu a zaostává oproti doporučením mezinárodním, především NCCN,“ kritizovala MUDr. Obermannová.
V České republice se nyní v první linii zahajuje terapie dubletem chemoterapie, eventuálně tripletem u potenciálně resekabilního onemocnění. „Ve světle dat z ESMO doufáme v brzké zavedení checkpoint inhibitoru v první linii dle PD‑L1 CPS skóre a upevnění pozice trastuzumabu dle pozitivity HER2. Ve druhé linii šlo ještě donedávna pacientům podle dosaženého skóre PS nabídnout buď ramucirumab s paklitaxelem, respektive ramucirumab v monoterapii, nebo chemoterapii založenou na irinotekanu, paklitaxelu, docetaxelu nebo FOLFIRI. První možnost bohužel nedávno vypadla a o ramucirumab je nutné žádat pomocí paragrafu 16. Podobná je také situace ve třetí linii. Tam se globálně nabízí kombinace trifluridin/tipiracilu, který ve studii TAGS prokázal na vysoce předléčené populaci prodloužení mediánu OS oproti placebu z 3,8 na 5,7 měsíce. Nicméně o trifluridin/tipiracil je nutné rovněž individuálně žádat revizního lékaře. Dostáváme se tak do situace, kdy teoreticky máme k dispozici léčbu, která prokázala efekt a pro udržení léčebné sekvence ji potřebujeme, bohužel ale není plošně dostupná,“ dodala MUDr. Obermannová.