Sukrosomální železo – inovativní forma železa s vysokou vstřebatelností a dobrou snášenlivostí
Deficit železa je častým jevem i v západních zemích a je zodpovědný za vznik až poloviny případů anémie. K suplementaci železa při jeho deficitu jsou v závislosti na klinické situaci využívány perorálně nebo intravenózně podávané přípravky. Inovativním perorálním přípravkem je sukrosomální železo, které obsahuje pyrofosfát železitý v obalu z esterů sacharózy. Sukrosomální železo se vyznačuje specifickými strukturálními, fyzikálně‑chemickými a farmakokinetickými vlastnostmi, jež jsou podkladem jeho zvýšené vstřebatelnosti a biologické dostupnosti a dobré gastrointestinální snášenlivosti. V klinických studiích byla účinnost sukrosomálního železa v různých klinických situacích vyšší v porovnání s jinými formami perorálně podávaného železa a přinejmenším srovnatelná s intravenózním železem.
Úvod
 Železo je biogenní stopový prvek, který se uplatňuje při buněčném dýchání, proliferaci a diferenciaci, je nezbytný pro normální fungování imunitního systému, energetický metabolismus a především pro tvorbu červených krvinek a hemoglobinu (Hb).1 Anémie postihuje čtvrtinu až třetinu celosvětové populace (její prevalence se však v různých geografických regionech značně liší), přičemž až polovina případů anémie vzniká na podkladě deficitu železa (ID).2,3 Příčiny ID jsou ovlivněny věkem, pohlavím a socioekonomickým statusem; obecně zahrnují zvýšené nároky organismu, snížený příjem či absorpci nebo zvýšené ztráty (tab. 1). V západních zemích se ID objevuje nejčastěji u pacientů s chronickými zánětlivými onemocněními (např. střevními záněty) a dalšími chronickými onemocněními (zejména ledvin) nebo malignitami, u osob podstupujících chirurgický výkon a u žen se silným menstruačním krvácením či v těhotenství.
Železo je biogenní stopový prvek, který se uplatňuje při buněčném dýchání, proliferaci a diferenciaci, je nezbytný pro normální fungování imunitního systému, energetický metabolismus a především pro tvorbu červených krvinek a hemoglobinu (Hb).1 Anémie postihuje čtvrtinu až třetinu celosvětové populace (její prevalence se však v různých geografických regionech značně liší), přičemž až polovina případů anémie vzniká na podkladě deficitu železa (ID).2,3 Příčiny ID jsou ovlivněny věkem, pohlavím a socioekonomickým statusem; obecně zahrnují zvýšené nároky organismu, snížený příjem či absorpci nebo zvýšené ztráty (tab. 1). V západních zemích se ID objevuje nejčastěji u pacientů s chronickými zánětlivými onemocněními (např. střevními záněty) a dalšími chronickými onemocněními (zejména ledvin) nebo malignitami, u osob podstupujících chirurgický výkon a u žen se silným menstruačním krvácením či v těhotenství.
Významnou rizikovou skupinou jsou senioři, kteří jsou anémií z deficitu železa ohroženi z mnoha důvodů. Je u nich častější nutriční deficit, velmi často mají chronické zánětlivé onemocnění, probíhá u nich skrytě pokles renálních funkcí a jsou mnohem náchylnější k chronickým ztrátám krve (např. z důvodu NSA gastropatie). Klinické studie ukazují, že anémií trpí 20–30 % seniorů a její výskyt roste s věkem. V jedné observační studii představoval tento podíl až 50 % všech seniorů starších 70 let, kteří byli přijati na pohotovost.
U pacientů s normální hodnotou Hb lze deficit železa předpokládat v případě snížené hodnoty MCH (mean corpuscular hemoglobin; fyziologické rozmezí 28–35 pg) nebo zvýšené hodnoty RDW (red cell distribution width; fyziologické rozmezí 11–15). Pro přítomnost ID je ovšem určující sérová koncentrace feritinu < 30 ng/ml, resp. sérová koncentrace feritinu < 100 ng/ml a saturace transferinu < 20 %. Naproti tomu hodnoty feritinu > 100 ng/ml při saturaci transferinu < 20 % spíše svědčí pro sekvestraci železa a jeho funkční deficit. Feritin patří mezi proteiny akutní fáze, jeho koncentrace se proto zvyšuje u zánětlivých stavů. V takových případech lze na přítomnost ID usuzovat na základě jiných parametrů, jako jsou nízký obsah Hb v retikulocytech (< 28 pg), zvýšený podíl hypochromních erytrocytů (> 5 %) nebo zvýšený poměr solubilní transferinový receptor/feritin.4
Léčba deficitu železa
Základem léčby deficitu železa by měla být snaha o identifikaci a řešení příčiny tohoto stavu spolu s perorálním či intravenózním podáváním železa, popřípadě krevních transfuzí, v závislosti na hodnotách hemoglobinu, snášenlivosti a komorbiditách pacienta.
V první linii léčby nekomplikovaného ID se obvykle využívá perorální suplementace pomocí železnatých nebo železitých solí, která se vyznačuje dostupností, snadným podáváním a nízkou cenou. Železo je rovněž dostupné v kombinaci s jinými účinnými látkami, nejčastěji s vitaminy a minerály.5 Perorální železo se užívá ve vysokých dávkách (100–200 mg elementárního železa) 1–3krát denně. Jeho biologická dostupnost je nízká (10–15 % u přípravků s obsahem dvojmocného železa, a ještě nižší u solí trojmocného železa) a jeho vstřebávání může být blokováno různými složkami potravy (fytáty, škrob, taniny) či léky (inhibitory protonové pumpy, antacida). Až u 50 % pacientů (v závislosti na typu užívaného přípravku) se vyskytují gastrointestinální (GI) nežádoucí účinky, které vedou ke snížené adherenci k léčbě, a tím též k její nedostatečné účinnosti. Řešením může být podávání nižších denních dávek (40–60 mg/den) nebo podávání středních dávek (80–100 mg) obden.3
V případě nedostatečné účinnosti nebo nesnášenlivosti perorálně podávaného železa se podávají intravenózní přípravky (glukonan sodnoželezitý, železitá sůl sacharózy, karboxymaltózy nebo derisomaltózy), jejichž účinnost z hlediska korekce deficitu železa je závislá na dávce. Preferovány jsou novější přípravky (např. železitá sůl karboxymaltózy), které umožňují aplikaci vysokých dávek železa (1 000 mg či více) během kratšího časového intervalu (15–60 minut). Intravenózní přípravky s obsahem železa jsou však nákladnější, vyžadují žilní přístup a monitorování během aplikace – jejich podávání může být spojeno s výskytem infuzních a hypersenzitivních reakcí. Mimoto, údaje o jejich dlouhodobé bezpečnosti jsou, s výjimkou léčby pacientů s chronickým onemocněním ledvin, zatím poměrně omezené.
Sukrosomální železo
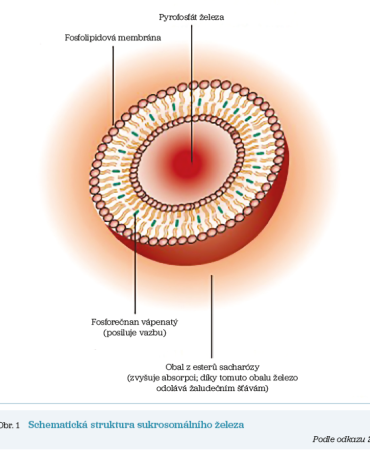 Sukrosomální železo (sucrosomial iron, SI) je inovativní léčebný přípravek, který byl navržen s cílem zvýšení biologické dostupnosti, snížení dávek a zlepšení snášenlivosti perorálně podávaného železa. V tomto přípravku je železo ve formě pyrofosfátu uloženo v tzv. sukrosomu, tedy jakési kapsli tvořené fosfolipidovou dvojvrstvou (obsahující zejména lecitin) a sukresterovou matrix (sukrester je surfaktant vzniklý esterifikací mastných kyselin a sacharózy, který snižuje rezistenci intestinální bariéry, čímž zvyšuje transcelulární a paracelulární průnik látek, a tedy jejich absorpci); pro zvýšení stability jsou přítomny též další složky jako fosforečnan vápenatý a škrob (obr. 1).6 Díky tomuto uspořádání je dosaženo tzv. gastrorezistence, tj. absence odbourávání železa v žaludku (množství uvolněného železa ze sukrosomu bylo ve studii in vitro < 5 %),7 a částice se téměř intaktní dostává ke střevní sliznici, kde probíhá její vstřebávání. Díky přítomnosti sukresterové matrix nedochází k redukci trojmocného železa ferireduktázou na dvojmocné a přestup do enterocytu probíhá mechanismy nezávislými na přenašeči DMT1 (divalent metal transporter 1) – díky fosfolipidové a sukresterové vrstvě je sukrosomální železo, na rozdíl od perorálně podávaných iontů železa, absorbováno podobně jako vezikula paracelulárně a transcelulárně. Pozoruhodné je, že v absorpci SI jsou zapojeny rovněž M buňky Peyerových plaků. Peyerovy plaky jsou tvořeny shluky lymfoidních folikulů obsahujících imunitní buňky a jsou součástí slizničního imunitního systému; M buňky jsou speciální epiteliální buňky, jejichž úkolem je vzorkování antigenů a jejich transport k buňkám přilehlé lymfatické tkáně, což se děje zejména pomocí transcytózy – a právě tímto mechanismem přispívají M buňky také ke vstřebávání SI.2,8
Sukrosomální železo (sucrosomial iron, SI) je inovativní léčebný přípravek, který byl navržen s cílem zvýšení biologické dostupnosti, snížení dávek a zlepšení snášenlivosti perorálně podávaného železa. V tomto přípravku je železo ve formě pyrofosfátu uloženo v tzv. sukrosomu, tedy jakési kapsli tvořené fosfolipidovou dvojvrstvou (obsahující zejména lecitin) a sukresterovou matrix (sukrester je surfaktant vzniklý esterifikací mastných kyselin a sacharózy, který snižuje rezistenci intestinální bariéry, čímž zvyšuje transcelulární a paracelulární průnik látek, a tedy jejich absorpci); pro zvýšení stability jsou přítomny též další složky jako fosforečnan vápenatý a škrob (obr. 1).6 Díky tomuto uspořádání je dosaženo tzv. gastrorezistence, tj. absence odbourávání železa v žaludku (množství uvolněného železa ze sukrosomu bylo ve studii in vitro < 5 %),7 a částice se téměř intaktní dostává ke střevní sliznici, kde probíhá její vstřebávání. Díky přítomnosti sukresterové matrix nedochází k redukci trojmocného železa ferireduktázou na dvojmocné a přestup do enterocytu probíhá mechanismy nezávislými na přenašeči DMT1 (divalent metal transporter 1) – díky fosfolipidové a sukresterové vrstvě je sukrosomální železo, na rozdíl od perorálně podávaných iontů železa, absorbováno podobně jako vezikula paracelulárně a transcelulárně. Pozoruhodné je, že v absorpci SI jsou zapojeny rovněž M buňky Peyerových plaků. Peyerovy plaky jsou tvořeny shluky lymfoidních folikulů obsahujících imunitní buňky a jsou součástí slizničního imunitního systému; M buňky jsou speciální epiteliální buňky, jejichž úkolem je vzorkování antigenů a jejich transport k buňkám přilehlé lymfatické tkáně, což se děje zejména pomocí transcytózy – a právě tímto mechanismem přispívají M buňky také ke vstřebávání SI.2,8
Vzhledem k výše popsaným třem způsobům absorpce se sukrosomální železo vyznačuje vysokou biologickou dostupností, což souvisí i s jeho vysokou účinností stran úpravy koncentrace feritinu a hemoglobinu. Biologická dostupnost byla studována u zdravých myší, jimž byl podáván pyrofosfát železitý nebo SI, měřeny byly koncentrace trojmocného železa v krvi v průběhu času (5 h). Po prvních třech hodinách byly koncentrace trojmocného železa v krvi vyšší u zvířat léčených SI, plocha pod křivkou (AUC) a maximální plazmatická koncentrace železa (Cmax) byly rovněž signifikantně vyšší ve skupině s SI. Po pěti hodinách bylo u zvířat léčených SI (nikoliv však ve druhé skupině) naměřeno zvýšení obsahu trojmocného železa v játrech a kostní dřeni.2,9 Ve studii in vitro vedlo podání SI k trojnásobnému zvýšení akumulace feritinu v buněčných liniích v porovnání se síranem železnatým (FS) a k 3,5násobnému zvýšení akumulace feritinu v porovnání s lipozomálním pyrofosfátem železitým (Lipofer) či mikronizovaným dispergovatelným pyrofosfátem železitým (SunActive), tedy rovněž inovativními lékovými formami navrženými s cílem zvýšení vstřebatelnosti železa.10
Účinnost sukrosomálního železa
Jak je patrné, sukrosomální železo má specifické strukturální, fyzikálně‑chemické a farmakokinetické charakteristiky, díky nimž se vyznačuje vysokou biologickou dostupností a velmi dobrou GI snášenlivostí. Lze jej tak s výhodou využít v terapii deficitu železa v nejrůznějších klinických situacích.
Chronické srdeční selhání
Deficit železa (s anémií či bez ní) je nacházen až u 50 % pacientů s chronickým srdečním selháním (CHF) a jeho přítomnost je spojena se sníženou fyzickou výkonností pacientů, zhoršenou kvalitou života i zvýšenou mortalitou, a obecně tak s horší prognózou. Evropskou kardiologickou společností (ESC) je proto silně doporučena léčba ID u nemocných s chronickým srdečním selháním. Provedeno bylo několik studií, které prokázaly přínos intravenózní suplementace železa u nemocných s CHF s ohledem na zlepšení fyzické výkonnosti, kvality života a funkční klasifikace NYHA (New York Heart Association), některé studie demonstrovaly rovněž snížení frekvence rehospitalizací pro zhoršení CHF. Objevují se však také studie, které dokládají, že účinnou a bezpečnou alternativou intravenózní suplementace může být právě podávání SI. V pilotní studii u 30 pacientů s CHF na stabilní farmakoterapii dle nejnovějších doporučení a ID (s anémií nebo bez ní) bylo 20 nemocných léčeno SI (30 mg denně) po dobu tří měsíců, 10 pacientů bylo bez suplementace železa (kontroly). Po třech měsících bylo při terapii SI dokumentováno zlepšení parametrů metabolismu železa v porovnání s výchozími hodnotami, koncentrace Hb zůstaly stabilní. Došlo však k signifikantnímu zlepšení kvality života (skóre dotazníku KCCQ vzrostlo z 55,7 na 61,8; p = 0,038) a byl patrný trend ke zlepšení fyzické výkonnosti (změna z 318 m na 332 m v 6minutovém testu chůze; p = 0,065) a k poklesu hodnoty mozkového natriuretického peptidu (BNP) (z 643 ng/l na 535 ng/l; p = 0,360), přičemž nebyly hlášeny žádné nežádoucí účinky. V kontrolní skupině nebyla pozorována změna žádného z hodnocených parametrů.11
Onkologická onemocnění
U nemocných s malignitami se často vyskytuje ID i IDA. Jejich přítomnost by měla být vyšetřována u všech pacientů s onkologickým onemocněním, především u těch, u nichž je plánována chemoterapie, radioterapie či chirurgický výkon. Dle doporučení ESMO (European Society for Medical Oncology) by pacienti s anémií indukovanou chemoterapií (CIA) (hodnoty Hb ≤ 11 g/dl nebo pokles Hb o ≥ 2 g/dl od výchozí hodnoty ≤ 12 g/dl) a absolutním ID (sérový feritin < 100 ng/ml) měli být léčeni železem k úpravě ID. V retrospektivní studii u nemocných s CIA bez ID či funkčního ID byl porovnáván vliv perorální suplementace SI (30 mg denně) (n = 33) vs. intravenózní aplikace glukonátu železitého (FG, 125 mg týdně) (n = 31) na odpověď Hb při podávání darbepoetinu, přičemž po osmi týdnech byla v obou skupinách zaznamenána podobná četnost odpovědí Hb (70 % pro SI vs. 71 % pro FG), stejný počet podaných transfuzí (n = 1) a srovnatelný vliv na kvalitu života.12
Chronická renální insuficience
Deficit železa je jednou z vedoucích příčin anémie u pacientů s chronickým onemocněním ledvin (CKD), základem její léčby je proto suplementace železa spolu s aplikací přípravků stimulujících erytropoezu (ESA).
Co se týká SI, jeho účinnost z hlediska udržení, resp. zvýšení hodnot Hb, feritinu a saturace transferinu byla potvrzena v sériích kazuistik u pacientů s (většinou mírnou) anémií s CKD bez potřeby dialýzy, a to téměř bez výskytu GI nežádoucích účinků. V randomizované otevřené studii bylo 99 pacientů s CKD bez potřeby dialýzy s anémií na podkladě ID v poměru 2 : 1 náhodně přiřazeno k podávání SI (30 mg denně), nebo intravenózního FG (125 mg týdně) po dobu tří měsíců. Po čtyřech měsících od začátku studie byly hodnoty Hb v obou skupinách podobné (11,4 g/dl vs. 11,7 g/dl), zásoby feritinu byly vyšší ve skupině s intravenózním FG (86 ng/ml vs. 239 ng/ml; p < 0,05). Po vysazení FG zůstaly hodnoty Hb stabilní, naproti tomu po vysazení SI klesly na výchozí hodnotu. Při perorální léčbě bylo hlášeno signifikantně méně nežádoucích účinků (p < 0,001), adherence k léčbě byla v obou skupinách podobná.13
Zánětlivá onemocnění gastrointestinálního systému
Anémie je nejčastější systémovou komplikací zánětlivých střevních onemocnění (IBD), celiakie a autoimunitní atrofické gastritidy, nejčastěji se vyskytuje u pacientů s Crohnovou chorobou.2 U nemocných s IBD je perorální suplementace železa problematická, neboť často vede ke zhoršení symptomů – to je zřejmě důsledkem oxidačního stresu indukovaného železem a zejména narušení složení a diverzity mikrobiomu. U pacientů s IBD a ID se proto obvykle doporučuje intravenózní suplementace železa. Jak se však ukazuje, alternativou mohou být i perorální formy se zlepšenou snášenlivostí, jako je SI či maltol železitý. V sériích kazuistik pacientů s IBD a mírnou až střední IDA (n = 92, z toho 46 pacientů netolerovalo FS) se ukázalo, že SI (30–60 mg denně po dobu 2–3 měsíců) je účinné při zvyšování koncentrace Hb, feritinu i saturace transferinu, a to při velmi nízkém výskytu GI nežádoucích účinků. Ve srovnávací studii byla účinnost SI (30–60 mg denně po dobu 2–3 měsíců) při zvyšování hodnoty Hb vyšší než účinnost FS (105–210 mg denně) (průměrná změna Hb +2,7 g/dl vs. +1,4 g/dl) navzdory nižším elementárním dávkám železa a srovnatelná s účinností intravenózní sacharózy železa (100 mg, celková dávka 500–1 000 mg) (průměrná změna Hb +1,7 g/dl vs. +1,8 g/dl).14,2
Jiná interní onemocnění a krvácení
Bylo zjištěno, že pacienti hospitalizovaní na interních odděleních (zejména starší osoby, s více komorbiditami) mají často anémii, která nezřídka zůstává nediagnostikována a neléčena, přestože může výrazným způsobem zvyšovat hospitalizační mortalitu.2 Je proto zapotřebí cíleně pátrat po přítomnosti anémie a ID a pacientům poskytnout adekvátní léčbu. Krvácení je rovněž častou příčinou anémie u pacientů hospitalizovaných na interních odděleních. Obvyklou léčbou je podávání transfuzí, řešením však může být i suplementace železa. Byla provedena studie u 90 nemocných se středně těžkou až těžkou IDA v důsledku gastrointestinálního nebo gynekologického krvácení (z nenádorových příčin), u nichž selhala suplementace pomocí FS. Pacienti byli randomizováni k léčbě vysokou dávkou SI (120 mg denně po dobu 1 měsíce), nebo k terapii intravenózním FG (62,5 mg denně). Oba typy léčby byly stejně účinné stran zvyšování koncentrace Hb (12,0 g/dl vs. 12,5 g/dl po 4 týdnech), náklady na léčbu byly dle očekávání významně nižší ve skupině se SI. Frekvence nežádoucích účinků byla v obou skupinách srovnatelná a ani v jedné skupině nebylo nutné podání krevní transfuze.15 V jiné multicentrické studii bylo 300 pacientů se středně těžkou až těžkou IDA v důsledku žaludečního (44 %) nebo střevního (56 %) krvácení randomizováno k perorální suplementaci železa (60 mg elementárního železa) ve formě FS, mikroenkapsulovaného (lipozomálního) pyrofosfátu železitého, mikronizovaného pyrofosfátu železitého, SI a dvou forem bisglycinátu železnatého. Podávání SI v porovnání s jakýmkoli jiným perorálním železem vedlo ke konzistentně vyšším nárůstům hodnoty Hb od šestého týdne, a to jak v celém souboru pacientů, tak v podskupině nemocných s elevací hodnot C‑reaktivního proteinu (CRP).16
Závěr
Sukrosomální železo je inovativní lékovou formou železa s unikátními strukturálními, fyzikálně‑chemickými a farmakokinetickými charakteristikami. Přítomnost sukresterového obalu uděluje sukrosomálnímu železu gastrorezistenci, chrání trojmocné pyrofosfátové železo před enzymatickou redukcí a podporuje jeho absorpci cestami nezávislými na transportéru DMT‑1 – paracelulárně, transcelulárně a prostřednictvím M buněk střevní sliznice. Díky tomu se SI vyznačuje vysokou biologickou dostupností železa a nízkou gastrointestinální toxicitou. Sukrosomální železo se tak jeví jako lék volby u pacientů s nekomplikovaným deficitem železa, a to zejména u osob s nesnášenlivostí nebo nedostatečnou účinností jiných perorálně podávaných solí železa. Kromě toho by mělo být SI považováno za alternativu k intravenózně podávanému železu (SI je jediným perorálně podávaným přípravkem s obsahem železa, který není inferiorní vůči intravenózně podávanému železu).
MUDr. Tomáš Doležal, Ph.D.
Institut pro zdravotní ekonomiku a technology assessment (iHETA), Praha
Literatura
- Sedláčková T, Racek J. Metabolismus železa a jeho regulace. Klin Biochem Metab 2009;17:17–23.
- Gómez‑Ramírez S, Brilli E, Tarantino G, et al. Sucrosomial® iron: a new generation iron for improving oral supplementation. Pharmaceuticals (Basel) 2018;11:97.
- Warner MJ, Kamran MT. Iron deficiency anemia. [Updated 2020 Aug 10]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020.
- Muñoz M, Acheson AG, Auerbach M, et al. International consensus statement on the peri‑operative management of anaemia and iron deficiency. Anaesthesia 2017;72:233–247.
- Slíva J. Železo a jeho využití v organismu. Remedia 2013;23:354–357.
- West AR, Oates PS. Mechanisms of heme iron absorption: current questions and controversies. World J Gastroenterol 2008;14:4101–4110.
- Brilli E, Romano A, Fabiano A, et al. Sucrosomial® technology is able to promote ferric iron absorption: Pre‑clinical and clinical evidences. Blood 2016;128:3618.
- Mabbott NA, Donaldson DS, Ohno H, et al. Microfold (M) cells: Important immunosurveillance posts in the intestinal epithelium. Mucosal Immunol 2013;6:666–677.
- Brilli E, Barnadas R, Camacho M, et al. G. Sucrosomial® iron absorption involves M cells interaction. In Proceedings of the European Iron Club Annual Meeting, Zürich, Switzerland, 8–11 February 2018; p. 51.
- Tarantino G, Brilli E, Zambito Y, et al. Sucrosomial® iron: A new highly bioavailable oral iron supplement. Blood 2015;126:4561–4562.
- Karavidas A, Trogkanis E, Farmakis D, et al. Oral sucrosomial iron improves quality of life in heart failure patients with iron deficiency: a preliminary proof of‑concept study. Eur J Heart Fail 2018;20(Suppl. S1):89.
- Mafodda A, Giuffrida D, Prestifilippo A, et al. Oral Sucrosomial® iron versus intravenous iron in anemic cancer patients without iron deficiency receiving darbepoetin alfa: A pilot study. Support Care Cancer 2017;25:2779–2786.
- Pisani A, Riccio E, Sabbatini M, et al. Effect of oral liposomal iron versus intravenous iron for treatment of iron deficiency anaemia in CKD patients: A randomized trial. Nephrol Dial Transplant 2015;30:645–652.
- Bastida G. Efficacy and tolerability of Sucrosomial iron supplementation in IBD patients with iron deficiency anemia and intolerance to iron oral salts. Exp Rev Hematol 2016;9(Suppl. S1):6–8.
- Giordano G. Oral high‑dose Sucrosomial® iron vs. intravenous iron in sideropenic anemia intolerant/refractory to iron sulfate. Multicentric randomized study. Exp Rev Hematol 2016;9(Suppl. S1):15–17.
- Giordano G, Parente A, Berardi D, et al. Effectiveness of different oral iron formulations in iron deficiency anemia due to gastrointestinal bleeding: multicentric randomized study; European Hematology Association: Stockholm, Sweden, 2018.