Úskalí při péči o pacienty s revmatoidní artritidou v běžné klinické praxi
Souhrn
Revmatoidní artritida (RA) je závažné chronické autoimunitní onemocnění s vysokou morbiditou a mortalitou. Výrazné zlepšení v péči o tyto pacienty přinesly biologické léky modifikující průběh onemocnění (biologic Disease Modifying Antirheumatic Drugs, bDMARDs) a cílené syntetické DMARDs (targeted synthetic DMARDs, tsDMARDs). Jsou podávány v centrech biologické léčby.
Pacienti s RA a především pacienti s vyšší aktivitou RA a komorbiditami by měli být optimálně v péči nejen revmatologa, ale i celého širšího týmu, včetně praktického lékaře, internisty a fyzioterapeuta.
Cílem článku je pojmenovat nejčastější problémy, které při péči o tyto pacienty nastávají. Jako první bod je nastolena otázka záchytu těchto pacientů, transferu na specializované oddělení a diagnostiky časných forem. V další části je pak probírána charakteristika jednotlivých DMARDs, možné nežádoucí účinky a úloha praktického lékaře či internisty při monitorování bezpečnosti těchto léků. Samostatný odstavec je věnován vlivu biologických léků na kardiovaskulární riziko pacientů s revmatickými onemocněními. Diskutována je také otázka výskytu onemocnění COVID‑19 u revmatických pacientů a strategie jejich léčby a ošetřování a také problematika jejich očkování.
Klíčová slova: revmatoidní artritida • biologická léčba • cílená syntetická léčba
Summary
Rheumatoid arthritis (RA) is a serious, chronic, autoimmune disease with high morbidity and mortality. Disease Modifying Antirheumatic Drugs (bDMARDs) and targeted synthetic drugs (tsDMARDs) have brought significant improvements in the care of these patients. They are administered in the centers for biological treatment.
Patients with RA and especially patients with higher RA activity and comorbidities should be optimally in the care not only of a rheumatologist, but also of the entire wider team, including a general practitioner, internist and physiotherapist.
The aim of the article is to name the most common problems that occur when caring for these patients. The first point is the question of the capture of these patients, the transfer to a specialized department and the diagnosis of early forms. The next section discusses the characteristics of individual DMARDs, possible side effects and the role of the general practitioner or internist in monitoring the safety of these drugs. A separate paragraph is devoted to the effect of biological drugs on the cardiovascular risk of patients with rheumatic diseases. The question of the incidence of COVID‑19 in patients with RA and the strategy of their treatment and care is also discussed, as well as the issue of their vaccination.
Key words: rheumatoid arthritis • biological treatment • targeted synthetic treatment
Úvod
Revmatoidní artritida (RA) je chronické zánětlivé, autoimunitní onemocnění, které může vést ke vzniku kloubních deformit, k destrukci kloubů vyžadující náhradu, dále pak zapříčiňuje zhoršení funkce a kvality života nemocných s RA.1 Závažné mohou být i tzv. mimokloubní projevy a komorbidity u RA, jako je plicní fibróza, vaskulitida, amyloidóza, zvýšené riziko infekcí a zvýšené kardiovaskulární riziko.2 RA také zkracuje střední délku života svých nositelů o 5–7 let.
Terapie RA prošla v posledních 30 letech obrovským vývojem. Dá se zjednodušeně říci, že jsme přešli v podstatě od paliativní léčby k účinné léčbě, která je schopna robustně, rychle a někdy i dlouhodobě potlačit zánětlivou aktivitu RA. Potlačení aktivity RA imunosupresivní či imunomodulační léčbou je základním cílem všech terapeutických algoritmů. Základním lékem pro prakticky všechny pacienty s RA jsou tzv. chorobu modifikující léky RA, které se označují jako DMARDs, což pochází ze zkratky anglického názvu disease modifying antirheumatic drugs. Paleta DMARDs se dnes značně rozšířila (tab. 1).

DMARDs se dnes dělí podle svého původu na přípravky syntetické a biologické. Skupina syntetických DMARDs se pak člení na tzv. konvenční syntetické DMARDs (csDMARDs) a cílené syntetické DMARDs (tsDMARDs). Nejdůležitějším csDMARD je metotrexát (MTX), který by podle doporučení např. Evropské ligy proti revmatismu (European League Against Rheumatism, EULAR) měl být součástí každé léčebné strategie RA, pokud pacient tento lék toleruje.3 Do skupiny tsDMARDs patří novější preparáty označované jako inhibitory Janusovy kinázy (JAK). Jde o syntetické molekuly, které však dosahují podobné, nebo dokonce lepší účinnosti než bDMARDs, i když jiným mechanismem účinku než biologické léky.4 Výhodou inhibitorů JAK je možnost perorálního podávání a žádná imunogenicita, nevýhodou jsou některé zatím ne zcela objasněné nežádoucí účinky a také cena této léčby. Vlastní bDMARDs se pak dělí na biologické léky inhibující tumor nekrotizující faktor alfa (TNFα) a bDMARDs s jiným mechanismem účinku (rituximab, abatacept, inhibitory IL‑6). Protože u některých bDMARDs již vypršela patentová ochrana, byly vyrobeny, vyzkoušeny a registrovány tzv. biosimilární léky, které mají shodnou účinnost a bezpečnost jako jejich referenční originální léky a jejich jedinou výhodou je nižší cena, i když v současné době se ceny originálních a biosimilárních léků srovnávají.5
Samostatnou a zajímavou kapitolou je otázka podávání glukokortikoidů (GK) u RA. Glukokortikoidy jsou bezesporu nesmírně účinnými imunosupresivními léky na straně jedné, ale s významnými nežádoucími účinky na straně druhé. Hledání onoho zlepšeného poměru benefit/risk GK trvá již půl století a v názorech se liší jak jednotliví lékaři, tak i odborné společnosti. Byla nalezena určitá evidence o synergismu účinnosti GK a MTX u časné RA, což vedlo k definici používání GK v Doporučeních EULAR 2020.3 Glukokortikoidy jsou doporučovány k iniciální léčbě aktivní RA, aniž jsou uvedeny dávka a forma, ale s ohraničením doby podávání na šest měsíců. Bohužel údaje z kohortových studií a registrů ukazují, že toto není dodržováno a téměř polovina pacientů s RA setrvává v léčbě RA dlouhodobě.
Kromě nových léků jsou pro úspěšnou léčbu RA důležité i další faktory. Řadíme mezi ně jednak správné hodnocení aktivity RA a jednak strategie léčby. Hodnocení aktivity RA je složité, protože obsahuje jak subjektivní (a obtížně hodnotitelné) údaje pacienta (bolest, ztuhlost, únavnost, zhoršení funkce), tak objektivní ukazatele zánětu (oteklé klouby, reaktanty akutní fáze, nález zjištěný zobrazovacími metodami). Nicméně byly vyvinuty a validizovány kompozitní ukazatele aktivity, z nichž nejvíce užívaným je index zahrnující počet oteklých a bolestivých kloubů a označovaný jako DAS (Disease Activity Score) 28, který je také používán k určení prahové aktivity pro zavedení léčby bDMARD a tsDMARD.6
Strategie léčby také doznaly výrazných modifikací. Nejdůležitějšími strategiemi léčby jsou nyní: časná léčba DMARDs, princip léčba k cíli (treat to target, T2T),7 kontinuální léčba a optimálně individualizace léčby každého pacienta. Co se týče časné léčby, dá se říci, že zavedení csDMARDs (obvykle MTX) je vhodné již při zjištění diagnózy RA.
Problém časné diagnózy a vyhodnocení aktivity a prognózy
Řada studií prokázala, že zavedení léčby DMARDs je více účinné při velmi krátkém trvání RA a že zpoždění již v řádu týdnů výsledky léčby a prognózu zhoršuje. Některé studie dokonce ukazují, že účinné může být i nasazení DMARDs ještě ve stadiu preklinické RA.8 Nicméně diagnóza RA není v počátečních stadiích a při častých atypických průbězích jednoduchá ani pro zkušeného revmatologa. Určitým zlepšením v diagnostickém procesu RA může být používání kritérií ACR (American College of Rheumatology ) / EULAR pro klasifikaci RA, které je vhodnější pro časné formy onemocnění (tab. 2).9 Ve snaze o ještě časnější zachycení potenciálních pacientů, ev. iniciálních stadií RA byl vyvinut koncept klinicky suspektních artralgií (tab. 3).10 V současné době probíhá několik studií s otázkou, jak léčit tyto pacienty, kteří ještě vlastně nemají synovitidu, ale vysokou pravděpodobnost vývoje do RA.


Nicméně hlavním problémem současnosti je rychlý transfer pacienta od lékaře prvního kontaktu (praktického lékaře, ortopeda, rehabilitačního lékaře) ke specialistovi. Počet revmatologů v Česku je nedostatečný a řada okresů nemá dlouhodobě žádného revmatologa. Objednací doby na specializované vyšetření se někdy pohybují v intervalu 3–9 měsíců. Jak tedy zajistit, aby nedocházelo ke zpoždění při stanovení diagnózy RA? Jednou z možností je zřízení tzv. klinik (ordinací, ambulancí) časné artritidy, kde jsou pacienti s významným podezřením na RA vyšetřováni okamžitě. Tyto ambulance časné artritidy představují běžný standard v západní Evropě, u nás existují také, ale v mnohem menším počtu (např. Revmatologický ústav v Praze, Hradec Králové). Problémem je triáž pacientů, která je prováděna telefonicky při objednání většinou určenými lékaři nebo někdy edukovanými sestrami. Je používán systém několika kontrolních otázek a lze najít určité podobnosti se systémem používaným při organizaci záchranné služby. Ze zkušeností však víme, že ambulance akutní artritidy je často zneužívána k řešení banálních problémů. Pro odesílání pacienta od praktického lékaře ke specialistovi lze doporučit schéma Emeryho, který již před mnoha lety z důvodů nedostatku lékařů ve Velké Británii navrhl vytvořit síť klinik časné artritidy, a to včetně kritérií pro odeslání pacienta s podezřením na RA ke specialistovi (obr. 1).
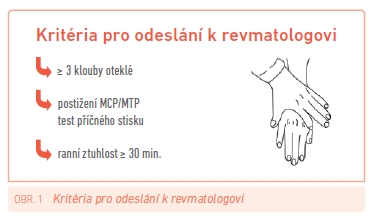
Problém zahájení léčby DMARDs
Konvenční syntetická DMARDs (metotrexát, sulfasalazin – SAS, leflunomid, antimalarika, soli zlata) jsou vázána na předpis revmatologa. Odpovídá to celkovému systému preskripce léků v České republice, přičemž však v řadě států je systém liberálnější. Lze připustit, že zahájení nové léčby DMARDs, výběr jednotlivého csDMARD nebo jejich kombinace představuje důležitý a zodpovědný úkon vyžadující dobré zkušenosti a znalosti lékaře a měl by být vyhrazen specialistovi. Nicméně při dlouhodobém podávání např. MTX nebo SAS pacientům ve stabilizovaném stavu, např. ve stavu remise či nízké aktivity, je možné, aby tyto léky předepisoval i nerevmatolog (praktický lékař, internista), a to např. formou delegované preskripce, jak je běžné třeba ve Velké Británii. Jako téměř samozřejmé je možno předpokládat, že praktický lékař je aktivně účasten při monitorování bezpečnosti léčby csDMARD, např. prováděním adekvátních laboratorních testů, což se ovšem v praxi často neděje. Samozřejmě to vyžaduje dostatečné znalosti praktických lékařů o terapii RA. Zdrojem informací mohou být např. společné dokumenty odborných společností sdružujících jak revmatology, tak praktické lékaře.11
Problém zahájení léčby biologickými a cílenými syntetickými DMARDs a monitorování jejich bezpečnosti
Indikační kritéria pro iniciaci bDMARDs a tsDMARDs publikovala Česká revmatologická společnost12 a vycházela přitom z kritérií EULAR.3 V principu jde o pacienty, u kterých selhala v první linii léčba MTX (ev. při nevhodnosti MTX i léčba dalším csDMARD) a kteří jsou stále aktivní a u nichž jsou přítomny tzv. faktory rizikové pro nepříznivý vývoj nemoci (přítomnost RF a anti‑CCP pozitivní, vysoké hodnoty reaktantů akutní fáze, polyartritida, časný vývoj erozí) (tab. 4).

Prahová aktivita pro indikaci biologické léčby byla původně vysoká, konkrétně DAS 28 > 5,1. Protože se však ukázalo, že i při střední aktivitě (DAS 28 3,2–5,1) RA progreduje a nemocný se funkčně zhoršuje, většina západních států umožňuje podávat bDMARD a tsDMARD již ve stadiu střední aktivity. Po dlouhých diskusích s plátci byla získána úhrada i pro pacienty se střední aktivitou i v České republice, ale neplatí to bohužel pro všechny přípravky z těchto skupin, což nedává žádnou medicínskou logiku. Biologické a cílené syntetické DMARDs mohou být v Česku předepisovány pouze v tzv. centrech biologické léčby, která mají zvláštní smlouvu na tyto léky. Všichni pacienti léčení bDMARDs a tsDMARDs jsou také zahrnováni do Národního registru biologické léčby ATTRA. Nová centra jsou navrhována výborem České revmatologické společnosti na základě splnění publikovaných požadavků. Tyto návrhy pak schvalují plátci – tzn. zdravotní pojišťovny. Mezi kritéria pro doporučení centra patří: zkušený revmatolog se znalostí celé problematiky bDMARDs, sestra na plný úvazek, vybavení pro intravenózní (i.v.) aplikaci, vybavení a schopnost zvládat emergentní situace, které se mohou při i.v. léčbě biologiky vyskytovat, schopnost vkládat informace do elektronické formy registru a dalším požadavkem je regionální potřeba centra. Bohužel je v důsledku poněkud živelného vývoje v minulosti a někdy i nesystémového přístupu pojišťoven síť center nerovnoměrná. Historicky vzniklo v roce 2001 šest center biologické léčby, aktuálně je jich 60. Tento vývoj lze považovat za příznivý. Na jedné straně větší počet center zkracuje dojezdovou vzdálenost pro pacienty, na druhé straně tento systém zajištuje vysokou kvalitu poskytované péče a výběr vhodných pacientů, u kterých je předpoklad dobré odpovědi na léčbu. Je to nutné, neboť biologická léčba je stále ještě poměrně nákladná. Registr pak umožňuje získávat informace o dlouhodobé účinnosti bDMARDs a tsDMARDs, především však informace o bezpečnosti této léčby, což je důležité např. při sledování některých sporadicky se vyskytujících, ale závažných nežádoucích účinků.
Problém nežádoucích účinků a monitorování bezpečnosti biologické a cílené léčby
Terapie bDMARDs i tsDMARDs je poměrně bezpečná, ale může vznikat celá řada nežádoucích účinků, které jsou uvedeny v tabulce 5. Je důležité, aby praktičtí lékaři a další lékaři, kteří se podílejí na léčbě pacientů s RA, měli alespoň základní přehled o těchto nežádoucích účincích a v případě jejich výskytu ihned informovali příslušného revmatologa.

Nejčastějším nežádoucím účinkem biologické léčby jsou infekce, a to závažné i nezávažné.13 Riziko vzniku infekcí, především závažných, je obecně zvýšeno u pacientů s RA oproti pacientům bez RA a stoupá s aktivitou RA. Podávání bDMARDs a tsDMARDs riziko závažné infekce mírně zvyšuje, a to jak ve srovnání s pacienty bez RA, tak s pacienty s RA léčenými MTX. Nejčastější lokalizace závažných infekcí představují kůže, měkké tkáně a také klouby (a to včetně kloubů po umělé náhradě). Zvýšený je výskyt tuberkulózy a některých dalších granulomatózních infekcí. K výraznému snížení výskytu tuberkulózy při léčbě anti‑TNF přípravky přispělo povinné vyloučení aktivní a zejména latentní tuberkulózy (TBC) před zahájením léčby. V současné době doporučuje Česká revmatologická společnost provádět test na produkci interferonu gama (Quantiferon, Elispot), rentgen hrudníku a samozřejmě i pečlivou anamnézu. V případě negativity všeho je možné léčbu zahájit, v případě pozitivity či nejistoty se doporučuje kontaktovat pneumologa. Při detekci latentní TBC je nutná nejméně šestiměsíční terapie isoniazidem, přičemž léčbu je možné zahájit po jednom měsíci. Vyloučení latentní TBC je nutné před zahájením léčby všemi bDMARDs a tsDMARDs. Anti‑TNF léčba může aktivovat infekci hepatitidou B. Proto je před zahájením biologické a cílené léčby doporučeno provést jaterní testy (HBsAg, anti‑HBc a anti‑HBs). U pacientů s vysokým a středním rizikem je nutná profylaxe, při nízkém riziku pak je doporučeno monitorování terapie. Nutná je spolupráce s hepatologem. V případě hepatitidy C je léčba v podstatě stejná jako u HCV negativních, když dostávají antivirovou léčbu. Pokud nemají antivirovou léčbu, doporučuje se individuální přístup – doporučena je mírnější imunosuprese (SAS, HCQ), léčba biologiky individuálně. Další infekcí, která je v poslední době hodně diskutována, je herpes zoster (HZ). Při léčbě anti‑TNF přípravky je frekvence infekce HZ jen mírně zvýšena oproti kontrolám. Při terapii inhibitory JAK se však toto riziko zvyšuje oproti kontrolám 3–4krát.14 U pacientů před zahájením léčby inhibitory JAK je proto doporučeno očkování proti HZ. Nejvhodnější pro očkování je neživá vakcína Shingrix. Významným rizikovým faktorem pro vznik HZ je vyšší věk a např. dle doporučení regulatorních úřadů není tofacitinib vhodným lékem pro pacienty starší 65 let a je doporučeno použít jinou alternativu léčby.15 Výskyt závažných infekcí se v zásadě neliší po léčbě anti‑TNF přípravky a dalšími bDMARDs s jiným mechanismem účinku (abatacept, rituximab, inhibitory IL‑6). Častěji se infekce mohou vyskytovat v průběhu léčby rituximabem, zvláště když dojde k poklesu koncentrací imunoglobulinů.
Problém revmatického pacienta v pandemii COVID‑19
Pandemie COVID‑19 významně ovlivnila celou lékařskou praxi a samozřejmě i praxi revmatologů. Proto je také pečlivě sledována otázka, jak infekce SARS‑Cov‑2 ovlivňuje revmatická autoimunitní onemocnění jak z hlediska frekvence, závažnosti průběhu a vlivu antirevmatických léků na průběh infekce COVID‑19, tak v neposlední řadě i z hlediska účinnosti očkování.
V Doporučeních ACR z června 2021 pro pacienty s COVID‑19 trpící autoimunitním revmatickým onemocněním (AIRD) se konstatuje, že pacienti s AIRD mají zvýšené riziko dostat infekci COVID‑19 v porovnání s populací bez AIRD, mají také větší riziko hospitalizace a větší riziko horších následků AIRD.16
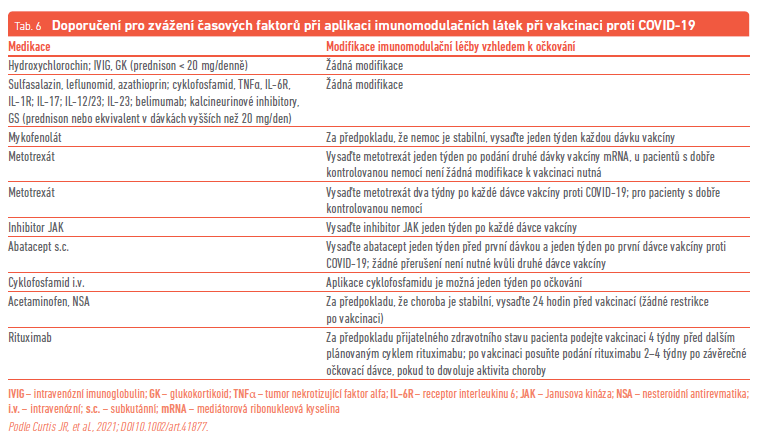
Pacienti s AIRD by měli být přednostně očkováni proti COVID‑19. Kromě známých alergií na komponenty vakcín není u pacientů s AIRD žádná kontraindikace k očkování proti COVID‑19. Optimální načasování vakcinace je před zahájením imunomodulační léčby nebo v průběhu nižší aktivity AIRD. Vakcína však může být podána i ve stavu vysoké aktivity s výjimkou život ohrožujících situací a pobytu na jednotce intenzivní péče. Pro aplikaci vakcinace u pacientů užívajících antirevmatické léky se doporučují určitá časová schémata, která jsou uvedena v tabulce 6. Byly popsány i exacerbace základního onemocnění, ale tento vztah zatím není jasný a posouzení benefitu a rizika očkování vyznívá u pacientů s AIRD vysoce kladně ve prospěch vakcinace.
Problém vzniku nádorových onemocnění
V souvislosti s biologickou léčbou je také diskutováno riziko vzniku lymfomů. Riziko vzniku lymfomů je u RA zvýšené, a to především u jejích aktivních forem. Dlouhodobé sledování především v registrech však zvýšené riziko při léčbě bDMARDs ani tsDMARDs nepotvrdilo.17 Naopak více dat potvrzuje zvýšené riziko vzniku kožních melanomů a nemalonomových nádorů a pravidelné sledování kožních znamének je doporučováno. Po prodělaném nádoru se doporučuje nepodávat bDMARDs nejméně pět let, ale v individuálních případech je možné diskutovat s onkologem i kratší interval. Lékem volby bývá v těchto situacích zpravidla rituximab.
Problém komorbidit u pacientů s RA
Jako komorbidity jsme si zvykli při RA uvádět onemocnění, jež přímo nesouvisejí s mechanismem vzniku RA, ale která se při RA vyskytují častěji nebo mají závažnější průběh (tab. 7). Komorbidity jsou jednou z příčin, proč často není z pohledu pacienta dosaženo dostatečného zlepšení kvality života. Jsou i jednou z příčin zkrácení střední délky života. Pacient s RA a komorbiditami by měl být ošetřován týmem zdravotníků, v jejichž čele stojí revmatolog, který má vůdčí i organizační roli, ale patří sem i specializovaná sestra, praktický lékař, fyzioterapeut, ergoterapeut, v případě potřeby i revmatochirurg, kardiolog, pneumolog či další specialista podle formy onemocnění.

Jednou z nejčastějších a nejzávažnějších komorbidit je zvýšené riziko kardiovaskulárních onemocnění (KVO). Při hodnocení kardiovaskulárního rizika se doporučuje používat metodu SCORE (Systematic Coronary Risk Evaluation), vypočtené riziko se u pacientů s RA doporučuje násobit 1,5krát.18 Pacienti s RA mají kromě tradičních rizikových faktorů KVO (hypertenze, diabetes, obezita, dyslipidemie, kouření) i netradiční rizikové faktory charakteristické pro RA. Patří mezi ně délka trvání RA, aktivita RA, počáteční a kumulativní ukazatele zánětu (CRP), počet oteklých kloubů, extraartikulární onemocnění (vaskulitida, plicní fibróza), pozitivita revmatoidních faktorů a protilátky proti cyklickému citrulinovanému peptidu (anti‑CCP). Mezi další faktory se řadí i disabilita, inaktivita a snížená mobilita.
Problematika vlivu různých antirevmatik na frekvenci kardiovaskulárních onemocnění
Riziko mohou představovat i podávané léky, a to především glukokortikoidy a nesteroidní antirevmatika, jež riziko KVO zvyšují. Naopak efektivní potlačení aktivity může riziko KVO snižovat, což je případ MTX a biologických a cílených syntetických DMARDs.2 Obecně tedy lze říci, že snížení aktivity RA snižuje riziko KVO, ale u jednotlivých DMARDs je nutné zvažovat některé specifické problémy. Podávání inhibitorů interleukinu 6 (IL‑6) (tocilizumab, sarilumab) vede ke zvýšení některých frakcí lipidů a vyžaduje podávání statinů. Neprokázalo se však, že by v porovnání s anti‑TNF léčbou došlo ke zvýšení počtu infarktů a dalších závažných projevů KVO.19 Podobné platí i pro inhibitory JAK, které také inhibují IL‑6. V kontextu podávání inhibitorů JAK se však diskutuje jiný problém KVO, a to možné zvýšení výskytu hluboké žilní trombózy (DVT) a plicního embolismu (PE). Kohortové studie z poslední doby prokázaly, že riziko DVT a PE je u pacientů s RA zvýšené a že toto riziko se zvyšuje s aktivitou RA a s vyšším věkem nemocných.20 Výsledky studií ani analýzy registrů nedávají jednoznačnou odpověď na to, zdali aplikace inhibitorů JAK zvyšuje riziko DVT a PE. Nicméně na základě studie u pacientů s kardiovaskulárním rizikem starších 50 let, kde byl výskyt VTE a PE vyšší, Evropská léková agentura (European Medicines Agency, EMA) nově nedoporučuje použití tofacitinibu u pacientů ve věku nad 65 let.21
Závěr
Moderní přípravky pro terapii revmatoidní artritidy přinesly doslova revoluci do léčby tohoto závažného onemocnění. Každá mince má však dvě strany. Pozitivní přínosy jasně vyplývají z výše uvedeného textu. Na té negativní straně nutno vidět významně zvýšené náklady a ne vždy dostupnou drahou léčbu pro všechny. Jednou z cest je přesné vytipování vhodných pacientů a dobrá strategie léčby. Kladou se tedy i větší nároky na kontinuální vzdělávání lékařů, a to jak specialistů, tak i nerevmatologů, kteří musejí být součástí týmů, jež se o pacienty s RA komplexně starají.
Práce byla podpořena projektem Ministerstva zdravotnictví ČR koncepčního rozvoje výzkumné organizace 00023728 Revmatologický ústav.
Literatura
- Smolen JS, Aletaha D, McInnes IB. Rheumatoid arthritis. Lancet 2016;388:2023–2038.
- Ozen, G, Pedro S, Michaud, K. The Risk of Cardiovascular Events Associated With Disease‑modifying Antirheumatic Drugs in Rheumatoid Arthritis. J Rheumatology 2021;48:648–655.
- Smolen JS, Landewé R, Bijlsma J, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease‑modifying antirheumatic drugs 2019 update. Ann Rheum Dis 2020;79:685–699.
- Taylor PC, Keystone EC, van der Heijde D, et al. Baricitinib versus placebo or adalimumab in rheumatoid arthritis. N Engl J Med 2017;376:652–662.
- Yoo DH, Prodanovic N, Jaworski J, et al. Efficacy and safety of CT‑P13 (biosimilar infliximab) in patients with rheumatoid arthritis: comparison between switching from reference infliximab to CT‑P13 and continuing CT‑P13 in the PLANETRA extension study. Ann Rheum Dis 2017;76:355–363.
- Smolen JS, Aletaha D, Bijlsma JWQ, et al. Treating rheumatoid arthritis to target. Recommendations of an international task force. Ann Rheum Dis 2010;69:631–637.
- Aletaha D, Alasti F, Smolen JS. Optimisation of a treat‑to‑target approach in rheumatoid arthritis: strategies for the 3‑month time point. Ann Rheum Dis 2016;75:1479–1485.
- Gerlog D, et al. PRAIRI Abstract EULAR 2016 0P0182.
- Aletaha D, Neogi T, Silman AJ, et al. 2010 rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Arthritis Rheum 2010;62:2569–2581.
- Steenbergen HW, Aletaha D, Beaart‑Vn de Voorde LJJ, et al. EULAR definition of arthralgia suspicious for progression to rheumatoid arthritis. Ann Rheum Dis 2017;76:491–496.
- Šenolt L, Mann H, et al. Revmatologie. Praha: Společnost všeobecného lékařství ČLS JEP, 2021. Doporučené postupy pro praktické lékaře. ISBN 978‑80‑88280‑29‑3.
- Šenolt L, Mann H, Závada J, et al. Doporučení České revmatologické společnosti pro farmakoterapii revmatoidní artritidy 2017. Čes Revmatol 2017;25:8–24.
- Pavelka K. Cílené a biologické léky v léčbě zánětlivých revmatických onemocnění. Vnitřní lékařství 2021;67:195–200.
- Curtis JR, Xie F, Bernatsky SYS, et al. Risk for Herpes Zoster in Tofacitinib‑Treated Rheumatoid Arthritis Patients With and Without Concomitant Methotrexate and Glucocorticoids. Arthritis Care Res 2019;71:1249–1254.
- Various European Medicines Agency emea‑europa.eu.(2020). Available on line at https://www.europa.eu/en/news/ema‑confirms‑xeljanz be used–caution–patients‑high risk‑blood‑clots (accessed July 29, 2020).
- Curtis JR, Johnson SR, Anthony DD, et al. American College of Rheumatology Guidance for COVID‑19 vaccination in patients with rheumatic and musculoskeletal diseases: version 2. Arthritis Rheum 2021;DOI 10.10002/art.41877
- Amari W, Zeringue A, McDonald JR, et al. Risk of non‑melanoma skin cancer in a national cohort of veterans with rheumatic arthritis. Rheumatology (Oxford) 2011;50:1431–1439.
- Baillet A, Gossec L, Carmona L, et al. Points to consider for reporting, screening for and preventing selected comorbidities in chronic inflammatory rheumatic diseases in daily practice: a EULAR initiative. Ann Rheum Dis 2016;75:965–973.
- Giles JT, Sattar N, Gabriel S, et al. Cardiovascular Safety of Tocilizumab Versus Etanercept in Rheumatoid Arthritis: A Randomized Controlled Trial. Arthritis Rheumatol 2020;72:31–40.
- Molander V, Bower H, Frisell T, Askling J. Risk of venous thromboembolism in rheumatoid arthritis, and its association with disease activity: a nationwide cohort study from Sweden. Ann Rheum Dis 2021;80:169–175.
- Nash P, Kerschbaumer A, Dörner T, et al. Points to consider for the treatment of immune‑mediated inflammatory diseases with Janus kinase inhibitors: a consensus statement. Ann Rheum Dis 2021;80:71–87.