Uzlinové syndromy – zaměřeno na Castlemanovu chorobu
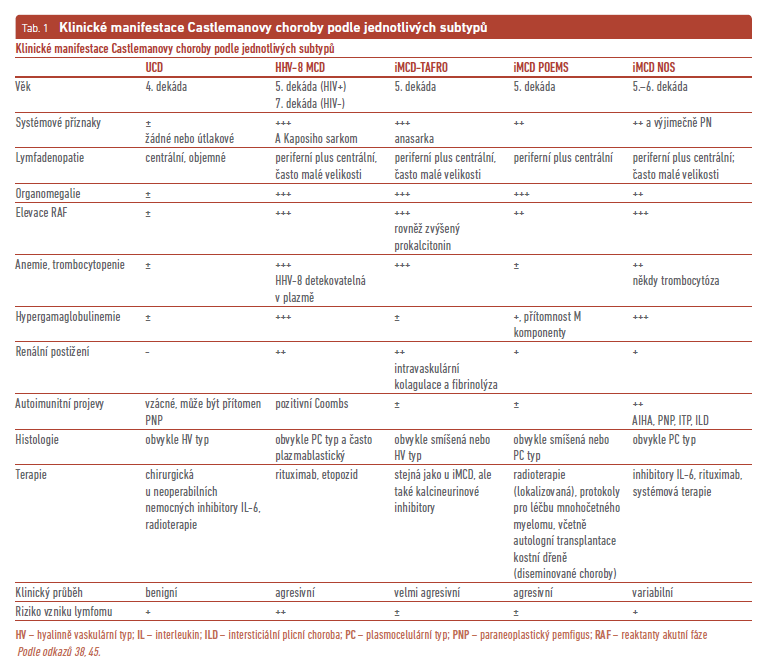
Castlemanova choroba (CD, angiofolikulární hyperplazie lymfatických uzlin) představuje heterogenní skupinu lymfoproliferativních onemocnění, která mají společné histopatologické rysy. Podle lokalizace postižení lymfatických uzlin lze CD rozdělit na unicentrické (UCD) a – v případě rozsáhlé lymfadenopatie – multicentrické (MCD) onemocnění. UCD zahrnuje jednu nebo více zvětšených uzlin v jednom regionu, pouze u části nemocných mohou být přítomny systémové příznaky. Nemocní s MCD mají krom multicentrické lymfadenopatie i zánětlivé příznaky. MCD představuje celou řadu chorobných stavů, mezi které patří MCD asociovaná s lidským herpes virem 8 (HHV‑8), POEMS asociovaná MCD a HHV‑8 negativní/idiopatická MCD (iMCD). Kompletní resekce postižených uzlin u UCD je většinou kurativním zlatým standardem léčby. U asymptomatické neresekabilní UCD je doporučena observace s včasným zahájením terapie symptomů. Symptomy se mohou vyskytovat jednak z lokálního útlaku (v tomto případě je doporučováno zvážení resekce, eventuálně terapie rituximabem), jednak v rámci symptomů spojených s projevy systémového zánětu; zde lze zvážit terapii anti leukin 6 (siltuximabem, tocilizumabem).
Castlemanova choroba (CD, angiofolikulární hyperplazie lymfatických uzlin) představuje heterogenní skupinu vzácných lymfoproliferativních onemocnění, která mají společné histopatologické rysy.1 Poprvé byla popsána americkým patologem Benjaminem Castlemanem z Massachusetts v roce 1956.2 V polovině 80. let 20. století byla CD rozdělena na dva typy – na unicentrickou (UCD) a multicentrickou (MCD). UCD se projevuje postižením jedné zvětšené uzliny či jednoho postiženého regionu lymfatických uzlin. MCD pak zahrnuje postižení více regionů lymfatických uzlin. Již na začátku epidemie HIV (virus lidské imunodeficience) byla pozorována možná asociace mezi MCD a HIV infekcí, nicméně později bylo prokázáno, že většina MCD HIV pozitivních pacientů má zároveň probíhající infekci lidským herpes virem 8 (HHV‑8). Právě HHV‑8 se ukázal jako jeden z klíčových virů podílejících se na vzniku MCD u imunokompromitovaných pacientů. Byl rovněž pozorován současný překryv mezi syndromem POEMS (P – polyneuropatie, O – organomegalie, E –endokrinopatie, M – monoklonální gamapatie, S – „skin“, kožní léze), což je vzácné onemocnění patřící do skupiny plazmocelulárních dyskrazií, a MCD. Idiopatická MCD (iMCD) nebo také HHV‑8 negativní MCD byla popsána Takeim a kol. v roce 2010 na základě pozorování společných laboratorních abnormalit a klinických příznaků ve sledované skupině pacientů. Syndrom byl pojmenován TAFRO (T – trombocytopenie, A – ascites, F – myelofibróza, R – renální postižení, O – organomegalie).1,3–5 Mezinárodní pracovní skupina pro Castlemanovu chorobu (Castleman Disease Collaborative Network, CDCN) navrhla klasifikační systém pro CD při zachování základního rozdělení na UCD a MCD. MCD byla rozdělena podle předpokládané etiologie na MCD asociovanou s HHV‑8 (s podjednotkami HIV+ a HIV–), POEMS asociovaná MCD a iMCD (rozdělená dle fenotypu na iMCD‑TAFRO a jinak nespecifikovanou iMCD – iMCD‑NOS) (tab. 1).4,5 Terapie CD se opírá o unikátní vlastnosti jednotlivých subtypů onemocnění. Radikální odstranění postižené uzliny/uzlin u UCD bývá často kurativní metodou; tam, kde nelze stav řešit chirurgicky, záleží na projevech onemocnění. U asymptomatických jedinců je dostačující observace a při manifestaci pak připadají v úvahu inhibitory interleukinu 6 (IL‑6). Situace je odlišná u MCD vzhledem k její heterogenitě – zde se pak uplatňují mimo jiné i onkologické terapeutické režimy.4,5
Epidemiologie
Epidemiologická data stran CD jsou velmi kusá. Odhaduje se, že ve Spojených státech amerických je diagnostikováno ročně okolo 6 500–7 700 nových případů CD; z tohoto počtu je pak přibližně 4 900–5 900 případů UCD (16–19 nemocných na 1 000 000 obyvatel).6 Epidemiologická data jsou obdobná pro japonskou populaci. Zdá se, že MCD je častější než UCD a MCD asociovaná s HHV‑8 je raritní.7 Epidemiologické údaje pro českou populaci nejsou dostupné. Výskyt UCD je mírně zvýšen u žen oproti mužům, u MCD převažují muži nad ženami. Pacienti s UCD jsou mladší jedinci typicky ve věku kolem 40 let, nicméně byl popsán výskyt UCD i u dětí či jedinců starších 60 let. U MCD je manifestace typická kolem 60. roku života. Nicméně CD může být diagnostikována v kterémkoliv věku.8,9 Dosud nebyly nalezeny přesvědčivé rizikové faktory pro vznik UCD, POEMS‑MCD nebo iMCD. Imunokompromitovaný terén s přítomností infekce HHV‑8 je primárním rizikovým faktorem pro vznik HHV‑8‑MCD. Přítomnost infekce HIV je nejčastější příčinou chronické sekundární imunodeficience. Dostupná data z literatury uvádějí, že prakticky všichni nemocní s HIV‑1 MCD mají HHV‑8 MCD, zatímco v populaci pacientů s HIV‑2 MCD je HHV‑8 MCD doložena pouze u 2–50 % případů v závislosti na endemickém výskytu HHV‑8.10–12 Mezi další rizikové faktory pro HHV‑8 MCD patří pokrevně spříznění rodiče, thymom, chronická virová hepatitida, pacienti po transplantaci orgánů a muži mající sex s muži.13
Patogeneze
Patogeneze CD dosud není plně objasněna. Předpokládá se dvojí možný původ charakteristických histopatologických změn přítomných v lymfatických uzlinách pacientů s CD. Jednak změny v důsledku akcelerovaných reaktivních změn na antigenní impuls (například přítomnost HHV‑8), nebo v rámci neoplastického procesu, což se zdá pravděpodobnější u UCD.5,13 Mezi histopatologické nálezy u CD patří hyperplastická a trofická germinální centra, převaha dendritických buněk, akumulace imunoblastů a plazmatických buněk a zvýšená vaskularizace. Tyto změny se mohou vyskytnout i u jiných chorobných stavů spojených s chronickou aktivací složek imunitního systému, jako jsou např. autoimunitní chronická zánětlivá onemocnění, lymfomy, vrozené či získané imunodeficience a chronické virové infekce.4,5 Předpokládá se, že možným původcem UCD je pravděpodobně klonální neoplastický proces patrně vycházející ze stromálních, konkrétně z folikulárních dendritických buněk.14 Sekvenováním lymfatické tkáně uzlin byla prokázána somatická mutace v PDGFRβ (platelet‑derived growth factor receptor β) nejméně u 20 % pacientů s UCD.15 Mutace byla nalezena na buňkách CD45 a in vitro experimenty potvrdily, že tato mutace podporuje buněčnou proliferaci a přežívání.15 Další cytogenetickou abnormalitou zjištěnou u pacientů s UCD typicky v populaci stromálních buněk jsou změny v úseku chromozomu 12q13–15 charakteristické pro mezenchymální tumory, dále pak přítomnost klonální cytogenetické anomálie t(1;22)(p22;q13), která je spojena s genem ovlivňujícím gen megakaryoblastické leukemie 1 a podílejícím se na vzniku akutní megakaryocytární leukemie, a konečně změny genu pro ECGF1 (endothelial cell growth factor 1) podporujícího angiogenezi a bránícího buněčné apoptóze.16–18 UCD není spojena s přítomností infekce způsobené lidským herpes virem 8 (HHV‑8) ani s infekcí HIV.4,5
Infekce HHV‑8 hraje významnou roli v etiologii MCD u imunokompromitovaných pacientů. HHV‑8 je gama herpes virus podobný viru Epsteina–Barrové (EBV), tento virus je asociován s přítomností Kaposiho sarkomu – jak endemického, tak asociovaného s HIV.19 U imunokompromitovaných pacientů dochází k replikaci HHV‑8 v plazmablastech lymfatických uzlin a k transkripci virového homologu interleukinu 6 (IL‑6;vIL‑6), který je příčinou vzniku symptomů lymfatického postižení spuštěním kaskády celé řady cytokinů, mezi něž patří i IL‑6.20,21 Předpokládá se, že HHV‑8 může způsobit u imunoglobulin M (IgM1) pozitivních naivních B lymfocytů diferenciaci na plazmablasty, aniž by podstoupily reakci v germinálním centru. U nemocných s přítomností zánětlivých symptomů bývá ve srovnání s asymptomatickými nemocnými detekována výrazně zvýšená virová nálož HHV‑8. Bylo prokázáno, že vysoká virová nálož koreluje se zvýšenými hodnotami IL‑6 a IL‑10.22,23 HHV‑8 infikuje B lymfocyty a plazmablasty, přítomnost viru lze detekovat imunohistochemicky v lymfatické tkáni nemocných. HHV‑8 je detekován až ve 30 % buněk plášťové zóny, tyto buňky mají imunoblastickou morfologii a variabilní pozitivitu na CD20+ a expresi transkripčního faktoru MUM1/IRF4. Tyto změny nejsou detekovány u UCD nebo u iMCD.24 Předpokládá se i podíl CD8+ T lymfocytů na patogenezi HHV‑8 asociované MCD.25 Vzhledem k významné roli B lymfocytů v patogenezi HHV‑8 asociované MCD je většina pacientů dobře responzivních na anti‑CD20 terapii rituximabem.26
Patogeneze HHV‑8‑/iMCD je ze všech ostatních forem CD podstatně méně známá než u MCD. Uvažuje se o třech patogenetických možnostech podílejících se na HHV‑8‑/iMCD. První z nich představují autoimunitní mechanismy spojené s tvorbou autoprotilátek vedoucí k nadprodukci prozánětlivých cytokinů. Předpokládá se, že až 30 % pacientů s iMCD vykazuje přítomnost autoimunitního onemocnění a protilátek. Dále sem patří autoinflamatorní mechanismy spojené s mutacemi v genech, jež regulují zánětlivou odpověď, nicméně tento mechanismus není zatím dostatečně objasněn a podpořen nálezy u většího počtu nemocných. Neoplastické mechanismy předpokládají přítomnost onkogenních mutací v germinální zóně, iMCD má často klinický i histopatologický překryv s určitými typy lymfomu a pacienti jsou ohroženi vyšším rizikem rozvoje malignit oproti běžné populaci. Třetím mechanismem je možnost infekce jiné než HHV‑8 nebo HIV, vzhledem k fenotypovému překryvu s HHV‑8 asociované MCD.4,5,27–29 Dosud však prostřednictvím sekvenace RNA nebyl prokázán virus zodpovědný za rozvoj iMCD.30 Předpokládá se význam IL‑6 a VEGF (vascular endothelial growth factor) u iMCD. Nicméně hodnoty IL‑6 nebývají výrazně zvýšeny a část pacientů s iMCD nereaguje na léčbu inhibitory IL‑6. U těchto pacientů se předpokládá zapojení alternativních cytokinů a jejich signálních drah.31
Populace monoklonálních plazmatických buněk představuje pravděpodobně etiologickou příčinu POEMS‑MCD. Přesný rozdíl v buněčných populacích a cytokinovém profilu mezi POEMS‑MCD a klasickým POEMS není dosud plně objasněn. U klasického POEMS dochází k nadprodukci VEGF a IL‑12 v důsledku přítomnosti somatických mutací v populaci plazmatických buněk.32,33
Histologická klasifikace
Histologické vyšetření lymfatické uzliny je nezbytné pro diagnózu CD včetně všech subtypů. Lokalizace vhodné uzliny k histologickému vyšetření je nezbytná pro správné stanovení diagnózy obzvláště při podezření na UCD. Histologická klasifikace zahrnuje hyalinně vaskulární typ s regresivně změněnými zárodečnými centry, plazmocelulární typ s difuzním zmnožením plazmatických buněk v interfolikulárních prostorech s produkcí polyklonálních imunoglobulinů, a konečně smíšený typ.4,5,34
Klinický obraz, diagnostika a stručný přehled terapie CD
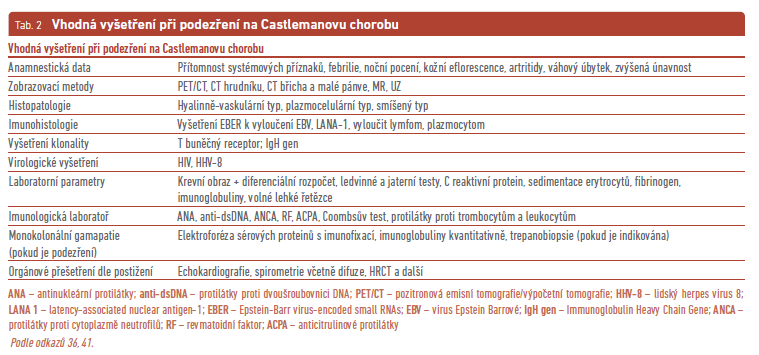
Klinické spektrum manifestací je velmi široké od postupného zvětšování uzlin bez přítomnosti příznaků či pouze s mírnými příznaky po akutní nástup život ohrožujícího stavu vedoucího k multiorgánovému selhávání. Symptomy CD mohou často splývat s příznaky jiných onemocnění. Je tudíž nutný aktivní přístup k nemocnému v rámci široké diferenciální diagnostiky, pokud je vysloveno podezření na přítomnost CD. Klinické příznaky nestačí ke stanovení diagnózy CD. Diagnózu CD lze stanovit pouze na základě histologického nálezu odpovídajícího CD. Obzvláště u UCD je nutné identifikovat vhodnou lymfatickou uzlinu k odběru. Lokalizaci usnadňuje vyšetření prostřednictvím emisní tomografie/výpočetní tomografie (PET/CT), kdy je k odběru nejvhodnější uzlina s maximální akumulací flourodeoxyglukózy (highest standardized uptake value – SUV). Mezi jednotlivými subtypy CD (UCD, HHV‑8‑MCD, iMCD, POEMS MCD) není rozdíl mezi SUVmax s hodnotou pohybující se obvykle mezi 3 až 8. Vyšší hodnoty svědčí spíše pro přítomnost lymfomu než CD. CT, magnetická rezonance (MR) a sonografie jsou dalšími zobrazovacími metodami využívanými v diagnostice a terapii CD (tab. 2, 3).4,5,13,27

UCD
Pacienti s UCD bývají většinou asymptomatičtí a nález zvětšené lymfatické uzliny je náhodný při klinickém vyšetření či v rámci vyšetření zobrazovacími metodami z jiné indikace. UCD obvykle postihuje pouze jednu uzlinu, eventuálně region; pokud je přítomna vícečetná lymfadenopatie, je třeba pomýšlet na jiné formy CD. Část pacientů s UCD může v důsledku útlaku vykazovat kompresní symptomy, obzvláště pokud jsou komprimovány uretery či dýchací cesty. Vzácně mohou být u pacientů s UCD přítomny systémové příznaky, např. febrilie > 38 °C, noční poty, únava, hmotnostní úbytek, hepatosplenomegalie, retence tekutin (periferní otoky, fluidothorax, ascites), kožní eflorescence či lymfocytární intersticiální pneumonitida (LIP). Systémové příznaky bývají přítomny u nemocných s neresekabilním pokročilým onemocněním bez rozdílu histopatologického subtypu. Pacienti s převažujícím plazmocelulárním typem histologického nálezu (10–30 %) jsou náchylnější k systémovým příznakům, zatímco nemocní s hyalinně vaskulárním typem (70–90 %) mají spíše příznaky v rámci komprese přilehlých struktur. Mezi nejčastější lokalizace lymfatické uzliny v rámci UCD patří mediastinum, krk, břicho a pánev, ale lokalizace může být prakticky kdekoliv. Rovněž byly popsány velmi vzácné případy postižení solidních orgánů – nejčastěji parotických žláz, u kterých se zvažuje možný původ v intraparotických lymfatických uzlinách. Mezi laboratorními nálezy bývají většinou bez výraznějších abnormalit, nicméně může být přítomna anemie, hypergamaglobulinemie, zvýšená sedimentace erytrocytů (FW). Vzácně se mohou vyskytnout závažné plicní komplikace, polyneuropatie, paraneoplastický pemfigus či autoimunitní hemolytická anemie. Vždy je nutné při rozvoji systémových příznaků pomýšlet i na jiné formy CD.5,35
Terapie UCD
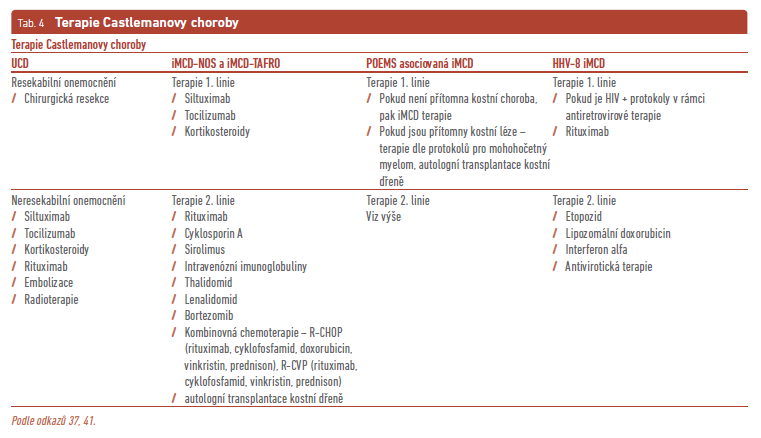
Dosud nebylo publikováno randomizované klinické sledování zaměřené na terapii UCD. Jednou z hlavních příčin se zdá velmi vzácný výskyt tohoto onemocnění, tudíž údaje o terapii pocházejí ze systematických analýz dostupné literatury, sérií případů a kazuistických sdělení, podle kterých vypracovala skupina CNCD doporučení pro terapii jednotlivých forem CD. Základním terapeutickým postupem u UCD je chirurgické odstranění postižené lymfatické tkáně všude tam, kde je to možné. Kompletní chirurgická excize je ve většině případů kurativním řešením s normalizací klinických a laboratorních nálezů. U některých probíhajících symptomů onemocnění trvá jejich vymizení různě dlouhou dobu, například postižení ledvin, které není důsledkem amyloidózy, ustoupí zhruba do 12 měsíců, stejně tak projevy paraneoplastického pemfigu. U renálního postižení v důsledku amyloidózy dojde rovněž ke zlepšení, ale ne k vymizení. Stran plicního postižení jsou data velmi nejednoznačná. Pokud není chirurgické řešení možné, přichází v úvahu radioterapie, embolizace nebo neoadjuvantní terapie (rituximab, protilátka anti‑CD20) nebo inhibitory IL‑6 (siltuximab nebo tocilizumab při autoinflamatorních projevech). Radioterapie může být efektivní jako primární léčba, ale je typicky rezervována pro vybranou populaci neoperabilních pacientů vzhledem k rizikům spojeným s radiační zátěží (tab. 4).36
MCD
Pacienti s MCD vykazují známky generalizované lymfadenopatie spojené s celou řadou klinických symptomů s různou závažností v terénu četných laboratorních abnormalit. Proliferace lymfocytů a plazmocytů postihuje nejen generalizovaně uzliny, ale může postihnout i játra, slezinu a další orgány. MCD může postihnout uzliny v kterékoliv lokalizaci a obvykle jsou dobře detekovatelné prostřednictvím PET/CT. Mezi velmi časté symptomy patří subfebrilie/febrilie, hmotnostní úbytek, noční poty, retence tekutin, cytopenie, poruchy funkce ledvin a jater. Patofyziologický původ cytopenií není uniformní, mohou být autoimunitního a zánětlivého původu, v důsledku akcelerované fagocytózy, nebo příčina nemusí být objasněna. Renální postižení zahrnuje sekundární amyloidózu či membranoproliferativní glomerulonefritidu. K dalším orgánovým postižením se řadí postižení plic (LIP, broncholitis obliterans), kůže (hemangiomy, paraneoplastický pemfigus, Kaposiho sarkom), periferního nervového systému. V úvodu je nutné provést vyšetření na přítomnost HIV a HHV‑8. Rovněž je nutné vyloučit/potvrdit přítomnost POEMS (elektroforetické vyšetření krve a moči s imunofixací, neurologické vyšetření, hormonální screening a další). Průběh MCD je obvykle spojen s řadou relapsů a remisí.4,5,37,38
HHV‑8 MCD – zde musí být potvrzena přítomnost HHV‑8 viru prostřednictvím LANA‑1 v tkáni lymfatických uzlin a/nebo polymerázovou řetězovou reakcí (PCR) v krevním oběhu u pacienta s MCD. Kvantifikace HHV‑8 je důležitá pro sledování průběhu onemocnění. Rovněž je nutné vyšetření na přítomnost HIV. Rychlost rozvoje příznaků HHV‑8 MCD je velmi variabilní – od pozvolné několikaleté progrese až po akutní začátek s život ohrožujícími manifestacemi (ledvinnými, hematologickými, neurologickými). Pacienti s HIV a HHV‑8 MCD mají většinou rychlejší nástup klinických příznaků než pacienti bez HIV. Hemofagocytární syndrom byl popisován přibližně u poloviny pacientů v rámci publikované série případů.39 Udává se, že mezi HIV negativními pacienty s HHV‑8 MCD jich má v úvodu mediastinální nebo abdominální lymfadenopatii pouze zhruba 10 %, ale s progresí onemocnění nebo u pacientů s konkomitantní HIV infekcí je tato lymfadenopatie přítomna v těchto lokalizacích přibližně u 50 % nemocných.40 Byly popisovány rozdíly u pacientů s HHV‑8 MCD majících rovněž infekci HIV1 nebo HIV2. Pacienti s HHV‑8 MCD s HIV1 jsou většinou mladší (42 let vs. 65 let), zpravidla jde o muže, jsou přítomny febrilie, splenomegalie a hemofagocytující syndrom a je u nich menší výskyt monoklonální gamapatie či pozitivity přímého Coombsova testu. Laboratorně bývá přítomna anemie, trombocytóza/trombocytopenie, hypoalbuminemie, polyklonální hypergamaglobulinemie, zvýšené koncentrace C reaktivního proteinu (CRP), FW, IL‑6, VEGF a laktátdehydrogenázy (LDH).39
Terapie MCD
Terapie pacientů s MCD se odvíjí od subtypu onemocnění, jeho průběhu a komorbidit. Série případů demonstrují terapeutické možnosti na jednotlivých subtypech tohoto relativně vzácného onemocnění. U pacientů s přítomností HIV infekce je to antiretrovirová terapie společně s pečlivě volenou imunosupresivní léčbou, které se podílejí na potlačení symptomů spojených s MCD. Onemocnění MCD je na rozdíl od většinou asymptomatického UCD spojeno s celou řadou klinických projevů, které mohou být potenciálně život ohrožující, obzvláště při orgánovém selhávání nebo při akcelerovaném inflamatorním stavu spojeném s cytokinovou bouří.5,20,41 Je nezbytně nutné při stanovení diagnózy MCD odlišit pacienty s pozitivitou HHV‑8 od těch, u kterých tento virus přítomen není, protože terapeutický přístup je pro jednotlivé skupiny odlišný. U HHV‑8 MCD závisí terapie na přítomnosti Kaposiho sarkomu a život ohrožujících orgánových manifestací, o nichž se předpokládá, že souvisejí se základní diagnózou. U nemocných s Kaposiho sarkomem jsou využívány terapeutické režimy zahrnující rituximab a pegylovaný lipozomální doxorubicin, u pacientů s HIV infekcí je doporučováno pokračování antiretrovirové terapie. Bylo popsáno zhoršení projevů Kaposiho sarkomu u pacientů s HIV po podání rituximabu; v tomto případě se doporučuje přidání gancikloviru. U nemocných s HHV‑8 MCD bez přítomnosti Kaposiho sarkomu se léčba odvíjí dle agresivity příznaků onemocnění. U HHV‑8 MCD bez přítomnosti život ohrožujících příznaků patří do terapeutického portfolia rituximab, u HIV pozitivních pacientů pak souběžná antiretrovirová terapie se snahou o dobrou kontrolu HIV infekce, ke zvážení je podávání gancikloviru pro HHV‑8 souběžnou infekci. Pokud se objeví známky progredujícího orgánového postižení, lze k rituximabu přidat pegylovaný lipozomální doxorubicin nebo etoposid. U život ohrožujících orgánových manifestací u pacientů s HHV‑8 MCD je podávána kombinovaná terapie rituximabem a pegylovaným lipozomálním doxorubicinem nebo etoposidem. Antiretrovirová terapie je určena ke kontrole HIV infekce společně s ganciklovirem zaměřeným na HHV‑8. Klinická odpověď je hodnocena ústupem klinických příznaků společně s monitorací laboratorních parametrů krevního obrazu, biochemických hodnot, CRP a dalších ukazatelů (tab. 3, 4).5,26–29
iMCD
Onemocnění iMCD je klinickopatologicky podobné HHV‑8 MCD, ale není přítomna infekce HHV‑8 detekovatelná PCR či prostřednictvím LANA‑1 v tkáni lymfatických uzlin. Téměř u všech pacientů se vyskytují celkové příznaky v podobě subfebrilií/febrilií, noční poty, hmotnostní úbytek a celková schvácenost s narůstáním únavy. Pacienti s iMCD mohou mít polyartritidu, kožní eflorescence různého charakteru, renální postižení, či dokonce lupus‑like symptomy. Přes podobnost celé řady klinických a laboratorních manifestací iMCD mají její jednotlivé subtypy poměrně heterogenní manifestace. Diagnostická kritéria iMCD zahrnují přítomnost lymfadenopatie, pozitivního histopatologického nálezu a alespoň dvou malých kritérií, z nichž jedno musí být laboratorní (tab. 3). Je nutné vyloučit další chorobné stavy, které mohou mít obdobné příznaky jako iMCD. Subklasifikace navržená CDCN uvádí subtypy iMCD TAFRO, iMCD NOS a iMCD POEMS.5,41,42
iMCD TAFRO je jedna z nejzávažnějších a nejagresivnějších forem iMCD s rychlým nástupem spojeným se závažným průběhem choroby. Uvádí se medián šest týdnů od počátku příznaků do provedení histologického vyšetření lymfatické uzliny, což je nejkratší doba mezi všemi typy iMCD.42 K hlavním projevům, jejichž začáteční písmena složená ve zkratku zároveň tvoří akronym názvu tohoto subtypu, patří trombocytopenie, ascites, myelofibróza, renální postižení a organomegalie. Pacienti s iMCD TAFRO mají hypervaskularizované lymfatické uzliny a histopatologicky bývá přítomen hyalinně vaskulární typ podobný jako u UCD. Laboratorně je přítomna trombocytopenie, normální nebo mírně zvýšená hodnota gamaglobulinů, zvýšená koncentrace alkalické fosfatázy, anemie, zvýšená hodnota CRP, zvýšená hodnota kreatininu, obzvláště pokud dochází k renálnímu selhávání. Sérové koncentrace LDH bývají většinou nezvýšeny. U pacientů s iMCD TAFRO jsou často detekovány antinukleární protilátky (ANA), je přítomna pozitivita Coombsova testu či protilátek proti trombocytům. Průběh iMCD TAFRO může být komplikován dalšími komorbiditami, mezi něž patří celá řada autoimunitních onemocnění, např. autoimunitní hemolytická anemie, idiopatická trombocytopenie a získaná deficience faktoru VIII. Kromě obvyklého vyšetření je doporučováno provedení trepanobiopsie k posouzení myelofibrózy a megakaroytické hyperplazie.42,43
iMCD NOS – nozologická jednotka, která nesplňuje diagnostická kritéria pro iMCD TAFRO a má méně agresivní průběh a lepší terapeutickou odpověď na terapii glukokortikoidy. V klinickém obraze může být přítomna retence tekutin, hepatosplenomegalie, trombocytóza a další. Hodnota trombocytů většinou bývá normální.42–44
POEMS MCD – onemocnění MCD se může vyskytovat společně s POEMS a CD patří k jednomu z hlavních kritérií při klasifikaci POEMS. V případě MCD asociovaného s POEMS jsou přítomny četné laboratorní abnormality zahrnující monoklonální gamapatii, zvýšené hodnoty VEGF, trombocytózu, polycytemii, nízkou koncentraci vitaminu B12 a abnormální endokrinologické laboratorní nálezy, například známky tyreopatie, zvýšenou koncentraci prolaktinu. Histologický nález u nemocných s klasickým POEMS je obdobný jako u CD nebo vykazuje klasickou CD histopatologii – nejčastěji je přítomen hyalinně vaskulární typ. Pacienti s POEMS MCD trpící osteosklerotickým postižením mají mírnější průběh choroby než ti bez něj. Periferní polyneuropatie se vyskytuje zhruba u 10 % pacientů s CD, a to častěji u nemocných s MCD než s UCD, nicméně často je přítomna u pacientů s POEMS MCD.45
Terapie iMCD
Terapeutický postup závisí na agresivitě průběhu a závažnosti orgánového postižení a rovněž na tom, zda je nebo není přítomen syndrom POEMS. U nemocných s iMCD bez přítomnosti POEMS a závažných orgánových manifestací se doporučuje zahájení podávání anti‑IL‑6 protilátky siltuximabu, případné posílení terapie glukokortikoidy závisí na tíži orgánových projevů a život ohrožujících komplikací. Pokud dojde k rozvoji život ohrožujících komplikací, jsou k siltuximabu přidány vysokodávkované glukokortikoidy; nenastane‑li v průběhu týdne zlepšení stavu, přechází terapie do chemoterapeutických režimů, jejichž podrobnější rozbor přesahuje rámec tohoto článku (tab. 4). Samozřejmostí je podpora a monitorace životních funkcí s doplňující podpůrnou terapií komorbidit. Terapie POEMS MCD je zaměřena na terapii syndromu POEMS dle hematoonkologických protokolů stanovených pro tento syndrom (tab. 4).44–49
Siltuximab
Siltuximab je chimérická monoklonální protilátka indikovaná k léčbě pacientů s iMCD dle doporučených terapeutických protokolů. Mechanismem účinku siltuximabu je inhibice vazby IL‑6 na jeho solubilní i transmembránový receptor, což vede k inhibici tvorby hexamerního signálního komplexu s proteinem gp130 na buněčném povrchu. Pacienti by měli být HIV a HHV‑8 negativní. Siltuximab je podáván intravenózně v obvyklé dávce 11 mg/kg v třítýdenních intervalech. Siltuximab prošel úspěšně studiemi fáze I a II zaměřenými na populaci pacientů s CD. V současné době probíhají otevřené fáze sledování vzhledem k limitující vzácnosti CD v populaci. Do studie fáze II bylo zařazeno celkem 79 pacientů s iMCD rozdělených do skupiny s terapií siltuximabem v dávce 11 mg/kg jednou za tři týdny (n = 53) a do skupiny s placebem (n = 26). Remise bylo dosaženo u 18 (34 %) pacientů ve skupině dostávající siltuximab, v placebové skupině nedošlo k remisi u žádného pacienta (rozdíl 34–0 %, 95% interval spolehlivosti [CI] 11,1–54,8, p = 0,0012). Výskyt nežádoucích příhod byl obdobný po celou dobu sledování.
Diferenciální diagnostika uzlinových syndromů
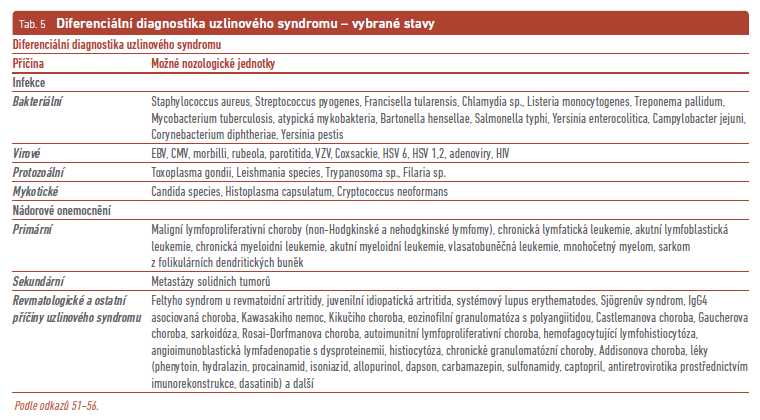
Uzlinový syndrom představuje diferenciálně diagnostický problém a může být projevem celé řady chorobných stavů, mezi které patří i CD. Uzlinový syndrom lze definovat jako lokalizované či generalizované zvětšení lymfatických uzlin, které může být zcela asymptomatické nebo může být doprovázeno celou řadou symptomů. Biopsie lymfatické uzliny je často nejrychlejším způsobem, jak dospět k diagnóze, nicméně je nutný dobrý výběr uzliny vhodné k odběru a úzká spolupráce s patologem při vyhodnocení nálezu, obzvláště pokud je pomýšleno na vzácné onemocnění. Nozologické jednotky, které mohou být příčinou lokalizované a generalizované lymfadenopatie, shrnuje tabulka 5. CD patří k poměrně vzácným onemocněním a diferenciální diagnostika jednotlivých subtypů CD může přinášet jistá úskalí i přes přesvědčivé histologické vyšetření s nálezem typickým pro CD. UCD, HHV‑8 MCD a POEMS MCD mají velmi typický průběh a laboratorní nálezy na rozdíl od iMCD, kde může být diferenciální diagnostika poměrně široká. Jisté opatrnosti je třeba při diferenciální diagnostice stavů, které mohou mít obdobný histologický obraz jako CD, jako jsou například některé formy lymfomů. Přítomnost infekce HHV‑8 je poměrně dobrým diagnostickým vodítkem pro určení HHV‑8 MCD při přítomnosti dalších příznaků typických pro CD. Určitý diferenciálně diagnostický problém představuje iMCD vzhledem k heterogenitě příznaků jak klinických, tak laboratorních, které mohou být obzvláště v úvodní diferenciálně diagnostické fázi značně zavádějící. Je nutné vyloučit celou řadu autoimunitních onemocnění, například zánětlivé revmatické choroby (systémový lupus erythematodes, revmatoidní artritidu, juvenilní idiopatickou artritidu, Sjögrenův syndrom a další), autoimunitní lymfoproliferativní syndrom a pak běžnější jednotky, jako jsou infekční či onkologické příčiny generalizované lymfadenopatie (tab. 5, obr. 1).
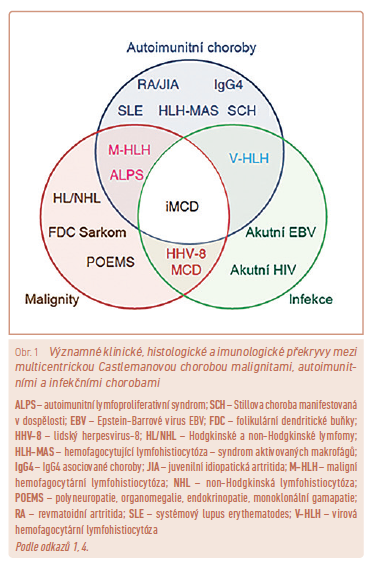
Castlemanova choroba v revmatologické ambulanci
CD je vzácné onemocnění, nicméně spektrum příznaků může vést nemocného do revmatologické ambulance v rámci diferenciálně diagnostického procesu, obzvláště pokud je pomýšleno na systémové zánětlivé revmatické onemocnění. Diferenciálně diagnosticky přínosná může být v první fázi přítomnost autoprotilátek typických pro zánětlivá systémová revmatická onemocnění a celkových příznaků, které se často mohou překrývat s celou řadou chorobných stavů. UCD víceméně nepředstavuje v revmatologické ambulanci problém a pacienti většinou nejsou primárně referováni k revmatologickému vyšetření, nicméně situace je odlišná u MCD a jejich subjednotek, které již představují ve svém počátku diferenciálně diagnostický problém (tab. 3). Stillova choroba manifestující se v dospělosti, systémový lupus erythematodes, Sjögrenův syndrom, IgG4 asociovaná choroba, Kikuchiho choroba, na něž je pomýšleno v rámci diferenciálně diagnostického procesu, mají celou řadu podobných příznaků jako CD. Pacienti s CD však nesplňují diagnostická kritéria systémového revmatického zánětlivého onemocnění a často chybějí i „typické“ laboratorní parametry včetně symptomatologie. Biopsie uzliny je zde stěžejní pro konečné určení diagnózy, nicméně je nutné v rámci konzultace s patologem uvést v diferenciální diagnostice možnost CD. Terapie CD je velmi komplexní a multioborová vzhledem k celé řadě potenciálně život ohrožujících komplikací této choroby.
Závěr
Uzlinové syndromy představují často obtížný diferenciálně diagnostický problém zahrnující různorodé choroby, které se mohou obzvláště v úvodu onemocnění svou symptomatologií překrývat. CD je vzácné onemocnění s celou řadou projevů, které má několik podjednotek rozdělených dle průběhu a typických laboratorních parametrů. MCD TAFRO představuje život ohrožující stav, který vyžaduje intenzivní terapii a monitoraci často na jednotkách intenzivní péče a onemocnění může být spjato s vysokou mortalitou. CD vyžaduje multidisciplinární přístup. Terapie se řídí dle typu a závažnosti daných projevů onemocnění. Nezbytnou podmínkou stanovení diagnózy je celá řada klinických a paraklinických vyšetření včetně biopsie lymfatické uzliny.
Podpořeno projektem (Ministerstva zdravotnictví ČR) koncepčního rozvoje výzkumné organizace 023728 (Revmatologický ústav).
Literatura
- Fajgenbaum DC, Shilling D. Castleman Disease Pathogenesis. Hematol Oncol Clin North Am. 2018;1:11–21.
- Castleman B, Iverson L, Menendez VP. Localized mediastinal lymphnode hyperplasia resembling thymoma. Cancer. 1956;4:822–830.
- Takai K, Nikkuni K, Shibuya H, et al. Thrombocytopenia with mild bone marrow fibrosis accompanied by fever, pleural effusion, ascites and hepatosplenomegaly [japonsky]. Rinsho Ketsueki. 2010;5:320–325.
- Fajgenbaum DC, Uldrick TS, Bagg A, et al. International, evidence‑based consensus diagnostic criteria for HHV‑8‑negative/idiopathic multicentric Castleman disease. Blood. 2017;12:1646–1657.
- Fajgenbaum DC. Novel insights and therapeutic approaches in idiopathic multicentric Castleman disease. Blood. 2018;22:2323–2330.
- Munshi N, Mehra M, van de Velde H, et al. Use of a claims database to characterize and estimate the incidence rate for Castleman disease. Leuk Lymphoma. 2015;5:1252–1260.
- Masaki Y, Kawabata H, Fujimoto S, et al. Epidemiological analysis of multicentric and unicentric Castleman disease and TAFRO syndrome in Japan. J Clin Exp Hematop. 2019;4:175–178.
- Parez N, Bader‑Meunier B, Roy CC, et al. Paediatric Castleman disease: report of seven cases and review of the literature. Eur J Pediatr. 1999;8:631–637.
- Talat N, Belgaumkar AP, Schulte KM. Surgery in Castleman‘s disease: a systematic review of 404 published cases. Ann Surg. 2012;4:677–684.
- Zhang L, Li Z, Cao X, et al. Clinical spectrum and survival analysis of 145 cases of HIVnegative Castleman’s disease: renal function is an important prognostic factor. Sci Rep. 2016;6:23831.
- Powles T, Stebbing J, Bazeos A, et al. The role of immune suppression and HHV‑8 in the increasing incidence of HIV‑associated multicentric Castleman‘s disease. Ann Oncol. 2009;4:775–779.
- Du MQ, Bacon CM, Isaacson PG. Kaposi sarcoma‑associated herpesvirus/human herpesvirus 8 and lymphoproliferative disorders. J Clin Pathol. 2007;12:1350–1357.
- Oksenhendler E, Boutboul D, Fajgenbaum D, et al. The full spectrum of Castleman disease: 273 patients studied over 20 years. Br J Haematol. 2018;2:206–216.
- Chang KC, Wang YC, Hung LY, et al. Monoclonality and cytogenetic abnormalities in hyaline vascular Castleman disease. Mod Pathol. 2014;6:823–831.
- Li Z, Lan X, Li C, Zhang Y, et al. Recurrent PDGFRB mutations in unicentric Castleman disease. Leukemia. 2019;4:1035–1038.
- Reichard KK, Robinett S, Foucar MK. Clonal cytogenetic abnormalities in the plasma cell variant of Castleman disease. Cancer Genet. 2011;6:323–327.
- Cokelaere K, Debiec‑Rychter M, De Wolf‑Peeters C, et al. Hyaline vascular Castleman‘s disease with HMGIC rearrangement in follicular dendritic cells: molecular evidence of mesenchymal tumorigenesis. Am J Surg Pathol. 2002;5:662–669.
- Chen WC, Jones D, Ho CL, et al. Cytogenetic anomalies in hyaline vascular Castleman disease: report of two cases with reappraisal of histogenesis. Cancer Genet Cytogenet. 2006;2:110–117.
- Uldrick TS, Polizzotto MN, Yarchoan R. Recent advances in Kaposi sarcoma herpesvirusassociated multicentric Castleman disease. Curr Opin Oncol. 2012;5:495–505.
- Suda T, Katano H, Delsol G, et al. HHV‑8 infection status of AIDS‑unrelated and AIDS‑associated multicentric Castleman‘s disease. Pathol Int. 2001;9:671–679.
- Brousset P, Cesarman E, Meggetto F, et al. Colocalization of the viral interleukin‑6 with latent nuclear antigen‑1 of human herpesvirus‑8 in endothelial spindle cells of Kaposi‘s sarcoma and lymphoid cells of multicentric Castleman‘s disease. Hum Pathol. 2001;1:95–100.
- Leger‑Ravet MB, Peuchmaur M, Devergne O, et al. Interleukin‑6 gene expression in Castleman’s disease. Blood. 1991;11:2923–2930.
- Oksenhendler E, Carcelain G, Aoki Y, et al. High levels of human herpesvirus 8 viral load, human interleukin‑6, interleukin‑10, and C reactive protein correlate with exacerbation of multicentric castleman disease in HIVinfected patients. Blood. 2000;6:2069–2073.
- Nakaya Y, Ishii N, Kasamatsu Y, et al. Human herpesvirus 8‑positive multicentric Castleman disease with germinotropic plasmablastic aggregates: Overlapping spectrum of human herpesvirus 8‑associated lymphoproliferative disorder. Pathol Int. 2020;8:574–580.
- Guihot A, Oksenhendler E, Galicier L, et al. Multicentric Castleman disease is associated with polyfunctional effector memory HHV‑8‑specific CD8+ T cells. Blood. 2008;3:1387–1395.
- Bower M, Newsom‑Davis T, Naresh K, et al. Clinical Features and Outcome in HIV‑Associated Multicentric Castleman‘s Disease. J Clin Oncol. 2011;18:2481–2486.
- Bower M. How I treat HIV‑associated multicentric Castleman disease. Blood. 2010;22:4415–4421.
- Marcelin AG, Aaron L, Mateus C, et al. Rituximab therapy for HIV‑associated Castleman disease. Blood. 2003;8:2786–2788.
- Uldrick TS, Polizzotto MN, Aleman K, et al. Rituximab plus liposomal doxorubicin in HIV‑infected patients with KSHV‑associated multicentric Castleman disease. Blood. 2014;24:3544–3552.
- Nabel CS, Sameroff S, Shilling D, et al. Virome capture sequencing does not identify active viral infection in unicentric and idiopathic multicentric Castleman disease. PLoS One. 2019;6:e0218660.
- Liu AY, Nabel CS, Finkelman BS, et al. Idiopathic multicentric Castleman‘s disease: a systematic literature review. Lancet Haematol. 2016;4:e163–175.
- Kanai K, Sawai S, Sogawa K, et al. Markedly upregulated serum interleukin‑12 as a novel biomarker in POEMS syndrome. Neurology. 2012;6:575–582.
- Wang C, Huang XF, Cai QQ, et al. Remarkable expression of vascular endothelial growth factor in bone marrow plasma cells of patients with POEMS syndrome. Leuk Res. 2016;50:78–84.
- Menke DM, Tiemann M, et al. Diagnosis of Castleman‘s disease by identification of an immunophenotypically aberrant population of mantle zone B lymphocytes in paraffin‑embedded lymph node biopsies. Am J Clin Pathol. 1996;3:268–276.
- Boutboul D, Fadlallah J, Chawki S, et al. Treatment and outcome of unicentric Castleman disease: a retrospective analysis of 71 cases. Br J Haematol. 2019;2:269–273.
- van Rhee F, Oksenhendler E, Srkalovic G, et al. International evidence‑based consensus diagnostic and treatment guidelines for unicentric Castleman disease. Blood Adv. 2020;23:6039–6050.
- Ostrowska B, Romejko‑Jarosińska J, Domańska‑Czyż K, et al. Idiopathic multicentric Castleman disease: pathogenesis, clinical presentation and recommendations for treatment based on the Castleman Disease Collaborative Network (CDCN). Acta Haematologica Polonica. 2021;52:29–37.
- Dispenzieri A, Fajgenbaum DC. Overview of Castleman disease. Blood. 2020;16:1353–1364.
- Oksenhendler E, Galicier L. Human herpesvirus 8‑related Castleman disease in the absence of HIV infection. Clin Infect Dis. 2013;6:833–842.
- Frizzera G, Peterson BA, Bayrd ED, et al. A systemic lymphoproliferative disorder with morphologic features of Castleman‘s disease: clinical findings and clinicopathologic correlations in 15 patients. J Clin Oncol. 1985;9:1202–1216.
- van Rhee F, Voorhees P, Dispenzieri A, el al. International, evidence‑based consensus treatment guidelines for idiopathic multicentric Castleman disease. Blood. 2018;132:2115–2124.
- Iwaki N, Fajgenbaum DC, Nabel CS, et al. Clinicopathologic analysis of TAFRO syndrome demonstrates a distinct subtype of HHV‑8‑negative multicentric Castleman disease. Am J Hematol. 2016;2:220–226.
- Masaki Y, Kawabata H, Takai K, et al. Proposed diagnostic criteria, disease severity classification and treatment strategy for TAFRO syndrome, 2015 version. Int J Hematol. 2016;6:686–692.
- Nishimura Y, Hanayama Y, Fujii N, et al. Comparison of the clinical characteristics of TAFRO syndrome and idiopathic multicentric Castleman disease in general internal medicine: a 6‑year retrospective study. Intern Med J. 2020;2:184–191.
- Dispenzieri A. POEMS syndrome: 2017 Update on diagnosis, risk stratification, and management. Am J Hematol. 2017;8:814–829.
- Fajgenbaum DC. Novel insights and therapeutic approaches in idiopathic multicentric Castleman disease. Blood. 2018;22:2323–2330.
- Chen LYC, Mattman A, Seidman MA, Carruthers MN. IgG4‑related disease: what a hematologist needs to know. Haematologica. 2019;3:444–455.
- Maritati F, Peyronel F, Vaglio A. IgG4‑related disease: a clinical perspective. Rheumatology (Oxford). 2020;59(Suppl 3):iii123‑iii131.
- Abramson JS. Diagnosis and Management of Castleman Disease. J Natl Compr Canc Netw. 2019;17:1417–1419.
- van Rhee F, Wong RS, Munshi N, et al. Siltuximab for multicentric Castleman‘s disease: a randomised, double‑blind, placebo‑controlled trial. Lancet Oncol. 2014;9:966–974.
- Gaddey HL, Riegel AM. Unexplained Lymphadenopathy: Evaluation and Differential Diagnosis. Am Fam Physician. 2016;11:896–903.
- Kanwar VS. Lymphadenopathy. Lymphadenopathy. New York, NY: WebMD. http://emedicine.medscape.com/article/956340‑overview#showall.
- Lucey BC, Stuhlfaut JW, Soto JA. Mesenteric lymph nodes seen at imaging: causes and significance. Radiographics. 2005;2:351–365. doi: 10.1148/rg.252045108.
- Karaman A, Karaman I, Cavusoglu YH, Erdogan D. The ongoing problem with peripheral lymphadenopathies: which ones are malignant? Pediatr Surg Int. 2010;3:247–250.
- Michalk D, Schönau E (Hrsg.) Differenzialdiagnose Pädiatrie (2018). Elsevier, Amsterdam.