V léčbě obezity už není důvod k frustraci – ani pacientů, ani lékařů

Obezita je dnes považována za jedno z nejvýznamnějších civilizačních onemocnění – zvyšuje riziko diabetu 2. typu, kardiovaskulárních chorob i předčasného úmrtí. Přestože základem léčby zůstává úprava stravy a životního stylu, v posledních letech se otevírají zcela nové možnosti farmakologické terapie, které přinášejí výrazně lepší výsledky než dosavadní přístupy. Jedním z prvních moderních přípravků byl dulaglutid, agonista GLP‑1 receptoru, který kromě podpory redukce hmotnosti příznivě ovlivňuje i glykemickou kontrolu. Na první generaci GLP‑1 analog navázaly další, účinnější přípravky. Mezi nimi tirzepatid – duální agonista GLP‑1 a GIP receptorů, jenž prokázal v klinických studiích mimořádný efekt v redukci hmotnosti. Do budoucna pak velké naděje vzbuzuje orforglipron, první perorální agonista GLP‑1 receptoru, který zatím není v běžné klinické praxi dostupný, ale jeho výsledky v probíhajících studiích ukazují na skutečný průlom v léčbě obezity. Společně tyto léky naznačují, že obezita již nemusí být nahlížena jen jako nezvratný problém, ale jako onemocnění, které lze cíleně a účinně léčit.
Je tirzepatid u pacientů s diabetem 2. typu a ASKVO účinnější než dulaglutid?
Nová data studie SURPASS‑CVOT ukazují, že u dospělých s diabetem 2. typu a prokázaným aterosklerotickým kardiovaskulárním onemocněním (ASKVO) vykázal tirzepatid podobný efekt na výskyt kardiovaskulárních příhod jako dulaglutid, tedy lék, který již dříve prokázal kardiovaskulární protektivitu ve srovnání s placebem ve studii REWIND [1,2]. U rizika celkové mortality došlo u skupiny užívající tirzepatid ke statisticky významnému snížení rizika o 16 procent ve srovnání se skupinou pacientů, kteří užívali dulaglutid.
Do studie SURPASS‑CVOT bylo zařazeno více než 13 000 účastníků s diabetem 2. typu a ASKVO, kteří byli randomizováni k subkutánnímu podávání tirzepatidu (5, 10 nebo 15 mg jednou týdně) nebo dulaglutidu 1,5 mg jednou týdně. Všichni pacienti dostávali standardní léčbu ASKVO a strategie kontroly glykémie mohla být upravena pomocí neinkretinových antidiabetik. Primárním výsledkem studie byla non‑inferiorita rizika závažných kardiovaskulárních příhod mezi skupinami tirzepatidu a dulaglutidu, přičemž závažné nežádoucí kardiovaskulární příhody (MACE) tvořila kombinace úmrtí z kardiovaskulární příčiny, infarktu myokardu a cévní mozkové příhody.
Během mediánu sledování trvajícího čtyři roky splnil tirzepatid kritérium non‑inferiority, přičemž došlo k numerickému snížení příhod o osm procent ve srovnání s dulaglutidem. Výsledky byly podobné, i když byly všechny tři složky MACE hodnoceny jednotlivě.
Analýza, která nepřímo porovnávala výsledky studie SURPASS‑CVOT (tirzepatid vs. dulaglutid) a REWIND (dulaglutid vs. placebo) s cílem ukázat efekt tirzepatidu, pokud by byl srovnáván s placebem místo dulaglutidu, ukázala snížení rizika tříbodového MACE o 28 procent pro primární cíl studie SURPASS‑CVOT. V tomto nepřímém modelu byl tirzepatid spojen s nižším rizikem výskytu jednotlivých kardiovaskulárních příhod, včetně kardiovaskulárního úmrtí/infarktu myokardu/cévní mozkové příhody, úmrtí z jakékoli příčiny a kardiovaskulárního úmrtí/srdečního selhání, přičemž každý z těchto výsledků dosáhl statistické významnosti.
Kromě kardiovaskulárních výsledků měl tirzepatid příznivé účinky na HbA1c, tělesnou hmotnost a změnu odhadované glomerulární filtrace ve srovnání s dulaglutidem.
Závažné nežádoucí účinky se vyskytly přibližně u 32 procent pacientů v obou skupinách, nejčastěji nevolnost a průjem. Bezpečnost a snášenlivost obou srovnávaných přípravků byla v souladu s již známým bezpečnostním profilem tirzepatidu a dulaglutidu.
Výsledky studie SURPASS‑CVOT prokazují kardioprotektivní účinek tirzepatidu a zároveň ukazují další výhody, včetně větší ochrany ledvin a snížení celkového rizika úmrtí ve srovnání s dulaglutidem. Tyto výsledky posilují argumenty pro tirzepatid jako potenciální první volbu v léčbě osob s diabetem 2. typu a kardiovaskulárním onemocněním.
Tirzepatid zlepšuje kontrolu glykémie a BMI u dětí a dospívajících s diabetem 2. typu
Výsledky studie SURPASS‑PEDS prezentované na letošním výročním zasedání Evropské asociace pro studium diabetu (EASD) a publikované v časopise Lancet [3] ukazují, že tirzepatid může u dětí a dospívajících ve věku 10–17 let s nedostatečně kontrolovaným diabetem 2. typu přinést klinicky významné zlepšení kontroly glykémie a redukci hmotnosti.
Diabetu 2. typu u dětí a dospívajících rychle přibývá, a to zejména v souvislosti s nárůstem prevalence obezity. Možnosti účinné léčby ke zlepšení glykémie u této populace jsou omezené a stávající postupy mají nižší efekt než u dospělých a neprokazují klinicky významný vliv na BMI.
Tirzepatid, dlouhodobě působící agonista receptorů GIP a GLP‑1 podávaný jednou týdně, je schválen k léčbě dospělých s diabetem 2. typu a k léčbě dospělých s nadváhou nebo obezitou. Na hodnocení účinku tirzepatidu u mladých pacientů s nedostatečně kontrolovaným diabetem 2. typu se zaměřila studie SURPASS‑PEDS.
Celkem 99 mladých pacientů (10–17 let) s nedostatečně kontrolovaným diabetem 2. typu bylo randomizováno v poměru 1 : 1 : 1 k léčbě tirzepatidem 5 mg, tirzepatidem 10 mg nebo placebem po dobu 30 týdnů s následným 22týdenním otevřeným prodloužením. Primárním cílem byla superiorita tirzepatidu oproti placebu ve změně HbA1c po 30 týdnech.
Ve 30. týdnu byl tirzepatid v porovnání s placebem účinnější při snižování HbA1c, s průměrným snížením o 2,23 procenta ve skupině užívající tirzepatid oproti nárůstu o 0,05 procenta ve skupině užívající placebo. Glykemická účinnost byla při léčbě tirzepatidem udržována až 52 týdnů. Tirzepatid také vedl k významnému snížení BMI o 7,4 procenta a 11,2 procenta ve skupinách s dávkou 5 mg a 10 mg, ve srovnání s 0,4 procenta ve skupině s placebem.
Nejčastější nežádoucí účinky byly gastrointestinální, mírné až středně závažné, především při titraci dávky, a s časem se snižovaly. K ukončení léčby došlo u 6,3 procenta účastníků ve skupině s tirzepatidem 5 mg a u 0 procent ve skupině s tirzepatidem 10 mg a placebem. Nebyly hlášeny žádné epizody závažné hypoglykémie. Záchrannou glykemickou terapii zahájilo 18 procent účastníků ve skupině s placebem a žádný ve skupině s tirzepatidem.
Tirzepatid prokázal významné zlepšení glykemické kontroly a BMI ve srovnání s placebem. Tyto účinky přetrvávaly po dobu jednoho roku.
Zlepší orforglipron adherenci k léčbě?
Orforglipron je první nepeptidový perorální agonista receptoru pro GLP‑1, podává se jednou denně ve formě tablety. Nabízí tak významnou výhodu jak oproti existujícím peptidovým GLP‑1 agonistům, které jsou aplikovány subkutánně a u některých pacientů mohou limitovat iniciaci a adherenci léčby, tak oproti perorálním formám peptidových GLP‑1 agonistů, které limituje složitější způsob užívání. Orforglipron zatím není v běžné klinické praxi dostupný, ale jeho výsledky v probíhajících studiích ukazují na skutečný průlom v léčbě obezity.
Účinnost a bezpečnost orforglipronu u dospělých s obezitou bez diabetu byla hodnocena ve studii ATTAIN‑1 [4], do které bylo zařazeno 3 127 účastníků, kteří dostávali orforglipron v dávkách 6 mg, 12 mg nebo 36 mg jednou denně po dobu 72 týdnů v kombinaci se zdravou stravou a fyzickou aktivitou. Primárním cílem byla procentuální změna tělesné hmotnosti od výchozí hodnoty do 72. týdne.
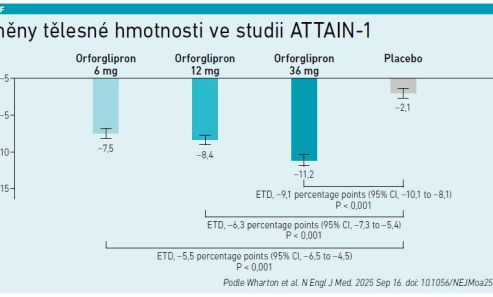 Po 72 týdnech léčby došlo u všech dávek orforglipronu k signifikantnímu a klinicky významnému úbytku tělesné hmotnosti −7,5 až −11,2 procenta v závislosti na dávce, zatímco ve skupině placeba to bylo jen −2,1 procenta. Ve skupině s dávkou 36 mg dosáhlo 54,6 procenta pacientů redukce hmotnosti ≥ 10 procent, 36 procent redukce ≥ 15 procent a 18,4 procenta redukce ≥ 20 procent, zatímco odpovídající hodnoty u placeba byly 12,9, 5,9 a 2,8 procenta. Tyto rozdíly byly statisticky významné. Všechny skupiny orforglipronu také vykázaly významnější snížení BMI a absolutní tělesné hmotnosti oproti placebu. V rámci podskupiny pacientů s BMI <35 kg/m2 byly výsledky zvláště klinicky relevantní (viz graf).
Po 72 týdnech léčby došlo u všech dávek orforglipronu k signifikantnímu a klinicky významnému úbytku tělesné hmotnosti −7,5 až −11,2 procenta v závislosti na dávce, zatímco ve skupině placeba to bylo jen −2,1 procenta. Ve skupině s dávkou 36 mg dosáhlo 54,6 procenta pacientů redukce hmotnosti ≥ 10 procent, 36 procent redukce ≥ 15 procent a 18,4 procenta redukce ≥ 20 procent, zatímco odpovídající hodnoty u placeba byly 12,9, 5,9 a 2,8 procenta. Tyto rozdíly byly statisticky významné. Všechny skupiny orforglipronu také vykázaly významnější snížení BMI a absolutní tělesné hmotnosti oproti placebu. V rámci podskupiny pacientů s BMI <35 kg/m2 byly výsledky zvláště klinicky relevantní (viz graf).
Kromě redukce hmotnosti orforglipron vedl ke zlepšení kardiometabolických parametrů, včetně obvodu pasu, systolického krevního tlaku, triglyceridů, non‑HDL cholesterolu a hsCRP. Tato pozitiva naznačují, že farmakologická modulace GLP‑1 receptoru perorální formou nejen podporuje úbytek hmotnosti, ale může mít i příznivý dopad na metabolické rizikové faktory spojené s obezitou.
Orforglipron byl dobře tolerován, přičemž nejčastější nežádoucí účinky byly gastrointestinální, většinou mírné až střední závažnosti. Přerušení léčby z důvodu nežádoucích účinků se pohybovalo mezi 5,3–10,3 procenta ve skupinách s aktivním lékem a 2,7 procenta u placeba, což odpovídá bezpečnostnímu profilu známému u jiných GLP‑1 agonistů.
Tyto výsledky ukazují, že orforglipron představuje perspektivní perorální léčbu obezity, která kombinuje účinnost redukce hmotnosti s praktickými výhodami perorální aplikace. Díky tomu může zlepšit adherenci, rozšířit dostupnost terapie a nabídnout pacientům alternativu jak k subkutánním, tak i v současnosti dostupným perorálním GLP‑1 agonistům. Studie ATTAIN‑1 potvrzuje potenciál orforglipronu jako bezpečné a účinné volby v dlouhodobém managementu obezity a přidružených metabolických rizik.
Reference
- Nicholls SJ, et al. S18a. Presented at: European Association for the Study of Diabetes Annual Meeting; Sept. 15‑19, 2025; Vienna.
- Swain E. Tirzepatide similar to dulaglutide for CV outcomes but tied to lower rates of death. Healio. 2025. [online]. [cit. 2025‑09‑30]. Dostupné z: https://www.healio.com/news/endocrinology/20250919/tirzepatide‑similar‑to‑dulaglutide‑for‑cv‑outcomes‑but‑tied‑to‑lower‑rates‑of‑death.
- Hannon TS, Chao LC, Barrientos‑Pérez M, et al. Efficacy and safety of tirzepatide in children and adolescents with type 2 diabetes (SURPASS‑PEDS): a randomised, double‑blind, placebo‑controlled, phase 3 trial. Lancet. 2025 Sep 17:S0140‑6736(25)01774‑X. doi: 10.1016/S0140‑6736(25)01774‑X. Epub ahead of print.
- Wharton S, Aronne LJ, Stefanski A, et al.; ATTAIN‑1 Trial Investigators. Orforglipron, an Oral Small‑Molecule GLP‑1 Receptor Agonist for Obesity Treatment. N Engl J Med. 2025 Sep 16. doi: 10.1056/NEJMoa2511774. Epub ahead of print.