Cesta pacienta s maligním melanomem

Nastavení správného algoritmu u vyšetření pacienta s podezřením na maligní melanom je z hlediska diagnostiky a následné terapie zcela zásadní. Ne vždy ale probíhá optimálně, což může přinést celou řadu komplikací jak pro ošetřujícího lékaře v ambulanci, tak pro pacienta samotného. Cesta pacienta s melanomem má svoje jasně definovaná pravidla a důkladně se jí věnují i Klinická doporučení pro diagnostiku a terapii melanomu, která byla nedávno uveřejněna na portálu uzis.cz
Kdo má rád informace v knižní podobě, určitě sáhne po obdobně aktuální knize o 276 stranách informací, tabulek, diagnostických a terapeutických algoritmů, doprovázených bohatým obrazovým atlasem, autorů prof. MUDr. Moniky Arenbergerové, Ph.D., MUDr. Marka Páska a prof. MUDr. Petra Arenbergera, DrSc., MBA, FCMA, Maligní melanom – diagnostika a léčba, kterou vydalo nakladatelství Maxdorf v únoru 2023.
Dermatoskopie a histologie jako první krok
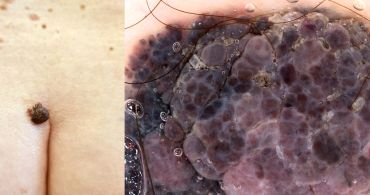
Jako styčný důstojník v algoritmu cesty pacienta funguje samotný dermatolog, který jednotlivé kroky managementu koordinuje a řídí. Pokud dermatolog pojme podezření na maligní melanom, měl by suspektní lézi také neodkladně vyšetřit pomocí dermatoskopu, ať už ručního, či digitálního. U nás na Dermatovenerologické klinice 3. LF UK a FNKV vyšetřujeme dermatoskopicky všechny méně či více podezřelé pigmentové léze. Ne každý melanom je totiž možné přesně diagnostikovat pouhým okem, protože klinicky se může takový melanom jevit zcela netypicky (viz obr. dole).
Dermatoskopie může odhalit i klinicky nesuspektní léze, a vést tak ke zlepšení diagnostiky u pigmentových projevů (statisticky významné zvýšení senzitivity v záchytu maligního melanomu oproti pouhému lidskému oku). Tato neinvazivní diagnostická metoda nám rovněž umožňuje odlišit primární melanom od metastázy, což je velké pozitivum, protože diferenciace mezi danými jednotkami často bývá bez klinické korelace obtížná i pro samotného histopatologa. Díky dermatoskopu je tak možné například v klinicky nejasných případech akrálních lézí osvětlit, kdy jde o subkorneální hemoragii, benigní akrální névus a kdy už pracujeme s akrolentiginózním maligním melanomem, u kterého může být v dermatoskopu patrný např. šedý závoj, celková chaotičnost léze či radiální proudění na periferii.
Dermatoskopii bohatě využíváme také při našich preventivních akcích Stan proti melanomu, které probíhají už téměř dvě desítky let (viz obr. na protější straně). I letos budeme opět vyšetřovat pacienty s podezřelými pigmentovými névy a dalšími kožními útvary v Praze na Václavském náměstí ve středním pásu na úrovni Opletalovy ulice 15. a 16. května, v Brně na náměstí Svobody 22. května a v Ostravě v Shopping Park Avion 23. května, vždy od 10 do 18 hodin (www.denmelanomu.cz).
Pokud s pomocí dermatoskopu dojde k vyslovení podezření na diagnózu maligního melanomu, přichází na řadu bioptická excize s následným odesláním vzorku na histopatologické vyšetření, které by mělo být provedeno optimálně co nejrychleji (nejpozději do 30 dnů od vyslovení dermatologické suspekce). Histopatolog pak buď potvrdí, či vyvrátí podezření na maligní melanom. V případě potvrzení diagnózy se zahájí následná chirurgická terapie s případným dovyšetřením sentinelové lymfatické uzliny.
Zásadní je šíře chirurgického lemu při reexcizi melanomu
Na trase pacienta od diagnostiky k léčbě by měl každou suspektní pigmentovou lézi vždy jako první vidět dermatolog, ten by následně podle našeho algoritmu měl odeslat pacienta k chirurgovi. Opačná cesta není správná. Dermatolog by měl pacienta odesílat k chirurgovi s jasným doporučením, jak lézi excidovat (provedení bioptické excize k ověření diagnózy). Dermatochirurg či chirurg tedy útvar vyřízne na základě doporučení dermatologa. V případě, že je nutné v rámci diagnostiky provést i biopsii sentinelové lymfatické uzliny a také nastavit adjuvantní léčbu, odesílá dermatolog pacienta přímo do dermatoonkologického nebo komplexního onkologického centra. Dermatolog a onkodermatolog by měli po celou dobu zůstávat těmi, kdo rozhodují o následném postupu léčby.
 Potíže mohou nastat v okamžiku, kdy pacient navštíví nejprve chirurga a až následně dermatologa. Pokud totiž chirurg zvolí již primárně tzv. široký chirurgický lem excize, dochází ke zhoršení možnosti následného spolehlivého detekování a vyšetření sentinelové uzliny, což může vést až k nenasazení adjuvantní terapie u pacientů, u kterých by jinak tato terapie byla indikována. V dobře nastaveném algoritmu má být prvním krokem takzvaná bioptická excize, to znamená vyříznutí celé podezřelé léze, ale bez širokého ochranného lemu. Teprve po určení tloušťky nádoru (index podle Breslowa) se určuje velikost chirurgického lemu pro reexcizi a posuzuje se nutnost odebrání a vyšetření sentinelové lymfatické uzliny.
Potíže mohou nastat v okamžiku, kdy pacient navštíví nejprve chirurga a až následně dermatologa. Pokud totiž chirurg zvolí již primárně tzv. široký chirurgický lem excize, dochází ke zhoršení možnosti následného spolehlivého detekování a vyšetření sentinelové uzliny, což může vést až k nenasazení adjuvantní terapie u pacientů, u kterých by jinak tato terapie byla indikována. V dobře nastaveném algoritmu má být prvním krokem takzvaná bioptická excize, to znamená vyříznutí celé podezřelé léze, ale bez širokého ochranného lemu. Teprve po určení tloušťky nádoru (index podle Breslowa) se určuje velikost chirurgického lemu pro reexcizi a posuzuje se nutnost odebrání a vyšetření sentinelové lymfatické uzliny.
Často také dochází k prodlení mezi excizí tumoru a biopsií sentinelové lymfatické uzliny. Pokud by měla být tato uzlina odstraněna až s odstupem několika měsíců, nemusí být již indikována z důvodu příliš dlouhého časového odstupu.
Špatným managementem se může stát i to, že se pacient ztratí ve zdravotním systému, ale čas běží dále a pacient vyhledá dalšího odborníka, až když má nějaký problém (většinou lokální či regionální rekurenci onemocnění, v horším případě až při symptomech ze vzdálených metastáz).
V případě melanoma in situ včetně lentigo maligna je doporučena reexcize s chirurgickým lemem 0,5 cm. Toto doporučení však není založeno na evidence‑based přístupu. Z těchto důvodů se chirurgický lem pro reexcizi melanoma in situ ve většině doporučených postupů pohybuje od pouhého dosažení kompletní excize (negativní okraje) při použití mikroskopicky kontrolované excize až po chirurgický lem 1,0 cm u tumorů v oblasti hlavy a krku s rozsáhlým aktinickým poškozením. Pokud je Breslow ≤ 2,0 mm, je doporučen chirurgický lem pro reexcizi 1,0 cm. Na druhou stranu v případech, kdy je Breslow > 2,0 mm, se doporučuje chirurgický lem 2,0 cm. V případě bezpečnostních lemů se vždy bavíme o lemech chirurgických, tedy lemech, které jsou měřeny samotným operatérem a ne histopatologem. Operatér (chirurg či dermatochirurg) musí vždy zcela jasně zapsat do operačního protokolu velikost použitého chirurgického lemu, tedy „provedena bioptická excize s lemem 2–3 mm“, nebo „provedena chirurgická široká excize melanomu s lemem 1,0 cm (anebo 2,0 cm)“.
Při hodnocení histopatologického reportu mohou nastat tři situace:
- Bylo dosaženo R0 excize, tedy nádor byl odstraněn kompletně, laterální okraje a spodina excize jsou vedeny mimo nádor.
- Bylo dosaženo R1 excize, tedy nádor nebyl odstraněn kompletně, je přítomno mikroskopické reziduum tumoru, dochází k dosahu či přesahu v oblasti laterálních okrajů excize či spodiny.
- Bylo dosaženo R2 excize, tedy nádor nebyl odstraněn kompletně, je přítomno makroskopické reziduum tumoru, většinou bývá R2 excize již klinicky zjevná, jedná se často o situace tzv. punch biopsie provedené z rozsáhlých tumorů za účelem pouhého potvrzení diagnózy. Vzdálenost tumoru od laterálního okraje a spodiny excize měřená histopatologem je klinicky relevantní pouze v případech, kdy je dosaženo výrazné diskrepance mezi chirurgickým lemem (uvedeným v operačním protokolu) a vzdáleností změřenou histopatologem. V těchto případech mohlo dojít k tzv. subklinickému šíření nádoru (často amelanotickou komponentou) anebo byl nádor lokalizován v anatomické oblasti s výrazným aktinickým poškozením (zejména obličej), což mohlo vést operatéra ke zkreslení klinického ohraničení tumoru. Pouze v těchto případech je přípustné provedení další reexcize melanomu. Reexcizi melanomu neprovádíme v případě, kdy máme v operačním protokolu jasně zapsán chirurgický lem 1,0 cm nebo 2,0 cm a výsledná vzdálenost měřená histopatologem je v korelaci s možnou retrakcí vzorku ve fixačním činidle (až cca 30 %).
Odstranění sentinelové uzliny podle velikosti indexu Breslowa
Pravidla pro biopsii sentinelové uzliny byla v poslední době pozměněna. Její odstranění zatím běžně indikujeme při indexu podle Breslowa > 1,0 mm. Podle zatím poslední 8. edice klasifikace AJCC maligního melanomu jsou však kritéria přísnější a biopsii sentinelové uzliny bychom měli začít zvažovat již u pacientů, kteří mají index podle Breslowa < 0,8 mm s ulcerací, anebo u pacientů, kteří mají ndex podle Breslowa 0,8–1,0 mm s ulcerací nebo bez ní.
Věk je dalším faktorem, který rozhoduje o provedení biopsie sentinelové uzliny, a to zejména u melanomu s tloušťkou pod 1,0 mm. Pokud jde o mladšího pacienta ve věkové kategorii ≤ 42 let, je vyšší pravděpodobnost, že sentinelová uzlina bude infiltrována maligním melanomem, proto obecně u mladších pacientů volíme tento výkon častěji. Mezi další rizikové faktory, které nejsou zahrnuty v 8. edici AJCC klasifikace melanomu, avšak mohou zvyšovat pravděpodobnost pozitivity sentinelové uzliny, patří lokalizace melanomu v oblasti hlavy a krku, přítomnost lymfovaskulární invaze a konečně počet mitóz ≥ 2/mm2. Přítomnost těchto rizikových faktorů bychom měli zhodnotit zejména v případě úvahy o indikaci biopsie sentinelové uzliny u melanomů s hodnotou indexu podle Breslowa < 1,0 mm. Klíčové je však před indikací tohoto výkonu při indexu podle Breslowa < 1,0 mm vždy výkon prodiskutovat s pacientem na základě zhodnocení poměru rizika a případného benefitu z biopsie sentinelové uzliny a finální indikaci provést v souladu s přáním pacienta.
Naopak sentinelovou uzlinu zpravidla nevyšetřujeme ve věku od 75 let výše, u polymorbidních pacientů, za přítomnosti vyššího ECOG PS > 2 (tedy při špatném fyzickém statusu) a obecně při nízké hodnotě indexu podle Breslowa (pT1a, tedy index podle Breslowa < 0,8 mm bez ulcerace). Před vyšetřením sentinelové uzliny by měl být vždy proveden vstupní staging, u pacientů s hodnotou indexu podle Breslowa až do pT3a (index podle Breslowa 2,1–4,0 mm bez ulcerace) stačí provádět před vyšetřením sentinelové uzliny pouze ultrazvuk spádových lymfatických uzlin a břicha a RTG vyšetření plic.
U rizikovějších pacientů s hodnotou indexu podle Breslowa od pT3b (index podle Breslowa 2,1–4,0 mm s ulcerací, index podle Breslowa ≥ 4,1 mm s ulcerací nebo bez ní) provádíme kromě ultrazvuku spádových lymfatických uzlin také celotělové CT vyšetření. U nás na pracovišti přistupujeme i k magnetické rezonanci mozku ve snaze časně detekovat případné mozkové metastázy. Biopsie sentinelové lymfatické uzliny společně s reexcizí histologicky ověřeného melanomu by měla být provedena co nejrychleji, optimálně do šesti až osmi týdnů od excize primárního tumoru (nejpozději však do 100 dní od kompletní excize melanomu). Histopatolog by měl v případě pozitivní sentinelové uzliny do hlášení zapsat velikost mikrometastázy, dále ev. přítomnost jejího extrakapsulárního prorůstání a v neposlední řadě také její lokalizaci v sentinelové uzlině. Velikost mikrometastázy můžeme považovat za tzv. uzlinový index podle Breslowa a přítomnost extrakapsulárního prorůstání za tzv. uzlinovou ulceraci. Jedná se tak o další důležité prognostické parametry, které (kromě klasického indexu podle Breslowa a ulcerace primárního tumoru) statisticky významně ovlivňují pětileté přežití v asociaci s melanomem.
Adjuvantní léčba pomocí protilátek anti‑PD‑1 a inhibitorů BRAF/MEK
 Pokud je sentinelová uzlina negativní, pacienta pouze sledujeme, při pozitivním výsledku naopak můžeme indikovat adjuvantní imunoterapii monoklonální protilátkou anti‑PD‑1 (pembrolizumab/nivolumab) nezávisle na statusu mutace BRAF V600, anebo adjuvantní cílenou léčbu kombinací inhibitoru BRAF a inhibitoru MEK (dabrafenib a trametinib) v případě přítomnosti mutace BRAF V600. Adjuvantní terapií podávanou po dobu jednoho kalendářního roku by měli být zajištěni všichni pacienti, kteří mají maligní melanom s vysokým rizikem rekurence onemocnění. Konkrétně se jedná o pacienty ve stadiu III (IIIA pouze za přítomnosti mikrometastázy v sentinelové uzlině o velikosti > 1,0 mm, IIIB, IIIC nebo IIID) dle 8. edice klasifikace AJCC melanomu, případně pacienti ve stadiu IV (po kompletním odstranění vzdálených metastáz), kterým léčbu nabízíme z důvodu snížené pravděpodobnosti pěti‑ a desetiletého přežití v asociaci s melanomem. Adjuvantní terapie však nemusí být zahájena u každého pacienta, který splňuje parametry vysoce rizikového melanomu. Při úvaze o zahájení adjuvance musíme brát v potaz jednak věk pacienta, jeho ECOG PS, komorbidity, compliance a v neposlední řadě zájem pacienta o adjuvantní léčbu jako takovou. Vždy bychom měli u každého pacienta pečlivě zvážit všechny potenciální přínosy léčby (RFS, DMFS) dle individuálního stadia onemocnění pacienta a možnosti komplikací v asociaci s terapií (imunitně podmíněné nežádoucí účinky léčby u imunoterapie, vyšší míra akutní toxicity u cílené terapie). Pacienti ve stadiu IIIA s velikostí mikrometastázy v sentinelové uzlině < 1,0 mm mohou dle úhradové vyhlášky být adjuvantně léčeni imunoterapií nebo cílenou terapií, avšak tito pacienti nebyli zařazeni do žádné z registračních studií pro adjuvantní terapii, vzhledem k jejich lepší prognóze a nižšímu riziku rekurence choroby. Z těchto důvodů není přítomno jasné doporučení pro zahájení adjuvantní terapie u těchto pacientů (riziko z adjuvantní terapie v těchto případech může převyšovat potenciální benefit z dané léčby). Do indikace adjuvantní terapie se v brzké době budou zahrnovat i pacienti ve stadiu IIB (pT3b, pT4a) a IIC (pT4b), tedy pacienti s vysoce rizikovým lokálně pokročilým melanomem, avšak s negativním výsledkem biopsie sentinelové lymfatické uzliny, u kterých bude nově možné nasadit pembrolizumab v adjuvantním režimu. Doposud neexistuje žádné jednoznačné doporučení, zda bychom měli pacienty s mutací BRAF V600 adjuvantně léčit přednostně kombinací inhibitoru BRAF a inhibitoru MEK, anebo imunoterapií monoklonální protilátkou anti‑PD‑1. Oba tyto odlišné terapeutické přístupy vykazují podobnou účinnost na poli pětiletého benefitu v přežívání bez návratu choroby (RFS) a přežívání bez vzdálené rekurence (DMFS). Hlavním rozdílem je však odlišné spektrum nežádoucích účinků terapie, kdy v případě imunoterapie mluvíme především o imunitně podmíněných nežádoucích účincích léčby s potenciálem výskytu závažných až život ohrožujících komplikací anebo trvalých následků. Pravdou je, že se závažné nežádoucí účinky vyskytují spíše vzácně a v případě potenciálně život ohrožujících komplikací se již bavíme o raritním výskytu. U cca 20 procent pacientů (tedy jednoho z pěti léčených) však dochází ke vzniku trvalého následku, ve většině případů se jedná o rozvoj imunitně podmíněné tyreoiditidy, která vede k trvalé hypotyreóze s nutností substituce levothyroxinu. Na druhé straně v případě kombinace inhibitorů BRAF a MEK se bavíme zejména o vyšším výskytu akutní toxicity (pyrexie, zimnice, třesavky, bolesti kloubů a svalů, zažívací obtíže, slabost a malátnost), objevující se zejména během prvních tří až šesti měsíců léčby, která u některých pacientů vede k předčasnému ukončení terapie. Dalším rozdílem je možnost následné terapie v případě selhání léčby v adjuvantním režimu. U pacientů s mutací BRAF V600 ve většině případů volíme tzv. vice versa přístup, tedy pokud byl pacient léčen adjuvantně kombinací inhibitoru BRAF a inhibitoru MEK, při relapsu onemocnění podáme do první linii léčby metastatického melanomu imunoterapii anti‑PD‑1 +/‑ anti‑CTLA‑4 (tedy pembrolizumab nebo nivolumab +/‑ ipilimumab), naopak v případě selhání imunoterapie v adjuvanci zvolíme do následné terapie kombinaci inhibitoru BRAF a inhibitoru MEK.
Pokud je sentinelová uzlina negativní, pacienta pouze sledujeme, při pozitivním výsledku naopak můžeme indikovat adjuvantní imunoterapii monoklonální protilátkou anti‑PD‑1 (pembrolizumab/nivolumab) nezávisle na statusu mutace BRAF V600, anebo adjuvantní cílenou léčbu kombinací inhibitoru BRAF a inhibitoru MEK (dabrafenib a trametinib) v případě přítomnosti mutace BRAF V600. Adjuvantní terapií podávanou po dobu jednoho kalendářního roku by měli být zajištěni všichni pacienti, kteří mají maligní melanom s vysokým rizikem rekurence onemocnění. Konkrétně se jedná o pacienty ve stadiu III (IIIA pouze za přítomnosti mikrometastázy v sentinelové uzlině o velikosti > 1,0 mm, IIIB, IIIC nebo IIID) dle 8. edice klasifikace AJCC melanomu, případně pacienti ve stadiu IV (po kompletním odstranění vzdálených metastáz), kterým léčbu nabízíme z důvodu snížené pravděpodobnosti pěti‑ a desetiletého přežití v asociaci s melanomem. Adjuvantní terapie však nemusí být zahájena u každého pacienta, který splňuje parametry vysoce rizikového melanomu. Při úvaze o zahájení adjuvance musíme brát v potaz jednak věk pacienta, jeho ECOG PS, komorbidity, compliance a v neposlední řadě zájem pacienta o adjuvantní léčbu jako takovou. Vždy bychom měli u každého pacienta pečlivě zvážit všechny potenciální přínosy léčby (RFS, DMFS) dle individuálního stadia onemocnění pacienta a možnosti komplikací v asociaci s terapií (imunitně podmíněné nežádoucí účinky léčby u imunoterapie, vyšší míra akutní toxicity u cílené terapie). Pacienti ve stadiu IIIA s velikostí mikrometastázy v sentinelové uzlině < 1,0 mm mohou dle úhradové vyhlášky být adjuvantně léčeni imunoterapií nebo cílenou terapií, avšak tito pacienti nebyli zařazeni do žádné z registračních studií pro adjuvantní terapii, vzhledem k jejich lepší prognóze a nižšímu riziku rekurence choroby. Z těchto důvodů není přítomno jasné doporučení pro zahájení adjuvantní terapie u těchto pacientů (riziko z adjuvantní terapie v těchto případech může převyšovat potenciální benefit z dané léčby). Do indikace adjuvantní terapie se v brzké době budou zahrnovat i pacienti ve stadiu IIB (pT3b, pT4a) a IIC (pT4b), tedy pacienti s vysoce rizikovým lokálně pokročilým melanomem, avšak s negativním výsledkem biopsie sentinelové lymfatické uzliny, u kterých bude nově možné nasadit pembrolizumab v adjuvantním režimu. Doposud neexistuje žádné jednoznačné doporučení, zda bychom měli pacienty s mutací BRAF V600 adjuvantně léčit přednostně kombinací inhibitoru BRAF a inhibitoru MEK, anebo imunoterapií monoklonální protilátkou anti‑PD‑1. Oba tyto odlišné terapeutické přístupy vykazují podobnou účinnost na poli pětiletého benefitu v přežívání bez návratu choroby (RFS) a přežívání bez vzdálené rekurence (DMFS). Hlavním rozdílem je však odlišné spektrum nežádoucích účinků terapie, kdy v případě imunoterapie mluvíme především o imunitně podmíněných nežádoucích účincích léčby s potenciálem výskytu závažných až život ohrožujících komplikací anebo trvalých následků. Pravdou je, že se závažné nežádoucí účinky vyskytují spíše vzácně a v případě potenciálně život ohrožujících komplikací se již bavíme o raritním výskytu. U cca 20 procent pacientů (tedy jednoho z pěti léčených) však dochází ke vzniku trvalého následku, ve většině případů se jedná o rozvoj imunitně podmíněné tyreoiditidy, která vede k trvalé hypotyreóze s nutností substituce levothyroxinu. Na druhé straně v případě kombinace inhibitorů BRAF a MEK se bavíme zejména o vyšším výskytu akutní toxicity (pyrexie, zimnice, třesavky, bolesti kloubů a svalů, zažívací obtíže, slabost a malátnost), objevující se zejména během prvních tří až šesti měsíců léčby, která u některých pacientů vede k předčasnému ukončení terapie. Dalším rozdílem je možnost následné terapie v případě selhání léčby v adjuvantním režimu. U pacientů s mutací BRAF V600 ve většině případů volíme tzv. vice versa přístup, tedy pokud byl pacient léčen adjuvantně kombinací inhibitoru BRAF a inhibitoru MEK, při relapsu onemocnění podáme do první linii léčby metastatického melanomu imunoterapii anti‑PD‑1 +/‑ anti‑CTLA‑4 (tedy pembrolizumab nebo nivolumab +/‑ ipilimumab), naopak v případě selhání imunoterapie v adjuvanci zvolíme do následné terapie kombinaci inhibitoru BRAF a inhibitoru MEK.
Follow‑up pacientů s melanomem
Dispenzarizace pacientů s maligním melanomem je stejně důležitá jako správný a rychlý management primárního tumoru. Tento proces má dva hlavní úkoly. Na jedné straně časný záchyt rekurence původního melanomu a na straně druhé časný záchyt potenciálního duplicitního melanomu. Většina rekurencí maligního melanomu se přitom odehrává během prvních tří až pěti let od excize primárního melanomu. Jedná se tedy o období s vyšším rizikem záchytu rekurence choroby. Doporučení pro onkologický staging by mělo být na základě těchto skutečností řízeno především rizikovostí jednotlivých stadií onemocnění a závislostí na časovém odstupu od excize primárního tumoru. Riziko vzniku duplicitního melanomu je u pacientů s pozitivní osobní anamnézou melanomu celoživotní a pohybuje se v rozmezí čtyř až deseti procent v závislosti na přítomnosti dalších rizikových faktorů. Musíme si rovněž uvědomit, že až 25 procent ze všech duplicitních melanomů bývá zachyceno po více než pěti letech od excize primárního tumoru. Dispenzarizace pacientů s melanomem v ambulanci dermatovenerologa by proto měla být celoživotní.
Dispenzarizace pacientů s potvrzenou diagnózou maligního melanomu představuje pro dermatologická oddělení a kliniky velkou kapacitní zátěž. Incidence melanomu v roce 2020 v České republice dosahovala přes 3 000 nových případů tohoto onemocnění. Prevalence žijících pacientů s melanomem v České republice v roce 2020 je přibližně 40 000 a je předpoklad, že tyto hodnoty se budou i nadále zvyšovat a pacientů s nutností dispenzarizace bude stále přibývat.
Shrnutí: od dermatoskopu po onkologické centrum
Dermatoskopické vyšetření je indikováno u každého pacienta s podezřelou pigmentovou lézí. Chirurgická excize by měla být provedena či indikována dermatologem, histologické vyšetření každého excidovaného projevu by mělo proběhnout bez prodlení a každý pacient by měl být sledován konkrétním dermatologem s možností návaznosti na komplexní onkologické centrum. Dispenzarizace pacientů s melanomem v ambulanci dermatovenerologa by měla být celoživotní.