Flash radioterapie
Léčba ionizujícím zářením – radioterapie – je od počátku využití v humánní medicíně cca v polovině 20. století provázena problematikou malé terapeutické šíře, resp. závažných nežádoucích účinků, které vycházejí z ozáření a následného úbytku buněk v nenádorových tkáních v cílovém objemu i mimo něj.
Od nástupu radioterapie se uplatňuje několik způsobů, jak nežádoucím účinkům předejít. Frakcionací lze dosáhnout jiné kinetiky biologické odpovědi, resp. úbytku buněk v nádorových a nenádorových tkáních, maximální konformitou (dodáním dávek právě a jen do určeného cílového objemu) lze snižovat dávky mimo cílový objem. Tyto dva principy se simultánně využívají ve standardní radioterapii a v jejich mezích jsou vyvinuta standardní léčebná schémata. Principy nejsou vzájemně nezávislé a s rostoucí konformitou lze měnit frakcionaci. V posledním desetiletí vývoj technologií v radioterapii umožnil výzkum, preklinické a v minimální míře klinické využití dalšího efektu, který umožňuje dosáhnout kvantitativně jiné odpovědi v nádorové a nenádorové tkáni. Již v roce 1966 popsali Hornsey a Alper vliv dávkového příkonu (rychlosti dodání dávek do cílového objemu) na biologickou odpověď tkání. V roce 2014 popsali Fauvadon et al. protektivní vliv vysokého dávkového příkonu (nad 40 Gy/s) na nenádorové tkáně a uplatnili termín „flash‑efekt“. (Pro vysoký dávkový příkon se dále užívá termín „UHDR“ – ultra high dose rate.) Ve fundamentální práci Fauvadon popsal vliv UHDR na vznik plicní fibrózy u myší. Při dávkovém příkonu nad 40 Gy/s se na rozdíl od konvenčního příkonu (< 0,03 Gy/s) nespouští TGFb dependentní fibrogenní mechanismus a radiací indukovaná apoptóza hladkosvalových buněk. Kinetika úbytku nádorových buněk zůstává stejná. Flash‑efekt se v posledních pěti letech stal další intenzivně zkoumanou cestou ke zvýšení terapeutické šíře radioterapie, pro metodu „flash‑radioterapie“. Flash‑efekt může budit dojem poměrně snadného řešení, nicméně jeho cesta do standardní terapie bude zřejmě ještě dlouhá, a to z mnoha příčin:
- Fyzikálně‑chemický a biologický mechanismus flash‑efektu není objasněn i přes několik pravděpodobných hypotéz.
- Příprava záření s UHDR je obtížná a bude vyžadovat speciální techniku více nebo méně rozdílnou od techniky nyní využívané pro radioterapii konvenčním dávkovým příkonem.
- Využití flash‑efektu bude vyžadovat specifické plánovací systémy a specifické algoritmy výpočtu rozložení dávek.
- Záření s UHDR vyžaduje specifickou dozimetrii.
- Řada experimentů in vitro dostatečně prokázala zákonitosti flash‑efektu. Nyní probíhá řada experimentů na zvířecích modelech. V humánní medicíně ale zatím proběhla jedna klinická studie paliativního ozáření u deseti nemocných.
- Nejsou vyvinuta frakcionační schémata pro radioterapii využívající flash‑efekt.
Některé z těchto aspektů vyžadují bližší komentář.
Mechanismus flash‑efektu
Přesný mechanismus flash‑efektu není objasněn. Potenciálních mechanismů je více. Výzkumné práce a experimenty zatím vycházejí ze dvou základních hypotéz, ale hypotetických mechanismů je více. První z nich, hypotéza kyslíkové deplece, vychází z pozorování, že flash‑efekt není patrný na buněčných kulturách za atmosférické koncentrace kyslíku – 20 procent, je ale patrný za fyziologické („tkáňové“) koncentrace tři až sedm procent. Poškození DNA vlivem formace volných radikálů (nepřímé poškození) je potencováno za přítomnosti volného molekulárního kyslíku vznikem peroxidových radikálů, což je základem „oxygen enhancement ratio“. Při UHDR vzniká v nenádorové tkáni hypoxie, která není dostatečně (rychle) kompenzována a buňky se stávají přechodně radiorezistentními. Za normálního dávkového příkonu je oxygenace vlivem prokrvení dostatečná a flash‑efekt nenastává. V heterogenní nádorové populaci je kyslíková deplece méně patrná a nesouvisí s radiorezistencí. V rámci teorií zahrnujících kyslíkové efekty se na flash‑efektu podílejí i další kyslíkové produkty – „ROS“ (reactive oxygen species), jejichž dynamika je při vysokém dávkovém příkonu také rozdílná mezi nádorem a nenádorovou tkání. Podíl ROS také podporuje absence flash‑efektu za přítomnosti ROS trapperů, amofostinu nebo N‑acetylcysteinu.
Druhá základní teorie objasňující mechanismus flash‑efektu, teorie imunitní a zánětlivé odpovědi, vychází z četných pozorování rozdílných účinků při UHDR oproti konvenčnímu dávkovému příkonu: Koncentrace TGFb jsou při UHDR nižší (narůstají cca 1,8× vs. 6,5×), což podporuje menší zánětlivou odpověď. Suprese imunitního systému vlivem TGF‑b je nižší. Cirkulující imunokompetentní buňky jsou vystaveny kratší expozici záření. V nádorovém mikroprostředí je vyšší nárůst infiltrace T lymfocyty. Tyto a řada dalších jevů v imunitním systému přispívají k objasnění flash‑efektu mimo základní fyzikálně‑chemické mechanismy. Další podklady pro objasnění flash‑efektu, jako je vliv na kmenové nádorové buňky, na nádorové mikrovaskulární prostředí, na cirkulující imunokompetentní buňky a další, jsou nad rámec tohoto sdělení.
Příprava záření UHDR, zdroje záření
Aplikace záření UHDR představuje zásadní technický problém, a to v aspektu typu záření, energie záření, zdroje o dostatečném výkonu a modifikace geometrie svazku. V preklinických experimentech bylo využito elektronové, fotonové i protonové záření. Výhody a nevýhody jednotlivých zdrojů jsou shrnuty v tabulce.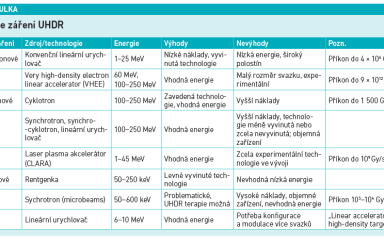
Technologie jsou velmi složité a je obtížné stručně sumarizovat, co přinášejí jednotlivé zdroje záření pro flash‑radioterapii, lze podat jen orientační přehled:
Iniciální pokusy, na jejichž základě byl popsán flash‑efekt, využily elektronové záření. Zdroji záření jsou lineární urychlovače poskytující záření o energii 5–5,6 MeV při dávkovém příkonu 0,1–1 000 Gy/s („Oriatron“, „Kinetron“). Tyto energie jsou vhodné pro pokusy na malých zvířatech. Pro humánní medicínu je třeba vyšší energie s větší hloubkou absorpce pod povrchem živé tkáně. Experimentální lineární urychlovač NLCTA (Next Linear Collider Test Accelerator – Stanford Linear Accelerator Center) poskytuje elektronové záření o energii 60 MeV a dávkovém příkonu řádově až 1012 Gy/s – VHEE (very high energy electrons), přístroj pro klinické využití ale zatím nebyl zkonstruován.
Jako zdroj elektronového záření o vysokém dávkovém příkonu lze využít i modifikované standardní klinické lineární urychlovače. Varian 2100 IX Linac byl modifikován pro studie in vivo s energií 20 MeV a dávkovým příkonem 37 Gy/s, podobně urychlovač Mobetron může po modifikaci poskytovat záření o energii 9 MeV a příkonu 800 Gy/s.
Fotonové (elektromagnetické) záření má řadu nevýhod. V experimentech na zvířatech byly vyvinuty technologie záření o vysokém dávkovém příkonu z rentgenového zdroje, lineárního urychlovače anebo synchrotronu (synchrotron microbeams). Energie je nízká, řádově do stovek keV, zato u synchrotronu dosahuje dávkový příkon až řádově tisíce Gy/s. Energii 10 MeV při příkonu v desítkách Gy/s (nad 40 Gy/s) poskytuje lineární urychlovač (ARIEL e‑linac). Postup fotonového záření s flash‑efektem do klinického použití je problematický, protože přirozeně nelze využívat větší počet svazků s modulovanou intenzitou.
Protonové záření má ideální předpoklady pro využití flash‑efektu. Dávky jsou deponovány v hloubce tkáně dané pozicí Braggova peaku a dávky lze aplikovat v ideálním případě jedním svazkem záření. Zdroje protonového záření poskytují dávkové příkony až do 1 500 Gy/s. Cyklotron C230 (IBA), který je instalován v mnoha zařízeních poskytujících protonovou radioterapii, byl již modifikován pro vysoké dávkové příkony polem o průměru 12 mm. Podobné možnosti má cyklotron ProBeam (Varian). Další úpravy umožní deponovat vysoký dávkový příkon v rozměrnějších objemech. Úpravy synchrotronu jsou technicky náročnější a vyžadují větší investice. I synchrotron ale je schopen poskytovat vysoké dávkové příkony, zatím byl upraven synchrotron ProBeatV (Hitachi). Potenciálně lze využít jako zdroje protonového záření i synchro‑cyklotron nebo lineární urychlovač, pokusy jsou zatím v iniciálním stadiu. Ve stadiu vývoje jsou i systémy přípravy protonového záření vysokovýkonným laserem – „compact laser plasma accelerator system“ (CLARA, poskytuje příkony až 109 Gy/s. Flash‑efekt může být jediným využitím této technologie, zatím stále ve stadiu technického vývoje. Pro UHDR aplikace využívající flash‑efekt lze využít oba systémy aplikace protonového záření – „scattering“ i „scanning“. Druhým lze dosahovat vyšší konformity. Četné studie prokázaly, že flash‑efekt lze při aplikaci formou scannování dosáhnout.
Při srovnání jednotlivých zdrojů záření má ke klinickému využití nejblíže protonové záření. Preklinické experimenty sice proběhly nejvíce s využitím elektronových zdrojů, nicméně v geometrických podmínkách humánní medicíny má protonové záření jednoznačné výhody. Navíc zdroje záření vyžadují nejméně náročné úpravy.
Preklinické experimenty
Od fundamentální práce Fauvadona et al. (která podle některých autorů datuje počátek historie flash‑radioterapie) uplynulo již téměř deset let a po roce 2019 již vycházejí řádově desítky publikací popisujících různé aspekty technologie, včetně in vivo experimentů. Jejich výstupy lze stručně shrnout. V období posledních deseti let byla na zvířecích modelech, převážně na myších, ev. prasatech, ověřena redukce účinků záření v nenádorových tkáních. Přehled experimentů by byl příliš obsáhlý, nicméně lze jmenovat významné výstupy:
- TGFb kaskáda plicní fibrózy se při flash‑efektu u myší nespouští.
- V kognitivních testech u myší jsou zachovány paměťové funkce po ozáření celého krania do 10 Gy. Po dávkách do 30 Gy je vlivem flash‑efektu postižení signifikantně nižší. Při dávkách do 25 Gy je v neurokraniu zachována mikrovaskulární integrita. Zároveň experimenty prokazují, že při dávkovém příkonu pod 41 Gy/s se flash‑efektu nedosahuje.
- Při ozařování kůže u prasat a myší je vlivem flash‑efektu a dávkách 30–40 Gy výrazně nižší kožní toxicita a nespouštějí se TGFb dependentní mechanismy. Pokusy s ozařováním kůže u myší také prokazují možnosti protonového ozařování metodou skenování s příkonem do 115 Gy/s.
- Důležitá oblast pokusů, ozařování břišní dutiny, převážně u myší, prokazuje při dávkách do 8 Gy významně menší poškození břišních orgánů a současně menší frekvence a stupeň lymfopenií. Zároveň tyto experimenty stanovují mírně vyšší hranici dosažení flash‑efektu, nad 100 Gy/s. Minimální dávkový příkon je další proměnná, která v závislosti na cílové tkáni určuje možnosti využít flash‑efektu.
- Významná oblast experimentů využívá embrya zebřiček – dánia pruhovaného (Danio rerio, zebrafish). Tento model se ukazuje jako vhodný pro výzkum flash‑efektu. Vlivem flash‑efektu se po dávkách do 26 Gy redukují různé formy poškození embryí. Zároveň tato oblast pokusů prokazuje koncentraci kyslíku jako významnou proměnnou pro dosažení flash‑efektu, experimenty podporují teorii kyslíkové deplece.
Většina preklinických experimentů využívá jednu dávku záření a nepřispívá k výzkumu účinků frakcionace.
Další oblast preklinických experimentů zkoumá přímý vliv záření o vysokém dávkovém příkonu na samotné experimentální nádory in vivo. Opět s významným podílem experimentů na myších je opakovaně prokázán ekvipotentní účinek v experimentálních nádorech při vysokém i konvenčním dávkovém příkonu. Zároveň se prokazuje stejný biologický dávkový ekvivalent a pro protonové vs. fotonové záření lze přijmout koeficient dávkového ekvivalentu 1,1 i při vysokém dávkovém příkonu.
Zajímavou poloexperimentální oblast představuje i využití flash‑radioterapie ve veterinární medicíně u probandů přicházejících mimo experimentální soubory („z terénu“). Zde byla úspěšně využita elektronová flash‑radioterapie v léčbě nádorů ORL oblasti.
Klinické studie
Ke klinickému využití ve standardní terapii flash‑efektu je zřejmě ještě dlouhá cesta. Přesto první nemocný již byl léčen a výsledky byly publikovány v roce 2019. Nemocný s refrakterní formou T‑kutánního lymfomu byl léčen jednorázovou dávkou 15 Gy na kožní tumor při max. rozměru ozařovaného objemu 3,5 cm v 90 ms. Flash‑efektu bylo dosaženo, při ústupu tumoru byla evidentní minimální kožní toxicita v přilehlém okolí.
V roce 2022 byla publikována první klinická studie „FAST‑01“ u nemocných se symptomatickými kostními metastázami na končetinách různého primárního původu. Dávka 8 GyE v jedné frakci byla aplikována protonovým zářením při dávkovém příkonu 60 Gy/s, metodou pencil beam scanningu.
Flash‑radioterapie byla aplikována u deseti nemocných a 12 cílových objemů (metastáz). U 8/12 objemů byl dosažen ústup bolestí, u 6/12 objemů kompletní. Nežádoucí účinky byly minimální.
Další klinické studie jsou iniciovány na dalších pracovištích, kupř. Univerzitní centrum Lausanne (CHUV) zahájilo studii léčby kožních nádorů elektronovou flash‑radioterapií.
Závěry
Flash‑efekt byl popsán před mnoha lety. Postupný vývoj zdrojů záření a techniky aplikace dávek umožnil v novém tisíciletí reálnou flash‑radioterapii. Přesná patofyziologie flash‑efektu sice není objasněna, přesto preklinické experimenty dávají přesvědčivé nálezy o jeho využitelnosti a o množství proměnných, na nichž závisí. Zároveň se daří připravit technologii aplikace dávek vysokým dávkovým příkonem – UHDR. Parametry dávkového rozložení, způsob aplikace a nejmenší náročnost na vývoj a úpravu zdrojů záření podporuje protonové záření. Do využití flash‑radioterapie ve standardní radioterapii zbývá ještě řešení mnoha otázek z oblasti biologie, kupř. vývoj frakcionačních schémat, stanovení dávkových limitů v rizikových orgánech, ale také z oblasti fyziky radioterapie – simulační studie, vývoj plánovacích systémů a v rozsáhlé oblasti dozimetrie UHDR.
Iniciální využití flash‑radioterapie ve veterinární a humánní medicíně již bylo referováno. V následujících letech se flash‑radioterapie zřejmě bude dále rozvíjet. A přinese žádaný efekt – dosažení větší terapeutické šíře při aplikaci ionizujícího záření.
Literatura u autora