Terapie CAR T – léčba budoucnosti již dnes?
Jedním z úkolů Asociace inovativního farmaceutického průmyslu (AIFP) je šířit informace o nových možnostech léčby. Jedním z praktických vyústění této snahy je i projekt Terapie budoucnosti. Ten si klade za cíl představovat nastupující terapeutické principy, které se v nadcházejících letech stanou běžně dostupnou realitou. Součástí projektu byl seminář pro odbornou veřejnost, zaměřený na potenciál léčby CAR‑T, tedy postupu založeného na genetické úpravě vlastních pacientových lymfocytů. Tato akce proběhla na konci září pod záštitou České lékařské společnosti Jana Evangelisty Purkyně.
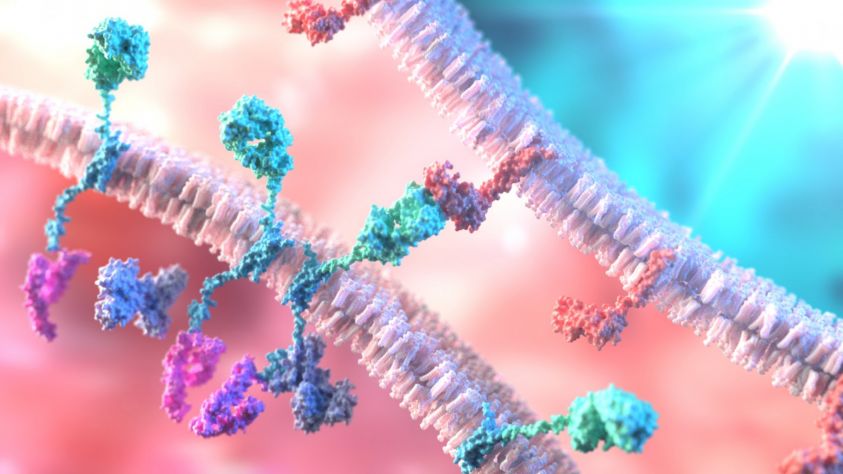
Jako CAR‑T se označuje inovativní směr léčby, kdy je do pacientových vlastních T lymfocytů metodami genetického inženýrství vpraven chimérický antigenní receptor. Takto modifikovaný T lymfocyt je schopen vyhledat a eliminovat cílovou buňku s daným povrchovým antigenem a zároveň aktivovat i ostatní složky imunitního systému. Uvedený koncept je v současné době již realitou a je používán v klinické praxi, a to i v České republice.
Na semináři takový postup do obecnějšího rámce zařadil prof. MUDr. Jiří Mayer, CSc., předseda České hematologické společnosti ČLS JEP. V úvodu svého sdělení zdůraznil, že právě hematologie otevřela nové směry a obzory nejen pro onkologii, ale i pro celou medicínu. Výzkum v hematoonkologii ukázal cestu k poznání některých genetických abnormalit v buňkách, což následně vedlo ke kauzální léčbě a k navržení konkrétních léků právě díky známé molekulární patogenezi.
Současná věda aktuálně přichází s nových konceptem „genové terapie“, což je revoluční přístup, kdy se pracuje s geneticky modifikovanými autologními buňkami samotného pacienta. Podstatná je podle prof. Mayera připravenost systému tyto inovace absorbovat. V této souvislosti pochválil VZP za vstřícný a flexibilní přístup při individuálním schvalování léčby konkrétních pacientů. V současné době se jedná řádově o desítky nemocných. „Není to zázračná živá voda, ale jedná se o naprosto jasný průkazný směr, kterým by se moderní medicína mohla ubírat, i když metoda samozřejmě nemá 100% účinnost,“ zdůraznil prof. Mayer. Nadějí do budoucna je také příslib, že se situace při použití metody buněčné terapie zlepší po legislativní stránce. Současná nově schválená legislativa totiž dává mnohem větší váhu názoru odborných společností, kde se předpokládá, že odborná veřejnost bude hrát důležitější roli v posuzování nových léčiv. Očekává se také menší administrativní zátěž při schvalování jednotlivých pacientů indikovaných k léčbě.
Na toto sdělení navázal MUDr. Aleš Kmínek, MBA, člen výboru České společnosti pro farmakoekonomiku a hodnocení zdravotnických technologií. „V současné době čelíme situaci, kdy se mění paradigma farmakoterapie v celých oblastech medicíny. Nastupující technologie jsou natolik nové, že přinášejí zásadně odlišný náhled na léčbu, a je tedy potřeba mnohdy zcela změnit zavedené klinické uvažování. Zároveň přinášejí mnohé etické nejasnosti. Dále mohou znamenat i problémy ekonomické, protože tyto nové terapie nejsou levné.“
Poté se MUDr. Kmínek již blíže zaměřil na terapeutické využití CAR‑T. Tato metoda patří mezi imunoterapeutické léčebné postupy, a řadí se tak vedle dalších, již zavedených terapeutických modalit, ať už jde o léčbu chirurgickou, radioterapii, chemoterapii, nebo tzv. cílenou léčbu. MUDr. Kmínek se blíže zastavil u principu této léčby. CAR‑T (Chimeric Antigen Receptor T Cells) je založena na tvorbě receptoru, který je navržen tak, aby rozpoznal specifický protein na povrchu nádorové buňky. Pojem „chimeric“ znamená, že takto vytvořený receptor kombinuje dvě funkce: nejen navázat se na specifický protein, ale také současně aktivovat T buňku, na které je umístěn. Lymfocyt je tak schopen nalézt nádorovou buňku, ale zároveň dostává informaci, aby nádorovou buňku dokázal zničit. Geny pro CAR jsou vloženy do T buňky pomocí virového vektoru.
To vše klade zvláštní nároky na proces přípravy a vlastní aplikaci CAR‑T buněk. „Rozdíl mezi klasickou léčbou a CAR‑T buněčnou terapií spočívá v tom, že u klasické léčby jde o lineární proces, který je pro všechny pacienty víceméně stejný. Začíná nalezením vhodné látky, její produkcí, dodáním do výdejního místa a podáním pacientovi. Naopak u CAR‑T buněčné terapie se jedná o zcela jiný model, kdy je proces léčby zcela personalizovaný, jsou použity přímo pacientovy buňky, které jsou upraveny, namnoženy a znovu vpraveny do těla.
Indikace pro CAR‑T jsou schváleny pro ČR i pro ostatní evropské země v následujících diagnózách:
- U dospělých pacientů s relabujícím nebo refrakterním difuzním velkobuněčným B lymfomem (DLBCL) po dvou či více liniích systémové léčby.
- U dospělých pacientů s relabujícím nebo refrakterním primárním mediastinálním velkobuněčným B lymfomem (PMBCL) po dvou či více liniích systémové léčby.
- U dětí a mladých dospělých pacientů do 25 let s akutní lymfoblastickou leukémií (ALL), která je refrakterní, v relapsu po transplantaci nebo ve druhém nebo pozdějším relapsu.
Tato léčebná modalita má některá významná specifika. „CAR‑T buněčná terapie je schopna navodit kompletní odpověď na léčbu i u některých pacientů s refrakterními nebo opakovaně relabujícími malignitami. Unikátní také je, že jde o jednorázovou aplikaci,“ zdůraznil MUDr. Kmínek.
Vzhledem k tomu že terapie CAR‑T je velmi náročná na organizaci, na personální vybavení i na specifické znalosti a dovednosti, je možné ji podávat pouze ve specializovaných centrech. Ta musejí být schopna zajistit odběr T lymfocytů, jejich odeslání k výrobě přípravku, jeho podání a také rozpoznání, monitorování a zvládání případných nežádoucích účinků léčby. Specifické nežádoucí účinky terapie CAR‑T nelze pominout a patří mezi ně především:
- Cytokine release syndrom (CRS): jedná se o potenciálně život ohrožující zánětlivou odpověď vyvolanou uvolněním prozánětlivých cytokinů. Jeho tíže a frekvence koreluje s antigen‑dependentní aktivací T buněk. Může nastat do 24 hodin po infuzi buněk CAR‑T nebo i později. Projevuje se horečkou, tachykardií, progredující hypotenzí, hypoxií s orgánovým selháním.
- Immune effector cell‑associated neurotoxicity syndrome (ICANS): do této kategorie náleží spektrum neurologických příznaků jako bolest hlavy, tremor, poruchy řeči, delirium, zmatenost apod.
„Specifické nežádoucí účinky terapie CAR‑T nelze podceňovat a je potřeba, aby příslušné pracoviště bylo odpovídajícím způsobem vybaveno jak personálně, tak i přístrojově,“ připomněl MUDr. Kmínek. „Je důležité o těchto nežádoucích účincích mluvit. Nemůžeme budit dojem, že se jedná o nějakou zázračnou léčbu.“
Typická cesta pacienta, který se postupně dostává až k terapii CAR‑T, zahrnuje tyto kroky:
- diagnózu hematologické malignity
- „konvenční“ léčbu pacienta podle protokolu, která musí terapii CAR‑T předcházet
- relapsy onemocnění
- indikaci k CAR‑T
- odběr krve a izolace T lymfocytů
- někdy nutnou překlenovací („bridging“) chemoterapií
- genetickou úpravou lymfocytů na CAR‑T
- podání CAR‑T
- sledování a léčbou nežádoucích účinků
V současné době jsou v ČR dostupné přípravky CAR‑T v indikacích, které odpovídají jejich SPC na základě společných stanovisek mezi VZP a ČLS JEP, podle § 16 zákona č. 48/1997 Sb.
MUDr. Kmínek se také zmínil i o ekonomických aspektech této terapie. Připomněl řadu studií, které zkoumaly nákladovou efektivitu podání léčby CAR‑T (Furzer et al. 2020, Lin et al. 2019, Roth et al. 2018, Sarkar et al. 2019, Walton et al. 2019, Whitington et al. 2018). Z těchto studií vyplývá, že v kontextu různých zdravotních systémů je terapie CAR‑T hodnocena vesměs jako nákladově efektivní nebo na hranici nákladové efektivity. „To znamená, že pozitivní efekt, který terapie CAR‑T pacientovi přináší, nestojí více než jiná léčba hrazená v jiných oblastech zdravotního systému nebo v jiných diagnózách,“ uvedl MUDr. Kmínek. Terapie CAR‑T je podle něj vhodná pro uplatnění nových inovativních modelů tvorby cen a úhrad. Velkou roli v tomto směru hraje EFPIA (Evropská federace asociací farmaceutického průmyslu), která zastřešuje inovativní farmaceutické firmy na národních úrovních. EFPIA navrhla určité možnosti, jakým způsobem se s ekonomickou náročností nových léčiv vyrovnat pomocí inovativních modelů cen a úhrad, tj. jak tuto terapii zaplatit. Uvažuje se o pěti konkrétních modelech (kombinovaná léčba, léčba jedním přípravkem pro různé indikace, platba založená na výsledcích, platba rozložená v čase a předplatné). Nové cenové modely nejsou izolované. Používají se jako stavební kameny pro vytváření smluv mezi plátci a společností dodávající léky.
Ekonomika bude hrát důležitou roli v argumentech jak pro zastánce, tak i pro odpůrce této léčby. Vyvstávají především otázky, zda se dá vysoká cena CAR‑T ospravedlnit a zda vůbec v rozpočtu systému zdravotního pojištění jsou příslušné finanční prostředky. Studie nákladové efektivity říkají, že ano.
MUDr. Kmínek také nastínil, jaká je blízká budoucnost terapie CAR‑T. Její indikace by se mohla rozšířit například na mnohočetný myelom, v přípravách jsou další léčiva v oblasti hematologických nádorů. Studuje se její vliv na solidní nádory, hovoří se o alogenní CAR‑T buněčné terapii, která by nevyužívala vlastní buňky pacienta, ale buňky potenciálního dárce buněk. Kromě T lymfocytů se uvažuje o terapii CAR‑T založené na NK buňkách.
Praktické zkušenosti s terapií CAR‑T na semináři popsal MUDr. František Folber, Ph.D., z Interní hematologické a onkologické kliniky LF MU a FN Brno. Připomněl, že první generace lymfocytů CAR‑T vznikla již v 90. letech minulého století, kdy byla modifikována pouze extracelulární část receptoru CAR‑T, který váže antigen. Přestože docházelo k vazbě, tyto buňky nebyly dostatečně aktivovány. Tento limit pak překonala druhá generace lymfocytů CAR‑T, které kromě extracelulární části měly modifikovanou i intracelulární část.
MUDr. Folber také popsal, jak v praxi probíhá proces přípravy léčebného prostředku a jeho aplikace. Nejprve dojde k odběru suspenze mononukleárních buněk pacienta do vaku, následuje manipulace v čistých prostorách, uložení vaku do chladicího nebo mrazicího boxu v ochranném obalu. Následně je box zaslán výrobci. Po uplynutí konkrétní doby výrobce připraví léčivý přípravek a vrací jej zpět na pracoviště při teplotě min. −150 stupňů Celsia pro jeho uskladnění. Po krátké době je zmražený vak přesunut na oddělení přímo k lůžku pacienta, rozmražen a pacientovi podán během krátké 10- až 15minutové infuze. Doba od odběru mononukleárních buněk pacienta k podání hotového přípravku pacientovi se v praxi pohybuje mezi třemi a pěti týdny. Celý proces od počátku diagnózy přes výběr vhodného pacienta k léčbě a schválení léčby zdravotní pojišťovnou až po důkladnou přípravu pacienta k odběru je však mnohem delší.
Co se týká výběru pacienta k léčbě pomocí terapie CAR‑T, jedná se o velmi náročný proces, který vyžaduje zkušenosti s léčbou. Tyto zkušenosti česká pracoviště postupně získávají, a to i ve spolupráci se zahraničními centry. Vhodný pacient pro terapii CAR‑T je tedy takový, který kromě toho, že splní oficiální indikační kritéria, je schopen léčbu podstoupit, je schopen se dočkat výroby a podání „svého přípravku“. Pacient by měl být schopen zvládnout bezprostřední nežádoucí účinky léčby, které při léčbě nastávají. Ty jsou poměrně časté, ale dobře zvladatelné.
V současné době jsou v České republice k dispozici tři komerční přípravky spadající do kategorie CAR‑T:
- Tisagenlekleucel (Kymriah)
- Indikace: DLBCL ve 3. a další linii u dospělých, B‑ALL ve 2./3. a další linii u dětí a dospělých do 25 let.
- Axikabtagen ciloleucel (Yescarta)
- Indikace: DLBCL ve 3. a další linii u dospělých, PMBCL ve 3. a další linii u dospělých.
- Brexukabtagen autoleucel (Tecartus)
- Indikace: MCL ve 3. a další linii u dospělých.
Všechny tři dostupné přípravky jsou lymfocyty CAR‑T 2. generace, vážou se na anti‑CD19, vzájemně se ovšem liší kostimulační doménou a v některých aspektech jsou rozdílné svou technikou výroby.
Účinnost uvedených přípravků není vzájemně srovnatelná z důvodu, že se při léčbě nejedná o stejné pacienty, stejné populace ani o stejné diagnózy a přímé head‑to‑head studie neproběhly.
V České republice je v současné době pro léčbu CAR‑T certifikováno pět center (FN Plzeň, FN Hradec Králové, FN Praha‑Motol, ÚHKT/VFN Praha, FN Brno). Od počátku používání terapie CAR‑T v r. 2019 bylo v České republice léčeno celkem 67 pacientů (stav k září 2021). Pro zvýšení kapacity a také z důvodu příchodu nových přípravků jsou v procesu certifikace pracoviště FN Ostrava a FN Olomouc.
Co se týká blízké budoucnosti terapie CAR‑T, je plánován vstup na trh nového přípravku idekabtagen vikleucel (Abecma) a dále je očekáváno zařazení přípravku lisokabtagen maraleucel (Breyanzi).
V současnosti tedy terapie CAR‑T přináší reálnou šanci na dlouhodobou léčebnou odpověď u pacientů s relaps/refrakterními B‑NHL a u mladých pacientů s akutní lymfoblastickou leukémií, a to často v situacích, kdy není k dispozici jiná léčebná alternativa. „Prostřednictvím této metody sice nedokážeme pomoci všem pacientům, ale velké části z nich ano,“ uzavřel svou prezentaci MUDr. Folber.