VIDEO Svoboda: Brněnské onkologické dny byly skvělé
Prof. MUDr. Marek Svoboda, Ph.D., ředitel Masarykova onkologického ústavu, a jeho zhodnocení 49. ročníku konference Brněnské onkologické dny.
Možnosti léčby metastatického kolorektálního karcinomu (mCRC) se od přelomu tisíciletí zásadně změnily a tento vývoj dále akceleruje. Přesto zdaleka ne všichni pacienti využijí všechny potenciální terapeutické modality. Na otázku, jak u těchto pacientů vystavět optimální sekvenci léčby, se zaměřilo sympozium podpořené společností Servier, které se konalo v rámci letošních Brněnských onkologických dnů.
Sympozium otevřel MUDr. Radim Němeček, Ph.D., z Kliniky komplexní onkologické péče MOÚ. Připomněl, že přibližně 20–30 procent pacientů s kolorektálním karcinomem je diagnostikováno již v metastatickém stadiu a u dalších 25–40 procent se metastázy objeví v průběhu nemoci. Česká republika stále patři mezi země s relativně vysokou incidencí tohoto nádoru, i když v posledních letech se díky soustředění na časný záchyt daří v této oblasti onkologie významně snižovat jak incidenci, tak mortalitu.
Při volbě algoritmu léčby metastatického kolorektálního karcinomu (mCRC) se nelze obejít bez vstupní znalosti molekulárního statusu. Kromě základních statusů, jako je mRAS (KRAS, NRAS) a mBRAF, kliniky zajímá přesná mutace. Aktuálně je k dispozici i léčba mutace KRAS G12C, zajímá nás HER2 status i status MSI/MMR (přítomnost mikrosatelitní nestability).
Molekulární podtypy mCRC
Mutace genů RAS, které se vyskytují přibližně u poloviny pacientů, jsou spojeny s horší prognózou a rezistencí k anti‑EGFR terapii; specifická mutace KRAS G12C1 je cílitelná novými inhibitory. U wtRAS je výrazná efektivita anti‑EGFR terapie především u levostranných nádorů. Mutace BRAF V600E, přítomná u osmi až dvanácti procent pacientů, má negativní prognostický význam a typicky se vyskytuje u pravostranných, mucinózních high grade karcinomů u starších žen. U této mutace nefunguje anti‑EGFR léčba (v monoterapii nebo v kombinaci s CHT). Efektivitu přináší kombinace inhibitorů BRAF v kombinaci s anti‑EGFR. MSI‑H, která se objevuje u dvou až pěti procent pacientů, se vyskytuje častěji u pravostranných nádorů a mBRAF (podobný fenotyp). HER2+ amplifikace/mutace přítomná u dvou až pěti procent mCRC vykazuje negativně prognostický faktor (horší OS) a je negativně prediktivní pro anti‑EGFR terapii. Efektivní je anti‑HER2 terapie, a to ideálně v kombinaci nebo při použití ADC. Povinné je dnes testování genu DPYD, který je přítomen u cca pěti procent mCRC. Jedná se o gen kódující enzym DPD, jehož defekt vede ke zvýšené toxicitě 5‑fluorouracilu až u 39 procent pacientů. Genotypizací lze detekovat přibližně pět procent pacientů. Snížení dávky 5FU u nosičů mutací DPYD eliminuje toxicitu a zachovává účinnost léčby.
Lokalizace primárního nádoru
Významným prediktivním a prognostickým faktorem je i lokalizace primárního nádoru. Pravostranné karcinomy, které tvoří přibližně třetinu případů, se vyznačují častější přítomností mutací KRAS, BRAF a MSI‑H a častými metastázami do peritonea. Jedná se agresivní nádory s horším OS. Hůře u nich funguje anti‑EGFR terapie. Naopak levostranné nádory, které představují dvě třetiny případů, mají příznivější prognózu. Častěji metastazují do jater a plic. U wtRAS/wtBRAF je vysoce účinná anti‑EGFR terapie (zlepšení PFS, OS, rychlé regrese).
Léčba mCRC v roce 2025
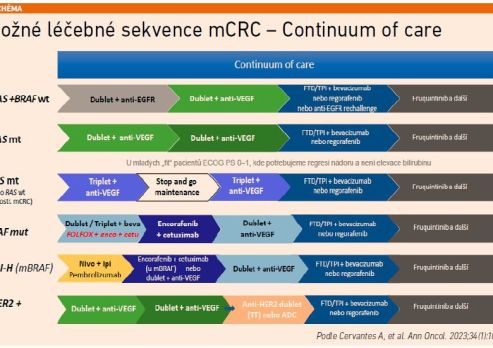 Aktuální guidelines pro léčbu mCRC pracují s konceptem kontinua péče, při němž by měl být pacient v průběhu onemocnění léčen několika liniemi systémové terapie s případným zařazením lokálních či lokoregionálních modalit. Cílem této strategie je maximalizovat benefity terapie a zachovat co nejlepší kvalitu života.
Aktuální guidelines pro léčbu mCRC pracují s konceptem kontinua péče, při němž by měl být pacient v průběhu onemocnění léčen několika liniemi systémové terapie s případným zařazením lokálních či lokoregionálních modalit. Cílem této strategie je maximalizovat benefity terapie a zachovat co nejlepší kvalitu života.
V 1. linii léčby mCRC s nemutovanými onkogeny RAS a BRAF je modalitou volby chemoterapie kombinovaná s anti‑EGFR terapií. Tento postup přináší jednoznačné benefity u levostranných nádorů a vede k lepší odpovědi na léčbu bez ohledu na stranovou lokalizaci. V případě progrese na léčbě anti‑EGFR v 1. linii je u pacientů v celkově dobrém klinickém stavu indikována kombinace chemoterapie a anti‑VEGF terapie.
První linie léčby mCRC s mutovaným onkogenem RAS a nemutovaným BRAF spočívá v kombinaci chemoterapie s anti‑VEGF. Při progresi onemocnění lze pokračovat v terapii stejnou anti‑VEGF látkou (bevacizumab) nebo indikovat jinou látku z téže skupiny (aflibercept).
U pacientů s mutovaným onkogenem BRAF je preferovanou kombinací v 1. linii dublet (ojediněle triplet) chemoterapie + anti‑VEGF. Po progresi onemocnění je standardem kombinace enkorafenib + anti‑EGFR. Samotné anti‑EGFR přípravky však mají u této skupiny jen minimální účinnost.
Ve 3. linii léčby, ke které se přistupuje po progresi onemocnění na dvou liniích systémové chemoterapie, je bez ohledu na mutační status onkogenů RAS a BRAF indikován trifluridin/tipiracil (FTD/TPI) ± bevacizumab nebo regorafenib. Terapie FTD/TPI je považována za standard léčby 3. linie u pacientů s mCRC předléčených 5‑fluorouracilem, oxaliplatinou, irinotekanem a cílenou terapií dle mutačního statusu onkogenů. Dlouhodobé zkušenosti s FTD/TPI dokládají, že tato terapie vede k oddálení doby do zhoršení výkonnostního stavu (PS > 2).
Sekvenční přístup („continuum of care“) spočívá v postupném využití všech dostupných modalit: od chemoterapeutických dubletů/tripletů s cílenou léčbou přes imunoterapii u MSI‑H pacientů až po novější přípravky (FTD/TPI, regorafenib, fruchintinib, inhibitory KRAS G12C, anti‑HER2 léčbu). Cílem je prodloužit celkové přežití, oddálit progresi a zároveň zachovat kvalitu života pacientů (viz schéma 1).
„Zvolit správnou strategii pro správného pacienta je velmi důležité nejen v první linii léčby. Bude‑li správně zvolena 1. linie léčby, umožní to dělat další správná rozhodnutí ve 2., 3. a dalších terapeutických liniích. Volba 1. linie je základní, protože ovlivní všechny další kroky v rámci kontinua poskytované péče. Vždy by měl být zvážen globální cíl léčby, zejména v závislosti na faktorech, jako je resekabilita tumoru, nádorová zátěž, symptomy a lokalizace nádoru. Důležité je u každého pacienta před zahájením 1. linie léčby provést test na mutace nebo alterace genu, především mutace RAS a BRAF i MSI/MMR a HER2,“ zdůraznil MUDr. Němeček.
Léčba mCRC po progresi na 2. linii
Možnostem léčby mCRC po progresi na 2. linii se na sympoziu věnoval významný zahraniční host prof. Dr. Gerald Prager, PhD (Medical University Vienna).
„Přestože se možnosti systémové léčby v posledních dvou dekádách významně rozšířily, terapeutické cíle se liší v závislosti na linii terapie. Zatímco v první linii usilujeme o maximální nádorovou odpověď a dlouhodobou kontrolu onemocnění, ve třetí linii se cíle posouvají k prodloužení doby přežití, udržení kvality života a symptomatické paliaci,“ uvedl prof. Prager.
V této souvislosti připomněl studii SUNLIGHT, která podle něj definovala nový standard péče pro pacienty s refrakterním mCRC. Do tohoto klinického hodnocení bylo zařazeno 492 dospělých pacientů s histologicky potvrzeným mCRC, výkonnostním stavem dle ECOG 0–1 a předchozí léčbou jedním až dvěma režimy chemoterapie a monoklonální protilátkou anti‑VEGF nebo anti‑EGFR. Obě ramena (monoterapie FTD/TPI vs. FTD/TPI + bevacizumab) byla velmi dobře vyvážena ve smyslu věku, zastoupení pohlaví, etnicity, pokročilosti a lokalizace nádoru i stran přítomnosti mutací. Doba od diagnózy první metastázy do randomizace byla u 57,5 procenta pacientů 18 měsíců nebo delší. Primárním cílem studie bylo potvrdit superioritu kombinace z hlediska celkového přežití (OS), sekundární sledované parametry zahrnovaly přežití bez progrese (PFS), podíl celkových odpovědí na léčbu, podíl pacientů s kontrolou onemocnění, kvalitu života a bezpečnost a snášenlivost léčby.
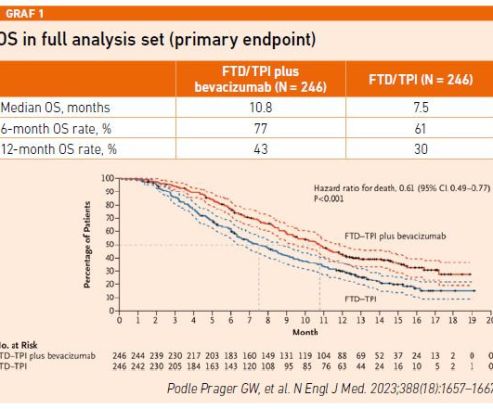 Kombinovaná léčba snížila riziko úmrtí téměř o 40 procent v porovnání s monoterapií FTD/TPI (mOS 10,8 vs. 7,5 měsíce) a studie dosáhla primárního cíle. Kombinovaná léčba FTD/TPI + bevacizumab také významně zlepšila celkové přežití bez ohledu na mutační stav RAS, lokalizaci primárního onemocnění, počet metastaticky postižených oblastí a předchozí léčbu bevacizumabem. Napříč tímto spektrem je benefit kombinované léčby naprosto jednoznačný (viz graf 1).
Kombinovaná léčba snížila riziko úmrtí téměř o 40 procent v porovnání s monoterapií FTD/TPI (mOS 10,8 vs. 7,5 měsíce) a studie dosáhla primárního cíle. Kombinovaná léčba FTD/TPI + bevacizumab také významně zlepšila celkové přežití bez ohledu na mutační stav RAS, lokalizaci primárního onemocnění, počet metastaticky postižených oblastí a předchozí léčbu bevacizumabem. Napříč tímto spektrem je benefit kombinované léčby naprosto jednoznačný (viz graf 1).
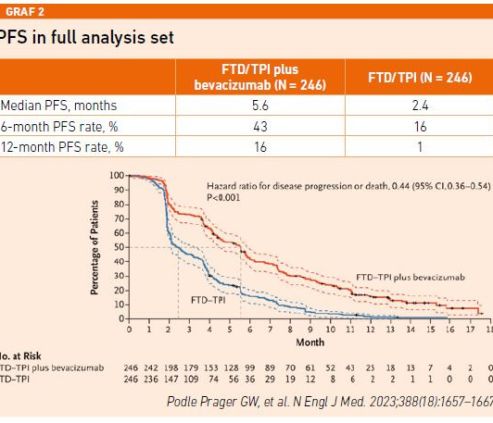 Stejného efektu bylo dosaženo i u sekundárních cílů. Riziko progrese onemocnění nebo úmrtí se snížilo o 56 procent (mPFS FTD/TPI + bevacizumab 5,6 měsíce vs. 2,4 měsíce u monoterapie). Kombinovaná léčba výrazně zlepšila PFS ve všech specifikovaných podskupinách pacientů (viz graf 2).
Stejného efektu bylo dosaženo i u sekundárních cílů. Riziko progrese onemocnění nebo úmrtí se snížilo o 56 procent (mPFS FTD/TPI + bevacizumab 5,6 měsíce vs. 2,4 měsíce u monoterapie). Kombinovaná léčba výrazně zlepšila PFS ve všech specifikovaných podskupinách pacientů (viz graf 2).
Celková četnost odpovědi byla pětkrát vyšší než v případě monoterapie (6,1 vs. 1,2 %), míra kontroly onemocnění byla vyšší téměř o 30 procentních bodů (69,5 vs. 41,9 %).
S pokročilostí nádoru se samozřejmě zhoršuje celkový zdravotní stav pacienta, jak se ale ukázalo, u kombinované léčby pomaleji. Doba do zhoršení výkonnostního stavu podle ECOG z hodnoty 0 nebo 1 na ≥ 2 se prodloužila o tři měsíce v porovnání s monoterapií.
Bezpečnost
Bezpečnostní profil léčby FTD/TPI + bevacizumab byl očekávatelný a zvládnutelný, odpovídal léčbě FTD/TPI i bevacizumabem v monoterapii. K nežádoucím účinkům, které se vyskytovaly častěji při kombinaci ve srovnání s monoterapií, patří neutropenie, nauzea a hypertenze. Léčba kombinací FTD/TPI + bevacizumab nevedla k vyššímu výskytu febrilní neutropenie.
Recentně byla publikována post hoc analýza studie SUNLIGHT zaměřená na klinické prognostické faktory (Tabernero J, Ann Oncol. 2024). Hodnotila výsledky léčby FTD/TPI v závislosti na prognostických charakteristikách nemocných. Skupina s příznivými prognostickými znaky byla přitom definována nízkou nádorovou zátěží (jedna nebo dvě lokality postižené metastázami) a méně agresivním onemocněním (doba od stanovení diagnózy do první metastázy ≥ 18 měsíců), skupina s nepříznivými prognostickými ukazateli pak vysokou nádorovou zátěží a agresivním onemocněním. V rámci skupiny s příznivou prognózou byla ještě definována podskupina s nejlepší prognózou, která byla navíc charakterizována absencí jaterních metastáz. Z analýzy vyplývá, že statisticky lepších výsledků ve smyslu prodloužení OS a PFS je proti primární kohortě při léčbě FTD/TPI dosahováno nejen ve skupině s příznivou prognózou, ale i ve skupině s nepříznivými prognostickými charakteristikami. Terapie tímto lékem vedla navíc k udržení dobrého výkonnostního stavu, zejména u nemocných s příznivými prognostickými ukazateli. Absolutně nejlepších výsledků při prodloužení OS i PFS bylo dosaženo ve skupině s nejlepšími prognostickými faktory. Tato statisticky signifikantní data ukazují, že ne zcela malá skupina pacientů může mít z terapie FTD/TPI ještě významně vyšší přínos, než tomu bylo při analýze celého souboru. Velmi důležitá je rovněž naprostá konzistence výsledků, kdy ve všech skupinách je dosahováno statisticky významně lepších ukazatelů OS a PFS proti placebu, tj. nezáleží na tom, ve které prognostické skupině je pacient zařazen; přínos léčby je o to větší, když nemocný vykazuje příznivé prognostické charakteristiky.
Prof. Prager v tomto kontextu připomněl ESMO Living Guidelines 2024, jež označují kombinaci FTD/TPI + bevacizumab za nový standard léčby ve 3. linii mCRC. „Přínos spočívá nejen v prodloužení přežití o tři až pět měsíců, což je v kontextu 3. linie léčby považováno za významné zlepšení, ale také v udržení kvality života, což je v této fázi léčby zásadní. Jelikož více než 95 procent pacientů s mCRC nemá dostupnou cílenou léčbu, představuje tato kombinace reálnou a široce využitelnou možnost pro většinu nemocných,“ zakončil prof. Prager.
Nejen prodloužení přežití, ale také zachování kvality života
O tom, do jaké míry představuje kombinace FTD/TPI + bevacizumab cestu k regresi onemocnění v pozdní linii, hovořila prof. MUDr. Beatrice Mohelníková Duchoňová, Ph.D., z Onkologické kliniky FN Olomouc. I ona zdůraznila, že léčba metastatického kolorektálního karcinomu (mCRC) prošla v posledních letech významným vývojem. Přesto však zůstává pro většinu pacientů nutností využívat účinné režimy i ve vyšších liniích terapie, protože cílená léčba je dostupná pouze malé části nemocných. V klinické praxi je proto zásadní hledat režimy, které dokážou zajistit nejen prodloužení přežití, ale také zachování kvality života.
Podle doporučení České onkologické společnosti (tzv. Modré knihy) je kombinace FTD/TPI s bevacizumabem doporučována jako standardní možnost po první a druhé progresi onemocnění a může být zvažována i po progresi třetí. Klíčovým předpokladem je, aby byl pacient stále v dobrém celkovém stavu („fit pacient“) a motivován pokračovat v aktivní onkologické léčbě. Aktualizované ESMO guidelines z června 2025 pak tuto kombinaci označují za léčebnou variantu číslo 1 pro „fit pacienty“ ve 3. linii léčby mCRC. Významně přitom zdůrazňují, že přínos této léčby je nezávislý na mutačním statusu tumoru. Kombinace FTD/TPI s bevacizumabem dosáhla v hodnocení ESMO‑MCBS skóre 4, což je v kontextu 3. linie léčby mimořádně vysoké a představuje jasný důkaz klinické relevance. Výsledky klinických studií jsou tedy přesvědčivé a ukazují, že tato strategie dokáže poskytnout významný benefit i pacientům, kteří již absolvovali více linií terapie.
Kombinace FTD/TPI s bevacizumabem oproti monoterapii významně prodlužuje dobu do progrese onemocnění, a to jak u pacientů s dobrou prognostickou charakteristikou (< 3 metastatická místa, ≥ 18 měsíců od diagnózy metastatického onemocnění), tak i se špatnou prognostickou charakteristikou (≥ 3 metastatická místa, < 18 měsíců od diagnózy metastatického onemocnění). Přežívání je lepší u pacientů s dobrou prognostickou charakteristikou.
Zajímavým a zároveň poněkud kontroverzním zjištěním je však vliv této léčby na celkové přežití. U pacientů s dobrou prognostickou charakteristikou nebyly rozdíly v celkovém přežití tak výrazné a nedosáhly statistické významnosti. Naopak u pacientů se špatnými prognostickými faktory došlo k výraznému prodloužení doby přežití. Tato pozorování otevírají otázku, zda jsou zmíněné charakteristiky v kontextu léčby kombinací FTD/TPI + bevacizumab skutečně prognostické. Zatímco prediktivní význam zřejmě zachovávají, jejich čistě prognostická hodnota byla v rámci subanalýzy studie SUNLIGHT do určité míry setřena.
V praxi to dokládá i předložená kazuistika. Pacient po progresi na této kombinaci pokračoval v léčbě fruchintinibem, při níž bylo opět dosaženo biochemické odpovědi. Klinický stav pacienta zůstal PS 1. Tento případ ukazuje, že i u vysoce předléčeného pacienta, který si zachovává dobrou kondici a motivaci, lze uvažovat o další účinné onkologické léčbě.
„Kombinace FTD/TPI + bevacizumab přináší klinicky významný benefit i u pacienta po několika liniích systémové léčby. Významným přínosem je nejen dosažená parciální regrese a prodloužení doby do progrese, ale také dlouhodobé zachování kvality života, které je v této fázi léčby zásadní. Kombinace FTD/TPI s bevacizumabem se etablovala jako účinná a dobře tolerovaná možnost ve 3. linii léčby metastatického kolorektálního karcinomu. V souladu s doporučeními České onkologické společnosti a ESMO představuje v tuto chvíli jednu z nejdůležitějších terapeutických strategií u pacientů, kteří jsou schopni podstoupit aktivní léčbu i po několika progresích,“ uvedla v závěru své prezentace prof. Mohelníková Duchoňová.
Jak si vede FTD/TPI s bevacizumabem v reálné praxi
Vlastní zkušenosti s kombinační léčbou FTD/TPI + bevacizumab popsal MUDr. Stanislav Batko z Onkologické kliniky 2. LF UK a FN Motol.
Kombinace FTD/TPI s bevacizumabem přináší významné prodloužení doby přežití, a to nezávisle na charakteristikách nádoru a pacienta. Ke zlepšení kvality života dochází i u těžce předléčených pacientů. Byla již publikována řada studií z nejrůznějších zemí světa a jejich výsledky jsou stejné jako ve studii SUNLIGHT, tedy významně prodloužená doba přežití, pohybující se kolem jednoho roku.
Například největší studie srovnávající klinické výsledky pacientů léčených monoterapií FTD/TPI a kombinací FTD/TPI + bevacizumab v reálných podmínkách (Nusrat M, J Clin Oncol. 2025) prokázala, že kombinace FTD/TPI + bevacizumab zlepšila klinické výsledky, včetně celkového přežití (9,4 vs. 6,4 měsíce), TTD (time to discontinuation) a TTNTD (time to next treatment or death), ve srovnání s FTD/TPI v monoterapii u pacientů s mCRC. Tyto výsledky jsou v souladu s výsledky studie SUNLIGHT.
V další studii z reálného prostředí v Texasu (Richards DA, J Clin Oncol. 2025) byl FTD/TPI používán převážně ve 3. linii, ve 2/3 v kombinaci s bevacizumabem. Charakteristika pacientů byla podobná jako ve studii SUNLIGHT, s vysokým podílem pacientů, kteří již dříve užívali antiangiogenní léčbu. Statisticky významný a klinicky relevantní přínos v délce přežití byl zaznamenán při přidání bevacizumabu k monoterapii (11,6 vs. 6,2 měsíce), což je opět v souladu s výsledky studie SUNLIGHT.
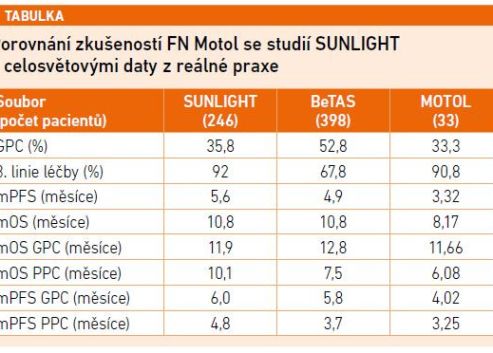
Ve studii BeTAS (Martinez Lago N, J Clin Oncol. 2025) se u pacientů s mCRC hodnotila účinnost a bezpečnost FTD/TPI + bevacizumab v reálné klinické praxi dle vstupních prognostických faktorů. Ve skupině s nejlepší prognostickou charakteristikou (best) bylo celkové přežití 18,3 měsíce, ve skupině s dobrou prognózou (good + best) 12,8 měsíce a ve skupině se špatnou prognózou (poor) 7,5 měsíce. Stejný vzorec byl i u PFS: 7,3 měsíce, 5,8 měsíce a 3,7 měsíce ve stejném pořadí prognostických skupin. To jsou velmi povzbudivé výsledky.
 Retrospektivní observační studie zaměřená na hodnocení účinnosti FTD/TPI ± bevacizumabu u metastatického kolorektálního karcinomu s MSI‑high/deficient MMR prokázala slibnou účinnost a příznivou bezpečnost. Ačkoli se jednalo o retrospektivní studii s malým počtem pacientů, léčba FTD/TPI + bevacizumab může mít lepší účinnost u MSI‑H/dMMR mCRC než u MSS/proficient MMR mCRC v předchozích prospektivních studiích.
Retrospektivní observační studie zaměřená na hodnocení účinnosti FTD/TPI ± bevacizumabu u metastatického kolorektálního karcinomu s MSI‑high/deficient MMR prokázala slibnou účinnost a příznivou bezpečnost. Ačkoli se jednalo o retrospektivní studii s malým počtem pacientů, léčba FTD/TPI + bevacizumab může mít lepší účinnost u MSI‑H/dMMR mCRC než u MSS/proficient MMR mCRC v předchozích prospektivních studiích.
Poté se již MUDr. Batko věnoval souboru 54 pacientů léčených režimem FTD/TPI + bevacizumab ve FN Motol v období 18 měsíců od ledna 2024 do července 2025 (viz tabulku 1).
Rozšiřující se data z reálné praxe potvrzují výsledky studie SUNLIGHT. Z léčby FTD/TPI + bevacizumab mají prospěch všichni pacienti s mCRC bez ohledu na výchozí prognostické faktory a charakteristiky nádoru. Motolské zkušenosti jsou v souladu s výsledky studie SUNLIGHT i celosvětovými daty z reálné praxe.
Kompletní kongresové zpravodajství z 49. ročníku Brněnských onkologických dnů je dostupné v příslušné medisekci nebo na tomto odkazu.
Prof. MUDr. Marek Svoboda, Ph.D., ředitel Masarykova onkologického ústavu, a jeho zhodnocení 49. ročníku konference Brněnské onkologické dny.
Prof. MUDr. Pavel Šlampa, CSc., Klinika radiační onkologie Masarykova onkologického ústavu. Nedávno došlo k významné optimalizaci přístrojového…
Součástí BOD byla i výstava věnovaná 150. výročí narození prof. Richarda Wernera, prvního ředitele Masarykova onkologického ústavu (respektive tehdy…
Rozhodnutí o nové síti komplexních onkologických center má padnout do konce září. Na 49. ročníku Brněnských onkologických dnů zdůraznil prof.…