ROZHOVOR: Vakcinaci proti HPV infekci bych doporučila všem sexuálně aktivním lidem
Vakcinace proti lidskému papilomaviru (HPV) v České republice vstoupila do praxe v roce 2006 s tím, že je určena především pro dívky před koitarche.…
Lidské papilomaviry (HPV) jsou malé neobalené viry s dvouřetězcovou DNA, které jsou schopny infikovat bazální epiteliální buňky kůže a sliznic. Do současné doby bylo identifikováno více než 400 typů HPV, z nichž průměrně 200 bylo plně klasifikováno. HPV patří mezi nejčastější patogeny postihující člověka, přičemž genitální infekce HPV je považována za nejčastější sexuálně přenosné onemocnění – průměrná celoživotní pravděpodobnost výskytu infekce HPV (u osob s alespoň jedním sexuálním partnerem opačného pohlaví) dosahuje 85 % u žen a 91 % u mužů, přičemž do věku 45 let se s virem HPV setká více než 80 % žen i mužů.
Lidské papilomaviry (HPV) jsou malé neobalené viry s dvouřetězcovou DNA, které jsou schopny infikovat bazální epiteliální buňky kůže a sliznic. Do současné doby bylo identifikováno více než 400 typů HPV, z nichž průměrně 200 bylo plně klasifikováno. HPV patří mezi nejčastější patogeny postihující člověka, přičemž genitální infekce HPV je považována za nejčastější sexuálně přenosné onemocnění1 – průměrná celoživotní pravděpodobnost výskytu infekce HPV (u osob s alespoň jedním sexuálním partnerem opačného pohlaví) dosahuje 85 % u žen a 91 % u mužů, přičemž do věku 45 let se s virem HPV setká více než 80 % žen i mužů.2 K přenosu HPV dochází primárně kontaktem kůže s kůží nebo kůže se sliznicí, přičemž hlavním způsobem transmise HPV je sexuální styk (možný je rovněž nepohlavní, vertikální přenos, tedy z matky, resp. rodičů na dítě).3 Mezi faktory zvyšující riziko infekce HPV proto patří především sexuální aktivita (vyšší počet sexuálních partnerů, mladší věk při zahájení sexuálního života, praktikování análního či orálního sexu), přítomnost či anamnéza jiné pohlavně přenosné infekce, HIV pozitivita či kouření.4
Většina infikovaných osob zůstává asymptomatická a infekci HPV eliminuje (udává se, že zhruba u 70 % osob infekce HPV vymizí do 1 roku a u 90 % osob do 2 let).5 U některých osob však může infekce perzistovat a v závislosti na typu přítomného HPV se u nich mohou rozvinout benigní léze, přednádorové léze či malignity.1 K eliminaci HPV je nezbytná účinná buněčná imunitní odpověď,5 riziko perzistence a progrese proto mají osoby s oslabenou imunitou,6 rizikovými faktory perzistence infekce HPV jsou rovněž konzumace alkoholu, kouření, vyšší počet sexuálních partnerů či koinfekce pohlavně přenosnými chorobami.7
HPV se z hlediska jejich onkogenního potenciálu dělí na nízce rizikové (LR) kožní (HPV-1, -2, -3, -7, -10, -27, -57, -73), nízce rizikové slizniční (HPV-6, -11, -40, -42, -44, -54, -55, -61, -62, -71 či -74) a vysoce rizikové (HR),1 které se nově dále dělí na velmi rizikové (HPV-16, -18, -45), středně rizikové (HPV-31, -33, -52, -58) a méně rizikové (HPV-35, -39, -51, -56, -59, -66, -68).8 Hlavním rozdílem mezi LR a HR typy HPV je to, že u LR virů zůstává virová DNA mimo buněčnou DNA (epizomální forma), zatímco v případě HR virů se virová DNA začleňuje do DNA hostitelské buňky (integrovaná forma). V důsledku integrace virové DNA do DNA hostitelské buňky dochází ke změnám ve virové DNA, které mají za následek deregulaci buněčného cyklu, inhibici apoptózy, vznik dalších mutací a nádorovou transformaci hostitelských buněk.9 Nejvýznamnějšími typy LR HPV jsou HPV-6 a HPV-11, které způsobují anogenitální bradavice (uvedené typy HPV jsou zodpovědné za vznik až 90 % případů anogenitálních bradavic10,11), mohou způsobovat rovněž rekurentní respirační papilomatózu (vzácné onemocnění charakterizované výskytem benigních papilomů v dýchacích cestách, zejména laryngu12) a nízce rizikové přednádorové změny, např. cervikální dysplazii nízkého stupně (přítomnost HPV-6 a/nebo HPV-11 byla nicméně detekována také až u 88 % karcinomů laryngu a až u 6 % karcinomů penisu).13 Z HR HPV pak jsou nejvýznamnější HPV-16 a HPV-18, které mohou vést ke vzniku přednádorových lézí i maligních nádorů – infekce HPV-16 a HPV-18 je zodpovědná za vznik 73 % případů karcinomu hrdla děložního, 74 % případů karcinomu vulvy, 71 % případů karcinomu vaginy, 87 % (!) případů karcinomu anu11 a 31 % případů karcinomu penisu;14 typ HPV-16 byl prokázán u 93 % případů (dlaždicobuněčného) orofaryngeálního karcinomu (OPC).15
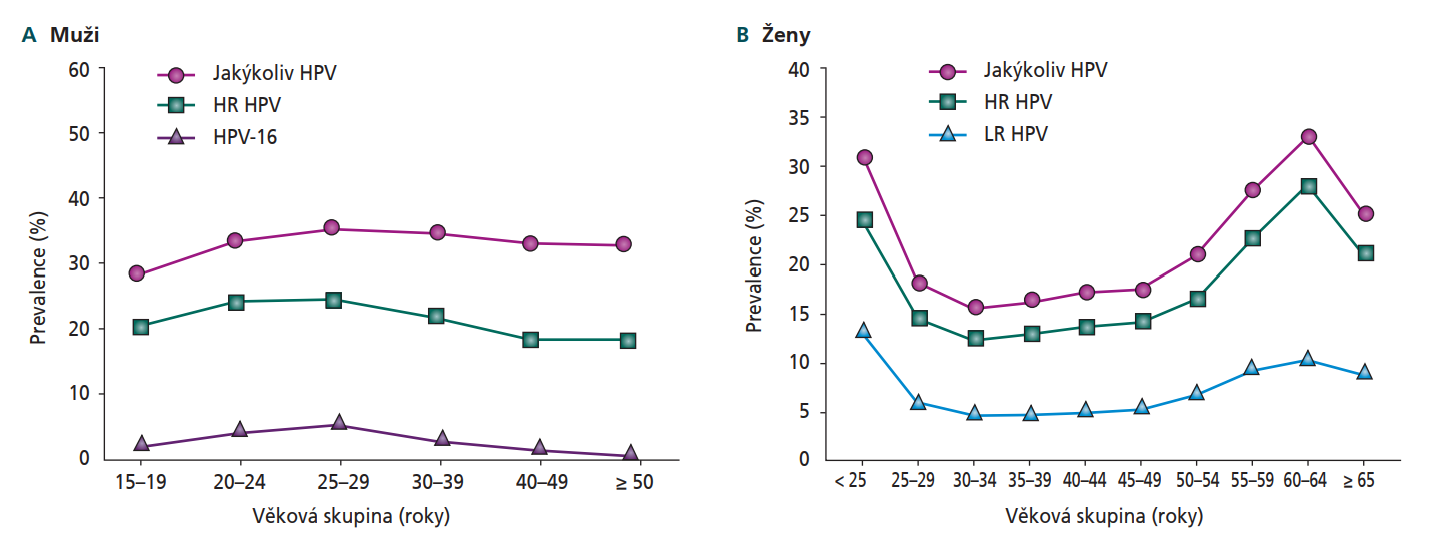
Prevalence infekce HPV celosvětově dosahuje 9–13 %, což odpovídá zhruba 630 milionům infikovaných osob.1 Jak již bylo uvedeno, výskyt infekce HPV je mírně vyšší u mužů než u žen, homosexuální či bisexuální muži přitom mají vyšší riziko infekce HPV než heterosexuální muži4 (nejvyšší prevalence HPV byla pozorována u homosexuálních HIV pozitivních mužů).16 V systematickém přehledu 65 studií s téměř 45 000 probandy17 činila průměrná prevalence infekce HPV (stěry odebírány z genitální a anální oblasti) u mužů 31 % (95% CI 27–35 %; rozmezí 1–84 %), přičemž prevalence infekce vysoce rizikovými typy HPV dosahovala 21 % (95% CI 18–24 %; rozmezí 1–75 %). V rámci HR HPV byl nejčastěji prokázán typ HPV-16 s prevalencí 5 % (95% CI 4–7 %), následovaný typy 51 (3 %, 95% CI 3–4 %), 52 (3 %, 95% CI 2–3 %), 59 (2 %, 95% CI 2–3 %) a 18 (2 %, 95% CI 2–3 %). Druhým celosvětově nejrozšířenějším typem HPV byl nízce rizikový typ HPV-6 (4 %, 95% CI 3–5 %). Věkově specifické křivky prevalence ukázaly vysoký výskyt HPV u mladých dospělých mužů, který zůstával vysoký po celou dobu dospělosti (naproti tomu u žen má prevalence infekce HPV bimodální průběh18) (obrázek 1A a B).17,18 Prevalence HPV byla nejvyšší u mužů ve věku 25–29 let (jakýkoli HPV 35 %, HR HPV 24 %, HPV-16 6 %), vysoká byla i u chlapců ve věku 15–19 let (jakýkoli HPV 28 %, HR HPV 20 %, HPV-16 3 %) –analýza tedy ukázala, že každý třetí muž ve věku ≥ 15 let je infikován alespoň jedním typem HPV a každý pátý muž je infikován alespoň jedním vysoce rizikovým (onkogenním) typem HPV. Při hodnocení podle geografického regionu byla nejvyšší prevalence HPV zjištěna v subsaharské Africe (37 %) následované Evropou a Severní Amerikou (36 %), naopak nejnižší prevalence byla dokumentována ve východní a jihovýchodní Asii (15 %).17
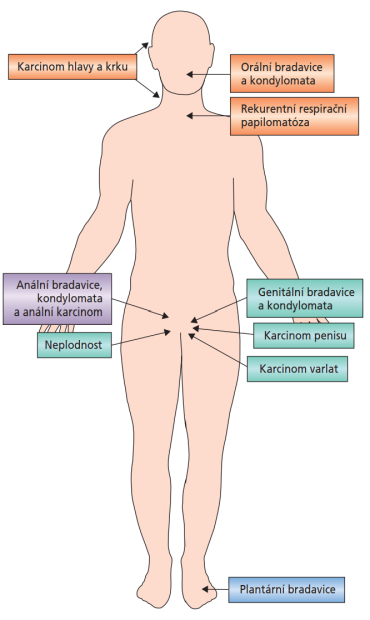 Dobře známa je souvislost mezi HPV a cervikálním karcinomem, která přitom může vést k mylnému přesvědčení, že HPV se týká pouze žen. Jak však již bylo uvedeno, infekcí HPV mohou být postiženi i muži. Viry HPV u mužů infikují anogenitální trakt a rovněž epitel dutiny ústní, orofaryngu či hrtanu prostřednictvím kožního kontaktu nebo vaginálního, análního či orálního sexu s infikovanou osobou. U mužů bývá imunitní odpověď na infekci HPV slabá (pouze 20–30 %) a non-protektivní, což často vede k recidivující infekci a podporuje transmisi viru. Virus se přitom může přenášet, i když infikovaná osoba nevykazuje žádné příznaky19 – většina infekcí HPV u mužů je asymptomatická. Vzhledem k tomu, že muži nejsou stran přítomnosti HPV rutinně vyšetřováni, mohou heterosexuální muži působit jako rezervoár infekce HPV a přenášet (nízce i vysoce rizikové typy) HPV na ženy.20 Kromě toho se i u mužů mohou vyskytnout různě závažná onemocnění související s HPV, tedy anogenitální bradavice (condylomata acuminata) nebo maligní nádory (karcinom penisu, anální karcinom a karcinom hlavy a krku [HNC]). U mužů navíc nejsou realizovány žádné rutinní screeningové programy, na rozdíl od žen (screening cervikálního karcinomu), což vede k oddálení diagnostiky a léčby, a tím i k horší prognóze nádorových onemocnění.19 Ukazuje se, že kromě karcinomu penisu, análního karcinomu a HNC může infekce HPV sehrávat úlohu rovněž při vzniku karcinomu prostaty nebo močového měchýře. Rovněž se objevují důkazy, že infekce HPV může nepříznivě ovlivňovat kvalitu spermatu a přispívat k neplodnosti (obrázek 2).16
Dobře známa je souvislost mezi HPV a cervikálním karcinomem, která přitom může vést k mylnému přesvědčení, že HPV se týká pouze žen. Jak však již bylo uvedeno, infekcí HPV mohou být postiženi i muži. Viry HPV u mužů infikují anogenitální trakt a rovněž epitel dutiny ústní, orofaryngu či hrtanu prostřednictvím kožního kontaktu nebo vaginálního, análního či orálního sexu s infikovanou osobou. U mužů bývá imunitní odpověď na infekci HPV slabá (pouze 20–30 %) a non-protektivní, což často vede k recidivující infekci a podporuje transmisi viru. Virus se přitom může přenášet, i když infikovaná osoba nevykazuje žádné příznaky19 – většina infekcí HPV u mužů je asymptomatická. Vzhledem k tomu, že muži nejsou stran přítomnosti HPV rutinně vyšetřováni, mohou heterosexuální muži působit jako rezervoár infekce HPV a přenášet (nízce i vysoce rizikové typy) HPV na ženy.20 Kromě toho se i u mužů mohou vyskytnout různě závažná onemocnění související s HPV, tedy anogenitální bradavice (condylomata acuminata) nebo maligní nádory (karcinom penisu, anální karcinom a karcinom hlavy a krku [HNC]). U mužů navíc nejsou realizovány žádné rutinní screeningové programy, na rozdíl od žen (screening cervikálního karcinomu), což vede k oddálení diagnostiky a léčby, a tím i k horší prognóze nádorových onemocnění.19 Ukazuje se, že kromě karcinomu penisu, análního karcinomu a HNC může infekce HPV sehrávat úlohu rovněž při vzniku karcinomu prostaty nebo močového měchýře. Rovněž se objevují důkazy, že infekce HPV může nepříznivě ovlivňovat kvalitu spermatu a přispívat k neplodnosti (obrázek 2).16
Anogenitální bradavice (AGW) jsou nejčastější klinickou manifestací infekce neonkogenními typy HPV.21 Jedná se o vysoce infekční, recidivující, obtěžující a stigmatizující pohlavně přenosné onemocnění, které negativně ovlivňuje kvalitu života pacientů. Celosvětová prevalence AGW je odhadována na 0,13–5,1 % s incidencí u mužů 103–170 případů na 100 000 osoboroků.22 Onemocnění je ve většině případů způsobeno nízce rizikovými typy HPV-6 a 11, méně často i jinými typy (HPV-2, -16, -18, -30 až -33, -35, -39, -41 až -45, -51 až -56 a -59).23 Ke vzniku projevů obvykle dochází do několika týdnů či měsíců po nákaze, ve značném počtu případů však může trvat až několik let, než se AGW objeví.24 Jedná se o kožní výrůstky vyskytující se v anogenitální oblasti,které mohou být solitární, o velikosti několika milimetrů, obvykle však bývají vícečetné a mohou se spojovat i do větších ložisek. Nejčastěji se projevují jako vyvýšené, masité papuly barvy kůže, mohou však být i bílé, růžové nebo hnědé. Mohou být filiformní, stopkaté či široké a ploché, případně až květákovité. Rozsáhlé útvary (condylomata acuminata gigantea), které se vzácně vyskytují zejména u imunodeficientních pacientů, se označují jako Buschkeho-Löwensteinův tumor.23,24,25 U mužů se AGW nejčastěji objevují na penisu (glans penis, sulcus coronarius, corpus penis23), mohou se však vyskytovati v dalších oblastech těla, které jsou při sexu v těsném kontaktu (třísla, perineum, perianální kůže, ústní dutina).24 Anogenitální bradavice jsou obvykle asymptomatické, nicméně někdy mohou být provázeny krvácením, pruritem či bolestí. Pacientům však způsobují významný psychický a psychosexuální distres.25 Diferenciálnědiagnosticky je u pacientů s AGW třeba vyloučit normální odchylky kůže (papillae coronae glandis [pearly penile papules] či sebaceózní cysty), jiná infekční či neinfekční onemocnění (condylomata lata, molluscum contagiosum, lichen planus, psoriáza), případně benigní (fibroepiteliální polypy, névy) či maligní nádory. V případě nejasností je možné k průkazu AGW využít polymerázovou řetězovou reakci (PCR).24,25
Anogenitální bradavice mohou časem spontánně vymizet, nicméně většina pacientů si přeje jejich okamžité odstranění. Léčba AGW má být individuální, dle počtu, velikosti, morfologie a lokalizace projevů. V terapii AGW se uplatňují jednak ablativní techniky a jednak lokální terapie. Ablativní techniky jsou využívány lékaři k odstranění bradavic v běžné praxi. Většina z nich je však pro pacienty nepříjemná a bolestivá, jsou spojeny s rizikem krvácení, destrukce tkáně, pomalého hojení či jizvení a rovněž s různě vysokou mírou recidiv. Mezi ablativní techniky patří kryoterapie (zmrazení AGW pomocí tekutého dusíku), laserová léčba (CO2 a Nd:YAG lasery – odpaření léze pomocí fokusované infračervené světelné energie), elektrokauterizace (destrukce AGW s využitím vysokofrekvenční elektrické energie), chirurgická léčba (vhodná i k odstranění rozsáhlých projevů působících obstrukci), případně aplikace kyseliny trichloroctové v koncentraci 33–50 % (chemické popálení AGW). V rámci lokální léčby (kterou si aplikují samotní pacienti) se uplatňuje především imunoterapie imiquimodem (stimulace imunitního systému k odstranění infikovaných lézí) či sinekatechiny (protizánětlivé, antiproliferativní, proapoptotické a antivirové působení) nebo lokální terapie podofylotoxinem (zastavuje dělení infikovaných buněk a způsobuje nekrózu tkáně).24 Pomoci zbavit se AGW mohou také systémově podávaná imunoterapeutika (např. inosin pranobex).26 Bohužel, jak již bylo uvedeno, AGW se často vracejí, což je frustrující pro pacienty i lékaře – četnost recidiv je nejnižší při využití lokální imunoterapie, nejvyšší je naopak u ablativních technik, které řeší pouze viditelné projevy, aniž by ovlivnily vyvolávající příčinu, tedy infekci HPV.24
Jak již bylo uvedeno, infekce HPV může vést ke vzniku karcinomu penisu, análního karcinomu či HNC, resp. OPC. V retrospektivní populační průřezové studii provedené v USA bylo identifikováno více než 650 000 případů malignit asociovaných s HPV, přičemž 40,2 % případů se vyskytlo u mužů a 59,8 % u žen. Ve více než polovině (52,4 %) případů malignit u žen šlo o cervikální karcinom, zatímco většinu (80,1 %) případů malignit u mužů představovaly orofaryngeální karcinomy. U mužů byl zaznamenán každoroční nárůst výskytu OPC o 2,7 % a análního karcinomu o 1,83 % (p < 0,001); u žen zůstával výskyt OPC stabilní, nicméně výskyt análního karcinomu se každoročně zvyšoval o 2,83 % (p < 0,001).27
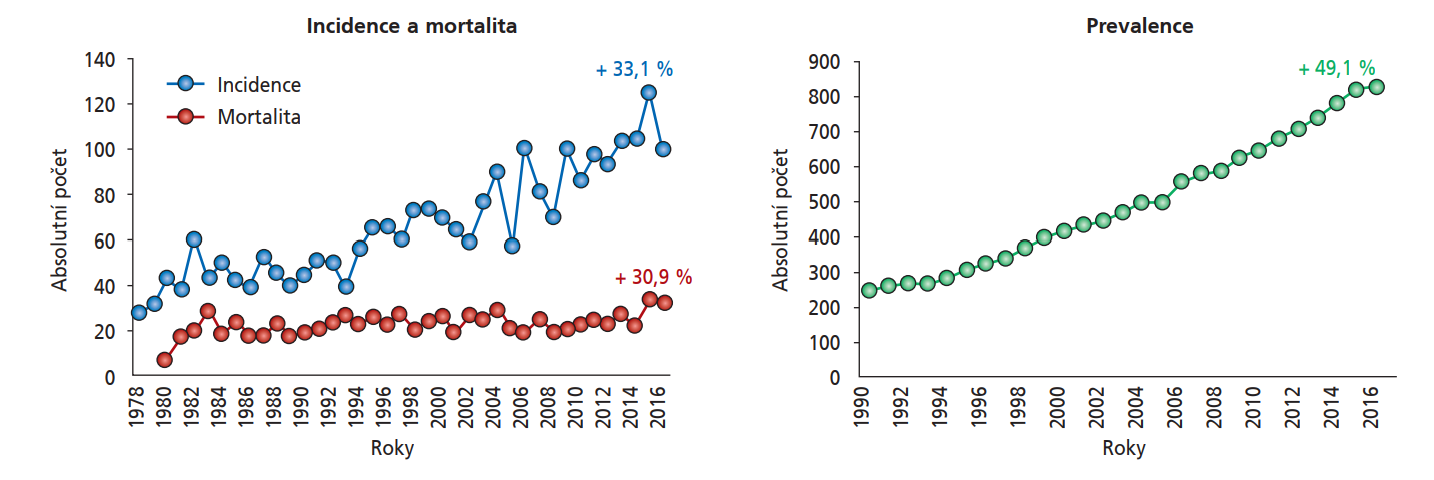
Výskyt karcinomu penisu je zřídkavý – v roce 2022 bylo celosvětově zaznamenáno téměř 38 000 případů, přičemž karcinom penisu byl 30. nejčastější malignitou (hned po karcinomu vulvy).28 Karcinom penisu je typický pro rozvojové země s nízkou úrovní hygieny a vzdělání a jeho výskyt se v jednotlivých zemích značně liší. Nejvyšší incidence je hlášena v Jižní Americe, Jižní Africe a Indii.29 Celosvětově však výskyt karcinomu penisu narůstá, a to i v České republice (obrázek 3).30 Jeho incidence stoupá s věkem, přičemž nejvyšší je ve věkové skupině > 60 let.29 Zhruba 40 % případů karcinomu penisu vzniká v souvislosti s infekcí HPV,16,19 přičemž u invazivního karcinomu je nejčastěji prokazován typ HPV-16 (40–70 %), následovaný HPV-6 (22 %), HPV-52 (15 %) či HPV-11 (4 %).23 Kromě infekce HPV jsou dalšími rizikovými faktory infekce HIV, chronické zánětlivé stavy (balanopostitida, lichen sclerosus et atrophicus), kouření, fimóza, absence cirkumcize, vyšší počet sexuálních partnerů a nižší socioekonomický status.29,31
Ve většině případů karcinomu penisu se jedná o dlaždicobuněčný karcinom a jeho varianty; některé histologické subtypy mohou být spojeny s vysokým grade a agresivním biologickým chováním. Většina karcinomů vzniká na žaludu, v oblasti sulcus coronarius nebo na předkožce a mívá podobu nebolestivé bulky či vředu (vzácněji se nádor projevuje erytémem nebo vyrážkou). Přibližně 25 % pacientů má v anamnéze preexistující kožní onemocnění penisu (balanitis xerotica obliterans, chronický zánět, Bowenova choroba, genitální bradavice, Queyratova erytroplazie apod.).31 Již v době stanovení diagnózy může být přítomno uzlinové postižení, 47–85 % pacientů má již vstupně metastatické onemocnění. Diagnostika karcinomu penisu je často opožděná, což může souviset s nespecifickými počátečními příznaky onemocnění, souběžnou fimózou maskující lézi či sociální stigmatizací, studem a nedostatečnou informovaností pacientů.31 K dosažení optimálních léčebných výsledků u pacientů s karcinomem penisu je nezbytný multidisciplinární a multimodální přístup zahrnující chirurgickou léčbu, radioterapii a chemoterapii, nejlépe ve specializovaných velkoobjemových centrech. Navzdory adekvátní terapii dosahuje 5leté přežití pacientů (bez ohledu na stadium onemocnění) asi 50 %, u pacientů s pozitivními lymfatickými uzlinami pak pouze 27 %. Prognóza pacientů s pokročilým onemocněním tedy zůstává špatná, neboť možnosti systémové léčby jsou stále velmi omezené. To se však s bližší molekulárněgenetickou charakterizací těchto nádorů může změnit – bylo zjištěno, že asi 30–50 % karcinomů penisu vykazuje expresi ligandu PD-L1, v terapii karcinomu penisu by se tak mohly uplatnit mj. inhibitory imunitních kontrolních bodů (imunoterapie). To je v současné době zkoumáno v řadě probíhajících klinických studií.31
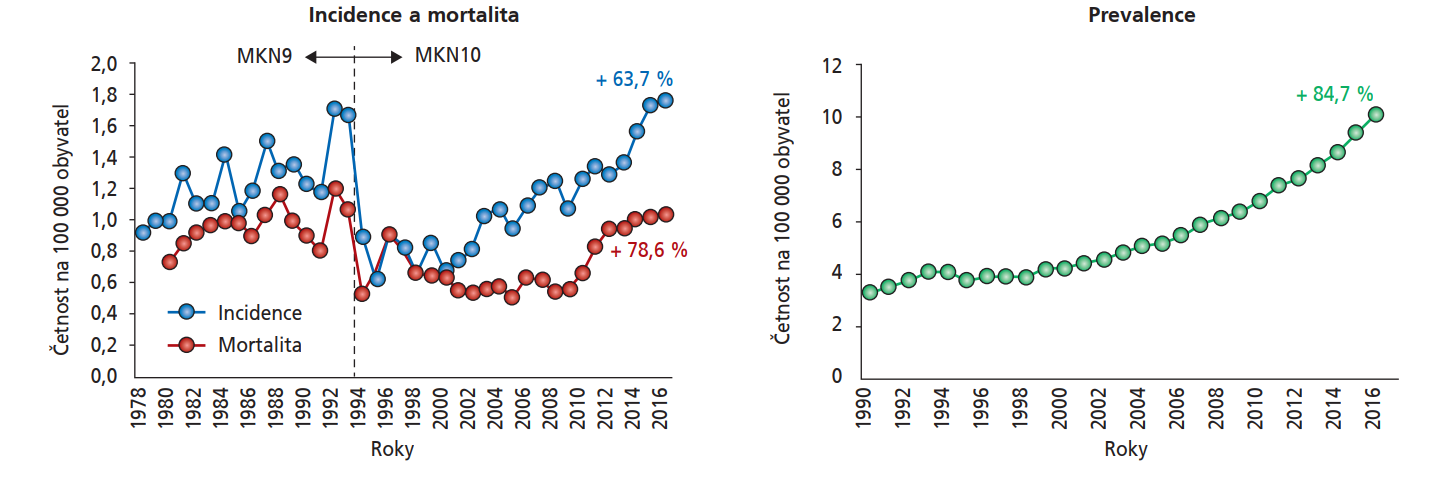
Anální karcinom patří rovněž mezi relativně vzácná nádorová onemocnění – odhadovaný výskyt análního karcinomu v roce 2024 byl 10 500 nových případů.32 Jak již ovšem bylo uvedeno, incidence i mortalita v důsledku análního karcinomu stoupá, a to opět i v České republice (obrázek 4).30 V publikovaném přehledu z roku 2023 byla nejvyšší věkově standardizovaná incidence análního karcinomu u mužů (v letech 2008–2012) zjištěna v Německu (1,65/100 000osoboroků) a nejvyšší věkově standardizovaná mortalita v důsledku análního karcinomu u mužů (v letech 2015–2019) byla dokumentována na Slovensku (0,90/100 000 osoboroků), následovaném Českou republikou (!) (0,61/100 000 osoboroků) a Rumunskem (0,42/100 000 osoboroků).33 Hlavním rizikovým faktorem vzniku análního karcinomu je infekce HPV (HPV jsou přítomny v 80–96 % případů, přičemž nejčastěji je prokazován typ HPV-16),23 dalšími rizikovými faktory jsou kouření, sexuální aktivita (vyšší počet sexuálních partnerů, anální sex), přítomnost anogenitálních bradavic či oslabená imunita, včetně infekce HIV34 (riziko análního karcinomu je obzvláště vysoké u homosexuálních mužů s HIV19).
Ve většině případů análního karcinomu se jedná o dlaždicobuněčný karcinom (90 %), méně často se vyskytují adenokarcinom, neuroendokrinní karcinom, případně melanom.35,36 Soudí se, že vznik análního karcinomu přímo souvisí s komplexním zánětlivým procesem v důsledku infekce HPV; jeho rozvoj předznamenává nález anální intraepiteliální neoplazie (AIN) nebo spinocelulárního karcinomu in situ (Bowenova choroba). Anální intraepiteliální neoplazie lze (podobně jako například cervikální intraepiteliální neoplazie) klasifikovat do stadií I–III v závislosti na míře abnormalit v diferenciaci a zrání dlaždicových vrstev, mitotické aktivity a změn jaderné membrány. Anální intraepiteliální neoplazie může následně přejít v invazivní spinocelulární karcinom (SCC), k čemuž dochází v 10–11 % případů. Anální karcinom má tendenci k lokálnímu šíření, má však i potenciál metastazovat.35 Onemocnění může být asymptomatické, nebo se může manifestovat krvácením, bolestí, úbytkem hmotnosti, pocitem masy v konečníku, výhřezem tkáně, inkontinencí stolice či obstipací. Diagnostika je často opožděná (asi pětina pacientů vyhledá lékaře až za 6 měsíců od nástupu příznaků či později), nezřídka i chybná (onemocnění je mylně považováno nejčastěji za hemoroidy).35
Léčba závisí na stadiu onemocnění: u nejméně pokročilého stadia je možná lokální excize, u pokročilejších stadií se uplatňuje chemoterapie (mitomycin-C či cisplatina v kombinaci s fluorouracilem) a radioterapie, u nemocných s metastatickým onemocněním je využívána chemoterapie (fluorouracil, mitomycin-C, cisplatina, paklitaxel).35 Pětileté přežití pacientů s análním karcinomem se pohybuje okolo 82 % v případě lokalizovaného onemocnění, 66 % v případě lokálně pokročilého onemocnění a 35 % v případě metastatického onemocnění.36 V současné době probíhají rovněž studie hodnotící úlohu imunoterapie u análního dlaždicobuněčného karcinomu.35,36
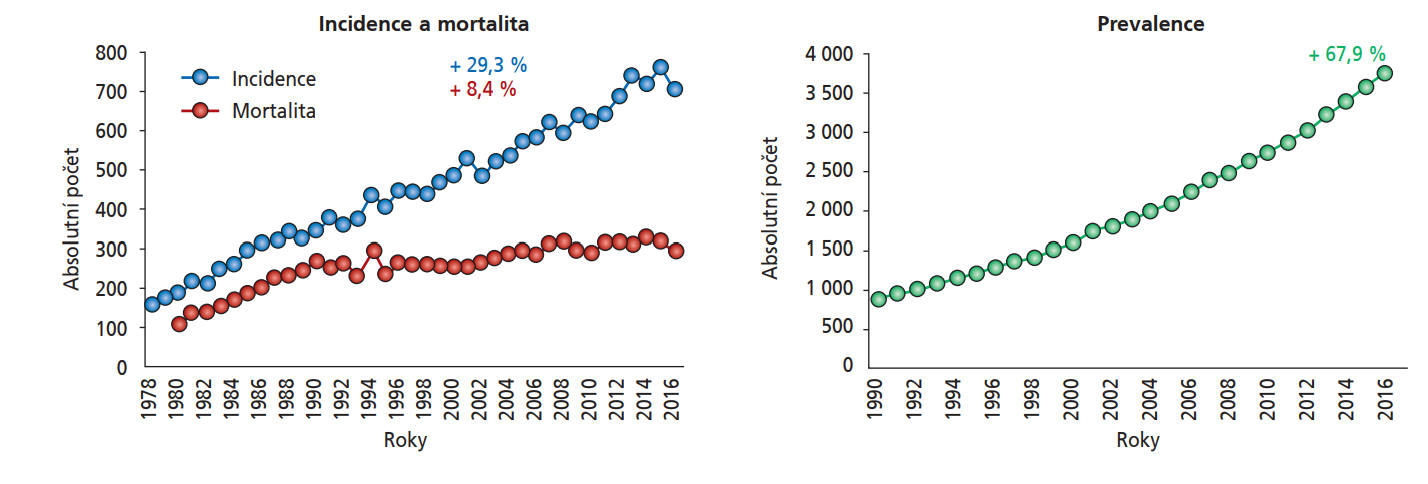
Maligní nádory hlavy a krku představují asi 4,8 % všech zhoubných nádorů, 90 % HNC přitom vychází z dlaždicových buněk vystýlajících dutinu ústní, farynx, larynx či vzácněji nosní dutinu. Incidence HNC se liší v závislosti na subtypu a geografickém regionu.16 V roce2022 bylo celosvětově zaznamenáno 189 000 případů karcinomu laryngu (20. nejčastější malignita), 120 000 případů karcinomu nasofaryngu (23. nejčastější malignita), 106 000 případů karcinomu orofaryngu (24. nejčastější malignita) a 86 000 případů karcinomu hypofaryngu (25. nejčastější malignita).28 Výskyt HNC stoupá, přičemž za poslední dekádu se zvýšil o 36,5 %.16 Stoupající incidence HNC je popisována i v ČR (obrázek 5);30 v roce 2021 bylo toto onemocnění v ČR 9. nejčastěji diagnostikovaným novotvarem.37 Kromě incidence HNC stoupá také prevalence HPV u dlaždicobuněčných HNC (naproti tomu podíl kouření a konzumace alkoholu, historicky významných rizikových faktorů, na vzniku HNC klesá), v současné době se předpokládá, že ve Spojených státech stojí infekce HR HPV za polovinou případů dlaždicobuněčných HNC. Na vzniku dlaždicobuněčných HNC souvisejících s HPV se podílejí především (v 85 %) typy HPV-16 a HPV-18, ve zbylých 15 % se uplatňujíHPV-33, -35, -52, -45, -39 či -58.16 Nejčastějším subtypem HNC vznikajícím v souvislosti s infekcí HPV je orofaryngeální karcinom (dle dat z USA a UK je HPV způsobeno 71 %, resp. 52 % všech dlaždicobuněčných OPC [OPSCC]38), přičemž převážná většina orálních infekcí HPV je získána sexuálním kontaktem. HPV-asociovaný OPSCC bývá lokalizován nejčastěji v oblasti patrové tonzily či báze jazyka – jejich nepravidelný povrch zřejmě vytváří příznivé prostředí pro perzistenci infekce HPV a následný vznik karcinomu).16 Incidence OPSCC asociovaného s HPV se za poslední dekády dramaticky zvýšila (dle studie z USA až o 225 %39),stoupá přitom zejména v mladších věkových kategoriích (s minimální či žádnou expozicí tabáku), a to především v Severní Americe a severní Evropě. V USA i UK je OPSCC v současnosti nejčastějším nádorovým onemocněním asociovaným s HPV, dokonce častějším než cervikální karcinom (!).16,38
HPV-pozitivní OPSCC se v porovnání s HPV-negativním OPSCC objevuje v mladším věku, je častější u mužů a bělochů, je slaběji asociován s konzumací alkoholu, a naopak je významně asociován se sexuálním chováním38 – nejsilnějším a nejkonzistentnějším faktorem asociovaným s HPV-pozitivním OPC je celoživotní počet (orálních) sexuálních partnerů (ten bývá větší právě u mužů); relevantními faktory jsou také věk prvního orálního sexu, intenzita orálního sexu, starší sexuální partner (> 10 let) nebo partner mající mimomanželský sex.40 HPV-pozitivní OPSCC se vyznačuje rovněž odlišným klinickými biologickým chováním (včetně molekulárněgenetického profilu či profilu imunitních buněk a nádorového mikroprostředí) a pacienti s HPV-pozitivním OPSCC mají lepší prognózu než nemocní s HPV-negativním OPSCC (to je dáno i tím, že HPV-pozitivní OPSCC mají tendenci zakládat rozsáhlé metastázy v cervikálních lymfatických uzlinách manifestující se otokem krku, což umožňuje časnější stanovení diagnózy). Riziko úmrtí je u pacientů s HPV-pozitivním OPSCC o 50 % nižší než u nemocných s HPV-negativním OPSCC.16
OPSCC se nejčastěji projevuje jako útvar na krku, bolestí v krku, dysfagií, pocitem „knedlíku v krku“, odynofagií či otalgií, klinický obraz OPSCC tak lze snadno zaměnit s jinými běžnými benigními stavy. Většina pacientů má malý primární nádor (T1 nebo T2) a uzlinové metastázy, u části pacientů s HNC se může vyskytovat pouze krční lymfadenopatie. V rámci diagnostiky je velmi důležité stanovení stavu HPV, neboť v případě HPV pozitivity je možná deeskalace léčby38 (markerem infekce HPV v postižených tkáních je overexprese proteinu p16INK4a).16 Kromě stavu HPV má na prognózu pacientů (a výběr terapie) vliv také histologický subtyp OPSCC, velikost nádoru, postižení lymfatických uzlin či kuřáctví.38,41 Při výběru terapie je kromě charakteristik onemocnění nutné zohlednit také celkový zdravotní stav a preference pacienta, možné nežádoucí účinky a funkční a kosmetické výsledky, nezbytný je opět individualizovaný a multidisciplinární přístup.41 V léčbě pacientůs OPSCC se uplatňuje chirurgie (je-li to možné, jsou preferovány méně invazivní techniky, jako je transorální laserová mikrochirurgie či transorální robotická chirurgie), radioterapie a chemoterapie (cisplatina, docetaxel, fluorouracil, paklitaxel), cílená léčba (anti-EGFR monoklonální protilátka cetuximab) a imunoterapie (pembrolizumab,nivolumab).38,41 Navzdory příznivé prognóze HPV-pozitivních OPSCC dochází u 10–25 % pacientů k recidivě onemocnění (obvykle do 2–5 let od stanovení diagnózy), proto je nutné pravidelné sledování.38 Po terapii OPC mnohdy zůstávají pacientům následky v podobě narušených žvýkacích, polykacích a artikulačních funkcí a také estetické problémy. To výrazně ovlivňuje jejich každodenní život a nevyhnutelně snižuje jeho kvalitu, pacienti se potýkají s úzkostmi či depresemi.42 U pacientů s HNC bylo dokumentováno téměř dvojnásobně vyšší riziko sebevražd v porovnání s pacienty s jinými malignitami, což svědčí o výrazném psychosociálním dopadu tohoto onemocnění.43
Přenos infekce HPV na ženy
Přibývá důkazů o tom, že muži sehrávají důležitou úlohu při přenosu infekce HPV na ženy (jak již bylo uvedeno, infekci HPV mohou přenášet i bezpříznakoví muži). Nejzávažnějším a nejvýznamnějším nepříznivým zdravotním následkem infekce HPV u žen je cervikální karcinom, který je v současnosti čtvrtou nejčastější malignitou u žen.44 Cervikální karcinom vzniká na podkladě perzistentní infekce vysoce rizikovými, onkogenními typy HPV, přičemž sexuální chování mužů je zásadním faktorem ovlivňujícím vznik onemocnění děložního čípku u žen – zkřížená infekce mezi partnery často vede k perzistentní infekci HPV, která zvyšuje pravděpodobnost vzniku high-grade lézí děložního hrdla, jež nakonec mohou vyústit v cervikální karcinom.19 Světová zdravotnická organizace (WHO) vytvořila globální strategii za účelem dosažení eliminace cervikálního karcinomu do roku 2030.45 Pokud přitom usilujeme o dosažení tohoto cíle, je nezbytné do prevence zapojit i muže – přístup zaměřený pouze na ženy zcela opomíjí skutečnost, že HPV se primárně přenáší z muže na ženu (případně z muže na muže) prostřednictvím sexuálního styku.19
Infekce HPV je jednou z nejčastějších pohlavně přenosných infekcí, a to nejen u žen, ale i u mužů – během svého života se s HPV setká 9 z 10 mužů. Bylo zjištěno, že každý třetí muž ve věku ≥ 15 let je infikován alespoň jedním typem HPV a každý pátý muž je infikován alespoň jedním vysoce rizikovým typem HPV. U mužů probíhá většina infekcí HPV asymptomaticky, sexuálně aktivní muži proto mohou působit jako rezervoár infekce HPV a přenášet (nízce i vysoce rizikové typy) HPV na své partnerky a partnery. U mužů může vést infekce HPV k výskytu anogenitálních bradavic či zhoubných nádorů, z nichž nejvýznamnějším je karcinom hlavy a krku, resp. orofaryngeální karcinom. Incidence OPC souvisejícího s HPV za poslední dekády dramaticky vzrostla, jedná se přitom o závažné, potenciálně fatální onemocnění s častými nepříznivými následky. Tyto skutečnosti zdůrazňují důležitost začlenění mužů do komplexních strategií prevence HPV s cílem snížit morbiditu a mortalitu související s HPV u mužů a v konečném důsledku i u žen.
Literatura
V digitální podobě: https://www.farmakoterapie.cz/
Vakcinace proti lidskému papilomaviru (HPV) v České republice vstoupila do praxe v roce 2006 s tím, že je určena především pro dívky před koitarche.…
Retrospektivní kohortová studie z České republiky hodnotí, jak profylaktické i postkonizační očkování proti HPV ovlivňuje riziko opakovaného výskytu…
Na webináři s tématem doporučení pro očkování v rámci prevence onemocnění asociovaných s infekcí HPV diskutovali přední odborníci – MUDr. Vladimír…
Webinář s tématem doporučení pro očkování v rámci prevence onemocnění asociovaných s infekcí HPV. Problematiku diskutovali přední odborníci – MUDr.…