Aktuální možnosti suplementace vápníku a vitamínu D v České republice
Osteoporóza je systémové onemocnění skeletu charakterizované úbytkem kostní hmoty a poruchami mikroarchitektury kostní tkáně, jehož důsledkem je…
V klinické praxi se u endokrinologických diagnóz často setkáváme se sekundární osteoporózou, jejíž příčinou může být některé z chronických onemocnění nebo jeho dlouhodobá léčba, která nepříznivě ovlivňuje kostní metabolismus.
V těchto případech je kostní metabolické onemocnění způsobeno například poruchou sekrece kortizolu, růstového hormonu, hormonů štítné žlázy, parathormonu či poruchou sekrece nebo účinku inzulinu. Mezi další významné příčiny sekundární osteoporózy patří i dlouhodobá léčba glukokortikoidy. Suplementace vápníku a vitamínu D je tak nedílnou součástí léčby sekundární osteoporózy u endokrinologických pacientů.
Osteoporóza je definována jako systémové metabolické onemocnění skeletu charakterizované úbytkem kostní hmoty, sníženou hustotou kostního minerálu (BMD) a zhoršením kostní mikroarchitektury. Důsledkem osteoporózy je větší kostní fragilita, vyšší riziko nízkotraumatických zlomenin, tzn. zlomenin způsobených traumatem i malé intenzity, běžné jsou například pády starších osob při běžných denních činnostech.1
Dle etiopatogeneze dělíme osteoporózu (OP) do dvou základních skupin, na primární a sekundární. Rozdělení ukazuje tabulka 1.
Tabulka 1 Rozdělení osteoporózy dle etiopatogeneze2,3
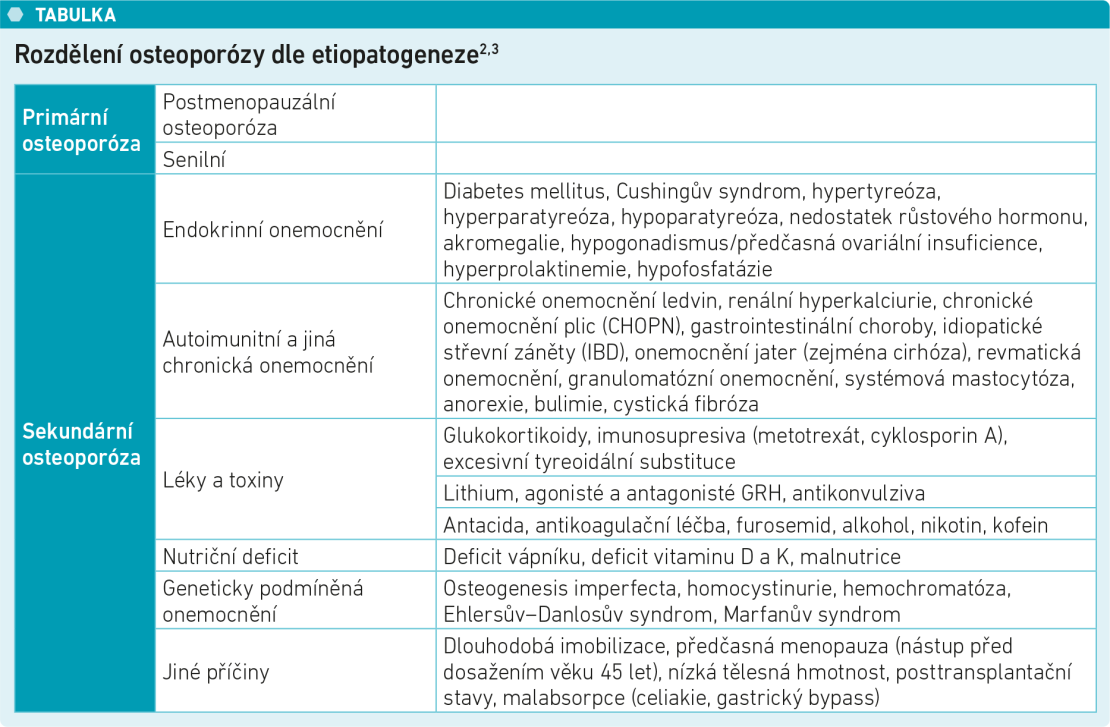
Primární OP zahrnuje, kromě idiopatické osteoporózy vyskytující se u dětí a mladých dospělých s neznámou etiopatogenezí, zejména estrogen-deficitní postmenopauzální osteoporózu, která postihuje ženy ve věku nad 50 let, a senilní osteoporózu, jež postihuje muže i ženy starší 75 let a souvisí se stárnutím a s ním spojenými metabolickými a funkčními změnami organismu.2
Sekundární OP je stav, kdy dochází k rozvoji kostního metabolického onemocnění na základě jiných rizikových faktorů než v případě primární OP. Tento stav ovlivňuje specifická klinická situace nebo onemocnění, především chorobné stavy přispívající k rozvoji osteoporózy a iatrogenní příčiny související s farmakologickými či nefarmakologickými intervencemi, jako je chirurgie nebo radioterapie.
Sekundární a primární příčiny OP se v reálné klinické praxi často vzájemně kombinují, u mnoha pacientů je příčina sekundární OP multifaktoriální. Sekundární OP postihuje až 30 % postmenopauzálních žen, více než 50 % premenopauzálních žen a 50–80 % mužů.4
Mechanismus rozvoje sekundární OP je různý podle typu vyvolávajícího faktoru. Výrazné zvýšení kostní resorpce, které lze jen obtížně kompenzovat zrychlenou tvorbou a mineralizací kosti, je charakteristické pro hypertyreózu, hyperparatyreózu, sarkopenii, hypovitaminózu vitamínu D, hypogonadismus nebo malabsorpci. Inhibice tvorby kosti a zhoršování kvality kostní hmoty jsou běžné například pro glukokortikoidy indukovanou OP nebo diabetes mellitus 1. typu. Prozánětlivý stav se zvýšenou kostní resorpcí, inhibicí tvorby kosti a zhoršením kostní mikroarchitektury a kvality kostí má vliv na rozvoj OP u chronických zánětlivých onemocnění (revmatoidní artritida, axiální spondylartritida, systémový lupus erythematodes, CHOPN a IBD).4
Mezi nejčastější endokrinologická onemocnění spojená se sekundární osteoporózou lze zařadit primární hyperparatyreózu (PHP), hypertyreózu, tyreotoxikózu, poruchy tvorby růstového hormonu, diabetes mellitus a hypogonadismus.
Primární hyperparatyreóza (PHP) je nejčastější příčinou hyperkalcemie. Nadprodukce parathormonu (PTH) vede k vyplavování vápníku z kostí, což se následně projevuje hyperkalcemií a hyperkalciurií. Na rozdíl od PHP nebývá sekundární hyperparatyreóza spojována s hyperkalcemií.
Většina pacientů s PHP je asymptomatických. K manifestaci klinických projevů dochází až při závažnější hyperkalcemii. Typické klinické projevy zahrnují mimo postižení skeletu také postižení ledvin (nefrolitiáza a nefrokalcinóza), postižení kloubů (chondrokalcinóza), postižení kardiovaskulárního systému (zejména arteriální hypertenzi a poruchy srdečního rytmu), pankreatitidu a tvorbu peptických vředů.
Skeletální účinek parathormonu je různý v případě kortikální a trabekulární kosti – účinek PTH na kortikální kost je katabolický, u trabekulární kosti anabolický. Na to je třeba pamatovat v případě diagnostiky OP v rámci vyšetření DXA. Postižení skeletu ve smyslu snížené kostní denzity se nejvíce projeví na distálním předloktí, ve kterém je nejvíce kortikální kosti, méně na krčku femuru, kde kost tvoří obě složky, a naopak zvýšení kostní denzity můžeme pozorovat v oblasti lumbální páteře. U žen s postmenopauzální osteoporózou jsou obvyklé opačné údaje (nejnižší denzita kosti v oblasti lumbální páteře), proto postmenopauzální pacientky s PHP mohou mít lepší denzitu lumbální páteře než pacientky s čistě estrogen-deficitní postmenopauzální osteoporózou.3
Podstatou léčby sekundární osteoporózy navozené PHP je léčba primárního onemocnění. Léčba zahrnuje kauzální terapii, která může být chirurgická (odstranění postiženého příštítného tělíska), léčbu symptomatickou, která se zaměřuje na snížení hladiny PTH (např. kalcimimetika), a podpůrnou léčbu, zahrnující dostatečný příjem vápníku současně s vitamínem D ideálně v jeho aktivní formě, např. vitamín D3 – cholekalciferol, který podporuje vstřebávání vápníku ve střevě.
I když by pacienti s PHP měli přizpůsobit svůj jídelníček tak, aby zvýšili příjem vápníku ze stravy, na dostatečný příjem vápníku pouze touto formou nelze spoléhat. Proto se doporučuje suplementovat vápník a vitamín D3 ideálně formou registrovaných léčivých přípravků s fixní kombinací. Doporučený denní příjem vápníku je 1 000 mg rozdělených do dvou dávek, protože dávky nad 500 mg přesahují absorpční kapacitu gastrointestinálního traktu.
Cholekalciferol podáváme v doporučené denní dávce 800–1 000 IU denně k udržení sérové koncentrace 25(OH)vitamínu D > 50 nmol/l (optimální hladina je v rozmezí 75–125 nmol/l).5
Po vyřešení příčiny hyperparatyreózy bývá osteoporóza často léčena antiresorpčními léky (bisfosfonáty nebo denosumabem), současně s touto léčbou je také nezbytná suplementace vápníku a vitamínu D3.
Z onemocnění štítné žlázy má vliv na kostní metabolismus zejména neléčená hypertyreóza a supresní léčba tyroxinem u pacientek s karcinomem štítné žlázy. Přiměřeně substituovaná hypotyreóza k osteoporóze nevede.
U pacientů s neléčenou hypertyreózou dochází ke zvýšení kostního obratu, laboratorně bývají zvýšeny kalcemie a kalciurie, suprese PTH, nižší hladiny vitamínu D3, zvyšuje se hladina markerů kostního obratu.3
Exogenní podávání supresních dávek L-tyroxinu k potlačení tyreostimulačního hormonu (TSH) se používá s cílem zamezit progresi nebo rekurenci karcinomu štítné žlázy. Rizikové jsou zejména pacientky v menopauze a postmenopauzální pacientky užívající supresní dávky L-tyroxinu. U těchto pacientek přetrvává riziko vzniku osteoporózy ještě dlouhou dobu po zklidnění toxikózy.3
Léčba sekundární osteoporózy spojené s onemocněním štítné žlázy se zaměřuje na řešení základního onemocnění a podpůrnou farmakologickou a doplňkovou terapii. Pro zlepšení BMD je nejdůležitější optimalizovat funkci štítné žlázy, současně je nutné zajistit dostatečný příjem vápníku a vitamínu D3 ideálně formou suplementace pomocí léčivých přípravků s fixní kombinací. Zejména v případech postmenopauzálních pacientek, kdy je vysoké riziko fraktur, je nutná antiresorpční léčba OP (bisfosfonáty nebo denosumabem) a současná suplementace vápníku a vitamínu D3.
Deficit růstového hormonu je asociován s poklesem kostní minerální denzity (BMD). Dospělí pacienti s deficitem růstového hormonu mají snížený kostní obrat a kost je mírně rezistentní na účinek parathormonu. Typický je obraz nízkoobratové osteoporózy (osteoklasty pracují intenzivněji nebo rychleji, než jsou osteoblasty schopny obnovovat kostní tkáň) přednostně v oblasti kortikální kosti. Negativní účinek na kostní denzitu se potencuje, pokud je současně při deficitu růstového hormonu přítomen deficit jiných hormonů hypofýzy – zejména gonadotropinů.
Deficit růstového hormonu způsobuje sekundární osteoporózu, která se léčí především substituční terapií růstovým hormonem. Jako podpůrná léčba se doporučuje opět suplementace vápníku a vitamínu D3.
Akromegalie je onemocnění charakterizované nadprodukcí růstového hormonu, za kterou je v 99 % případů zodpovědný nezhoubný adenom hypofýzy. Pro nadbytek růstového hormonu je typický vysoký kostní obrat s převahou osteoresorpce. Údaje o vzniku osteoporózy u pacientů s akromegalií jsou ale kontroverzní.3
Diabetes mellitus 1. i 2. typu (DM1T, DM2T) je obecně asociován s vyšším rizikem vzniku osteoporotických kostních fraktur (zejména bederních a vertebrálních fraktur). U DM1T hraje hlavní roli deficit inzulinu, který má anabolický účinek na kost, dále sdružené autoimunity a chronické komplikace diabetu.
DM2T většinou neprovází celkový úbytek kostní hmoty, bývá však patrná porucha mikroarchitektury kosti. Většina studií zabývajících se souvislostí mezi diabetem a poruchami metabolismu kostní tkáně dospěla k závěru, že většina diabetiků s DM2T má normální BMD, ale zároveň je v této skupině vyšší výskyt fraktur, které svým charakterem odpovídají osteoporotickým zlomeninám. Jde obvykle o fraktury proximálního femuru nebo kompresivní fraktury obratlů.
Mnohé studie hovoří o změnách v markerech kostního obratu, jako i v humorálním působení faktorů a látek produkovaných tukovou tkání. K osteoporóze u diabetiků přispívá kromě špatné glykemické kompenzace také léčba glitazony, diabetická nefropatie a nedostatek vitamínu D. Pro zvýšený výskyt fraktur hraje také zvýšené riziko pádů způsobené poruchou rovnováhy asociovanou s hypoglykemií a diabetickou neuropatií.3,9
Vzhledem k tomu, že u pacientů s DM2T většinou nedochází k celkovému úbytku kostní hmoty, chybí nám tedy základní diagnostický ukazatel pro stanovení osteopenie či osteoporózy. Dá se ale předpokládat, že snížená koncentrace inzulinu může být považována za nezávislý prediktor zvýšeného rizika fraktur.
V rámci preventivních opatření pro vznik osteoporotických fraktur je nejdůležitější korekce glykemické kompenzace, změna životního stylu včetně odstranění dalších rizikových faktorů (kouření, alkohol) a preventivní podávání vápníku současně s vitamínem D3.
Doporučený celkový příjem vápníku u postmenopauzálních žen by měl být mezi 1 000–1 500 mg denně, a i když je preferován fyziologický příjem z potravy (mléčné výrobky atp.), klinická data ukazují, že větší část této denní dávky je nutné suplementovat. Doporučená denní dávka vitamínu D je 800–2 000 IU, obézní pacienti vyžadují vyšší dávky, až 4 000 IU denně. Preferovanou formou vitamínu D je vitamín D3 – cholekalciferol.10 Na základě aktuálních dostupných možností na českém trhu preferujeme pro suplementaci opět registrované léčivé přípravky s fixní kombinací vápníku a vitamínu D3, které mají oproti potravinovým doplňkům prokázaný účinek. V případě potřeby vyšší dávky vitamínu D3 lze vitamín D3 – cholekalciferol – přidat např. ve formě kapek.
Nízké hladiny testosteronu vedou ke snížení minerální hustoty kostí, a tím zvyšují riziko zlomenin a osteoporózy, zejména u starších mužů. Příčinou primárního hypogonadismu je testikulární dysfunkce, zatímco příčinou sekundárního hypogonadismu jsou poruchy a změny v oblasti funkce hypotalamu anebo hypofýzy.
Vliv testosteronu na kost může být dvojí – přímo působením molekuly testosteronu, resp. jejího aktivního metabolitu dihydrotestosteronu prostřednictvím androgenových receptorů, nebo konverzí testosteronu na estradiol pomocí enzymu aromatázy a následným účinkem estradiolu v cílových tkáních (kostech) pomocí estrogenových receptorů.11 Testosteron ve studiích in vitro zvyšoval proliferaci a snižoval apoptózu osteoblastů, zabraňoval kostní resorpci indukované parathormonem a tyroxinem a tvorbě osteoresorpčních stimulátorů interleukinu 1 (IL-1) a IL-6. Testosteron i estradiol jsou důležité pro zachování optimální BMD u mužů. Pozitivní účinek testosteronu na kost je potencován i jeho pozitivním vlivem na svalovou hmotu a celkovou sílu, a tím i na snížení rizika pádů.3
Podávání testosteronu hypogonadickým mužům signifikantně zvyšuje jejich BMD.12 Osteoporóza je také důležitou komplikací androgen-deprivační terapie (ADT) při léčbě karcinomu prostaty. Bilaterální orchiektomie a léčba agonisty GnRH snižují kostní denzitu a zvyšují riziko vzniku osteoporotické fraktury.13
Léčba osteoporózy způsobené hypogonadismem zahrnuje kromě úpravy životního stylu a kauzální léčby hypogonadismu také farmakologickou léčbu (bisfosfonáty, teriparatidem nebo denosumabem) současně se suplementací vápníku a vitamínu D3.
Mezi další významné příčiny sekundární osteoporózy patří dlouhodobá léčba glukokortikoidy. Osteoporóza indukovaná glukokortikoidy (GIOP) je v současnosti považována ze nejčastější a nejzávažnější formu sekundární osteoporózy. Glukokortikoidy patří ke skupinám nejčastěji předepisovaných léčiv, především kvůli protizánětlivému a imunosupresivnímu efektu. Nejčastějšími indikacemi pro podávání glukokortikoidů jsou respirační, muskuloskeletální a kožní onemocnění.6,7
Nežádoucím účinkem léčby glukokortikoidy je, že dochází ke změně kvality kostní tkáně a její mikroarchitektury. Pokles BMD je obvykle rychlý a projeví se již během prvních týdnů léčby. Více než 50 % pacientů léčených glukokortikoidy po dobu delší než 3 měsíce zrychleně ztrácí kostní hmotu, v pozdějším období se úbytek zpomalí. Riziko vzniku fraktur při léčbě glukokortikoidy je ale výrazně vyšší, než by odpovídalo poklesu BMD, a objevuje se dříve než pokles BMD. Riziko vzniku fraktur stoupá s podávanou dávkou glukokortikoidů.3,7 Za rizikovou dávku glukokortikoidů se považuje dávka ≥ 5 mg prednisonu za den.3
Incidence osteoporotických fraktur u pacientů dlouhodobě léčených glukokortikoidy je 30–50 %. Zlomeniny se objevují za 3 až 6 měsíců od zahájení léčby. Preferenčně bývá postižena trabekulární kost, ve které je efekt glukokortikoidů výraznější.8 Závažnost kostní ztráty při léčbě glukokortikoidy závisí na podávané dávce a době trvání léčby. Při vysazení léčby může dojít k relativní reverzibilitě kostních změn.
V případě diagnostiky GIOP je třeba klasické diagnostické postupy (klinické vyšetření, měření BMD metodou DXA, laboratorní markery) doplnit minimálně vyšetřením svalové síly pacienta, z důvodu vyššího rizika vzniku fraktur v případě pádů. Laboratorní vyšetření by mělo zahrnovat širší spektrum biochemických hodnot dle individuálního stavu pacienta (koncentrace pohlavních hormonů, PTH, vitamínu D [25-hydroxyvitamínu D], TSH apod.). BMD má být změřena vždy před zahájením terapie glukokortikoidy a znovu nejpozději po 6 měsících léčby.7
Léčba sekundární osteoporózy vyvolané glukokortikoidy spočívá v řešení základního onemocnění a dále v prevenci a léčbě GIOP pomocí léků (zejména bisfosfonátů a teriparatidu), současně se suplementací vápníku a vitamínu D3 a úpravou životního stylu pacienta, zejména eliminace kouření, alkoholu. Včasné zahájení léčby GIOP je klíčové, protože riziko zlomenin je vysoké už na začátku léčby glukokortikoidy. Terapie GIOP má být zahájena již při hodnotách T-skóre –1,5 a nižších. Co se týče suplementace vápníku a vitamínu D, obvyklými terapeutickými dávkami jsou 1 000–1 200 mg vápníku a 800 IU vitamínu D3 denně.3,7
V rámci diferenciální diagnostiky osteoporózy je třeba především u pacientů mužského pohlaví a mladších pacientek myslet také na sekundární osteoporózu způsobenou endokrinními poruchami. Pokud je to možné, zaměřuje se léčba na odstranění primární příčiny osteoporózy. Suplementace vápníku a vitamínu D3 je důležitou součástí léčby většiny nejčastějších endokrinologických diagnóz (primární hyperparatyreóza, onemocnění štítné žlázy, poruchy tvorby růstového hormonu, diabetes mellitus, hypogonadismus a další) a je vhodné ji nasadit co nejdříve. Další významnou příčinu sekundární osteoporózy představuje dlouhodobá léčba kortikosteroidy. I zde má suplementace vápníku a vitamínu D3 své nezanedbatelné místo.
V rámci suplementace jsou preferovány registrované léčivé přípravky s prokázaným účinkem oproti potravinovým doplňkům, u kterých není výrobce před uvedením na trh povinen ověřovat účinnost klinickými studiemi. Jako nejvýhodnější se jeví suplementace registrovanými léčivými přípravky s fixní kombinací vápníku a vitamínu D3 v celkové denní dávce 1 000 mg vápníku a 800 IU vitamínu D3, které jsou rozděleny ideálně do dvou denních dávek z důvodu lepší vstřebatelnosti vápníku. Zároveň je vhodné, aby pacienti upravili svůj jídelníček a přijímali více vápníku ze stravy. V případě nutnosti suplementace vyšší denní dávky vitamínu D3, zejména u obézních pacientů s diabetes mellitus, přidáváme vitamín D3 (cholekalciferol) ideálně formou kapek.
Vzhledem k široké nabídce na trhu lze výběr lékové formy suplementace vápníku a vitamínu D3 přizpůsobit potřebám jednotlivých pacientů. Vzhledem k tomu, že pacienti s osteoporózou jsou převážně starší, polymorbidní, užívající velké množství léků, jeví se jako výhodné lékové formy, které se nepolykají, jako např. žvýkací tablety snadno rozpustné v ústech. Výhodné je, pokud má léčivý přípravek více příchutí, jejichž střídání má pozitivní vliv na adherenci pacienta k této podpůrné léčbě.
Literatura
Osteoporóza je systémové onemocnění skeletu charakterizované úbytkem kostní hmoty a poruchami mikroarchitektury kostní tkáně, jehož důsledkem je…
Osteoporóza je progredující systémové onemocnění skeletu charakterizované ztrátou kostní hmoty a narušením kostní mikroarchitektury. Důsledkem je…
Česká republika patřila v rámci Evropské unie mezi země s několika nepříznivými charakteristikami týkajícími se osteoporózy. Měla a má vysokou…
Koncentrace vápníku v krevním séru (plazmě) není dostatečným ukazatelem metabolických procesů organismu, do kterých je kalcium zapojeno. Množství…