Biohybridní mikroroboti – možná budoucnost cílené léčby karcinomů
Vědci z Institutu Maxe Plancka představili novou studii, ve které popisují způsob a potenciál přidávání umělých komponent k bakteriím. Biohybridní mikroroboti by se mohli stát účinnými systémy pro cílenou aplikaci léků proti zhoubným nádorům.
Tým vědců z Oddělení fyzické inteligence při Institutu Maxe Plancka pro inteligentní systémy ve Stuttgartu zkonstruoval biohybridní mikroroboty tím, že vybavil bakterie E. coli umělými komponenty. Takto inovativní způsob podávání léků by jednoho dne mohl nabídnout vysoce cílenou a účinnou možnost léčby onkologických onemocnění.
Studie byla publikována v Science Advances. O práci píše European Pharmaceutical Review.
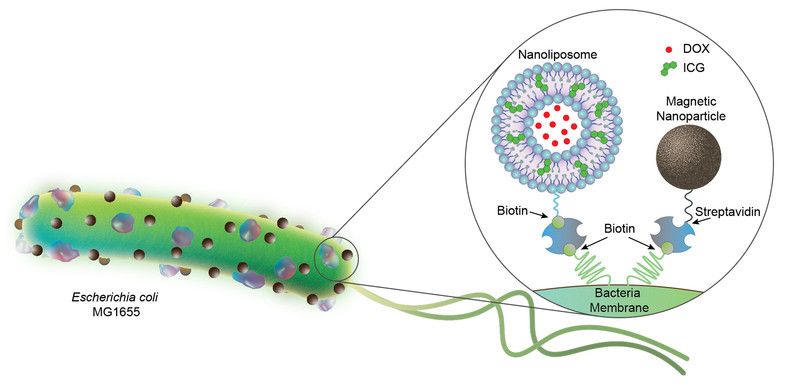
Vědci nejprve ke každé bakterii připojili několik nanolipozomů (viz obrázek) obsahujících ICG (indocyanine green, pozn. red.). Při osvětlení blízkým infračerveným světlem ICG taje, což umožňuje uvolnění potřebné dávky léčiva – chemoterapeutika doxorubicinu (DOX) – z nitra vodného jádra nanolipozomů.
Dále vědci připojili magnetické nanočástice, které při vystavení magnetickému poli pomáhají kontrolovat pohyb bakterií. „Lanem“, které váže lipozomy a magnetické částice k bakterii, je velmi stabilní komplex streptavidinu a biotinu, který byl vyvinut teprve před několika lety.
Určité vlastnosti bakterie E. coli z ní podle vědců činí žádoucí platformu pro podávání léků proti onkologickým onemocněním. Jsou to rychlí a všestranní plavci, kteří se umějí pohybovat v různém prostředí – od kapalin až po vysoce viskózní tkáně. Jsou také velmi citlivé, se sklonem být přitahovány chemickými gradienty, jako jsou nízké koncentrace kyslíku či vysoká kyselost – oboje převládá v blízkosti nádorové tkáně.
Samotná léčba vstříknutím bakterií v těsné blízkosti nádoru, která bakteriím umožní růst, a aktivovat tak místní imunitní odpověď, je známá více než století. Vybavení bakterií dalšími komponenty by mohlo účinnost této léčby zvýšit. Přidání těchto složek však není snadné, protože hustota roztoku ovlivňuje ředění. Tým ve Stuttgartu byl ale úspěšný a vybavil 86 ze 100 bakterií jak lipozomy, tak magnetickými částicemi.
Ve své studii vědci také prokázali, že mohou zvenčí směrovat roztok o vysoké hustotě. Za prvé, úzký kanál ve tvaru L se dvěma oddíly na každém konci, s jedním nádorovým sféroidem v každém z nich. Za druhé, ještě užší uspořádání připomínající drobné krevní cévy. Na jednu stranu vědci přidali další permanentní magnet a ukázali, jak přesně dokáží navést mikroroboty obsahující léky směrem k nádorovým sféroidům.
Nakonec tým navedl mikroroboty přes viskózní kolagenový gel (simulující nádorovou tkáň) se třemi úrovněmi tuhosti a pórovitosti – od měkké přes střední až po tuhou. Čím je kolagen tužší, čím pevnější je síť proteinových řetězců, tím obtížnější je pro bakterie najít cestu skrz matrici. Tým ukázal, že jakmile přidají magnetické pole, bakterie se dokáží dostat až na druhý konec gelu.
Jakmile se mikroroboti sešikují v požadovaném bodě (nádorový sféroid), blízký infračervený laser generuje paprsky s teplotou až 55 °C, spouští tání ICG a nanolipozomů, což vede k uvolňování léčiv. Kyselé prostředí s nízkým pH také způsobuje, že se nanolipozomy otevírají, což umožňuje automatické uvolňování léků v blízkosti nádoru.
Zdroj: European Pharmaceutical Review