Nová farmaceutická legislativa slibuje dostupnější léky

Evropská komise představila dlouho očekávaný návrh revize evropské farmaceutické legislativy. Má se jednat o největší reformní změnu v této oblasti za posledních dvacet let. Jejím cílem není jen zvýšení místní a cenové dostupnosti léčivých přípravků pro všechny občany Evropské unie, ale také posílení vývoje inovativních léků a konkurenceschopnosti Evropy na globálním trhu s léky. Legislativní návrhy budou nyní předloženy Evropskému parlamentu a Radě. Ozývá se však i první kritika zainteresovaných stran.
Stávající farmaceutická legislativa je již obsoletní, její reforma přichází po dlouhých letech a je tak trošku vynucenou reakcí na současné problémy, které se projevují nejen snižujícím se podílem Evropy na globální produkci inovativních léčiv, ale také relativně pomalým a nerovným přístupem pacientů k nejmodernějším lékům v rámci jednotlivých zemí Evropské unie. Podle dat nedávno prezentovaných Evropskou federací farmaceutického průmyslu a asociací (EFPIA) v Evropě v současnosti vzniká pouze 22 procent z celkového objemu inovativních léčiv, což vynikne především v kontrastu se Spojenými státy americkými, kde je to 48 procent. Značné mezery máme dle Evropské komise jak v řešení nenaplněných zdravotních potřeb, vzácných onemocnění, tak i v boji proti antimikrobiální rezistenci, kterou se Evropská komise v rámci této legislativy také zabývá. Vysoké ceny inovativních léčiv a nedostatek léků jsou přetrvávajícím problémem jak pro evropské pacienty, tak pro jednotlivé systémy zdravotní péče. Pokud má Evropa i nadále zůstat atraktivním místem pro investice a udržet si pozici jednoho z leaderů ve vývoji léčiv, musí podle Evropské komise přizpůsobit svá pravidla digitální transformaci a novým technologiím a v souladu s názorem farmaceutických firem také omezit byrokracii a celkově zjednodušit postupy provázející vývoj, schvalovací procesy a uvádění nových léků na trh. Nová pravidla by dle Evropské komise také měla respektovat dopady výroby léků na životní prostředí. „Dnes k naší Evropské zdravotnické unii přidáváme další ústřední pilíř. Předkládáme návrhy, abychom zajistili, že se léky k pacientům po celé Evropě dostanou včas a spravedlivě. Je to reforma, která zajišťuje, že Evropa zůstane atraktivní pro podnikání a náš farmaceutický průmysl bude globální inovační velmoc. Vybudování jednotného trhu s léky je nutností jak pro naše občany, tak pro naše společnosti,“ komentovala představení návrhů komisařka pro zdraví a bezpečnost potravin Stella Kyriakidesová.
Hlavní cíle revize lékové legislativy
Představený návrh revize farmaceutické legislativy vychází z Farmaceutické strategie pro Evropu, kterou představila Evropská komise již v listopadu 2020. Jejím cílem bylo vytvoření takového farmaceutického prostředí, které bude odolné vůči krizi, bude silně orientováno na pacienta a farmaceutický průmysl Evropské unie bude mít dostatek prostoru pro inovace, díky čemuž bude konkurenceschopný v rámci globálního trhu. Reforma legislativy zahrnuje návrhy nových směrnic a nařízení, které revidují stávající právní předpisy, a to včetně právních předpisů o pediatrických lécích a lécích na vzácná onemocnění.
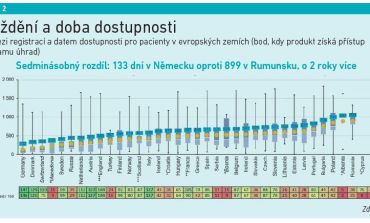
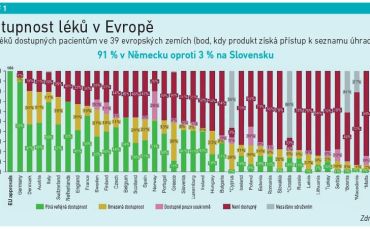 Nová pravidla by měla napomoci vytvořit jednotný trh s léky, který podle Evropské komise zajistí, že všichni pacienti v celé Evropské unii budou mít včasný, spravedlivý a cenově dostupný přístup k bezpečným a účinným lékům. V oblasti výzkumu a vývoje léků by měl vzniknout celý nový „ekosystém“, který bude pro firmy v Evropě atraktivní a bude podporovat inovace. Tomu by mělo napomoci také výrazné snížení administrativní zátěže a urychlení procesu schvalování nových léků, které se pak také dostanou rychleji k pacientům. Nová legislativa má řešit i obrovskou nerovnost, která panuje v dostupnosti léků v rámci jednotlivých zemí Evropské unie. Léky by měly být nadále dostupné pro pacienty bez ohledu na to, kde žijí. Současné rozdíly v dostupnosti v jednotlivých zemích znázorňují grafy 1 a 2. Návrhy nové legislativy reflektují také boj s antimikrobiální rezistencí či udržitelnost z pohledu životního prostředí.
Nová pravidla by měla napomoci vytvořit jednotný trh s léky, který podle Evropské komise zajistí, že všichni pacienti v celé Evropské unii budou mít včasný, spravedlivý a cenově dostupný přístup k bezpečným a účinným lékům. V oblasti výzkumu a vývoje léků by měl vzniknout celý nový „ekosystém“, který bude pro firmy v Evropě atraktivní a bude podporovat inovace. Tomu by mělo napomoci také výrazné snížení administrativní zátěže a urychlení procesu schvalování nových léků, které se pak také dostanou rychleji k pacientům. Nová legislativa má řešit i obrovskou nerovnost, která panuje v dostupnosti léků v rámci jednotlivých zemí Evropské unie. Léky by měly být nadále dostupné pro pacienty bez ohledu na to, kde žijí. Současné rozdíly v dostupnosti v jednotlivých zemích znázorňují grafy 1 a 2. Návrhy nové legislativy reflektují také boj s antimikrobiální rezistencí či udržitelnost z pohledu životního prostředí.
Jak dostat léky včas ke všem pacientům?
 Mezi klíčové prvky návrhu patří podle Evropské komise například nové pobídky, které by měly motivovat farmaceutické společnosti, aby zpřístupnily své léky všem pacientům Evropské unie a zaměřily se zejména na vývoj produktů, které řeší nenaplněné zdravotní potřeby. Pacientům by také měly být dříve dostupné generické a biosimilární léčivé přípravky a zjednodušeny postupy jejich registrace. „Jedním z opatření je zkrácení délky exkluzivity nových molekul z nynějších osmi let na šest let v případě, že výrobce nedodá inovativní léčivo na všechny trhy v Evropské unii. Nyní tato osmiletá ochrana exkluzivního přístupu na trh takovou podmínku nemá, což podle Evropské komise vede k tomu, že výrobci nejsou motivováni k dodávkám léků všem pacientům v Evropské unii a na některé menší trhy začnou dodávat s několikaletým zpožděním,“ vysvětluje Česká asociace farmaceutických firem (ČAFF) v reakci na oznámení revize lékové legislativy s tím, že současná osmiletá ochranná lhůta, která platí v Evropě, je nejdelší na světě. Podle návrhu by však mohly farmaceutické firmy získat oproti současným 11 letům o rok delší dodatečnou ochranu nového léku. Až 12 let by byl lék „chráněn“, pokud by byl určen k terapii onemocnění, které dosud nebylo účinně léčitelné, nebo v případě, že jsou prováděny srovnávací studie, jež usnadní i srovnávání nákladové efektivity léků, nebo pokud je vyvinuta nová terapeutická indikace. „Záměr Komise byl jednoduchý – motivovat farmaceutický průmysl k tomu, aby soustředil výzkum a vývoj na dosud neuspokojené potřeby medicíny a zároveň aby společnosti dodávaly lék na celý unijní trh. Komise ale nijak neřeší ceny léků a zařazování léků do národních systémů zdravotního pojištění. A tam je kámen úrazu. Firma může sebevíce chtít uvést lék na některý trh, ale pokud v menších státech s přísnými úhradovými pravidly není ochota regulačních autorit a zdravotních pojišťoven lék do systému vpustit, protože by jej musely pojištěncům hradit, na což nemají dost peněz, situace nemá řešení,“ poznamenal výkonný ředitel ČAFF Filip Vrubel.
Mezi klíčové prvky návrhu patří podle Evropské komise například nové pobídky, které by měly motivovat farmaceutické společnosti, aby zpřístupnily své léky všem pacientům Evropské unie a zaměřily se zejména na vývoj produktů, které řeší nenaplněné zdravotní potřeby. Pacientům by také měly být dříve dostupné generické a biosimilární léčivé přípravky a zjednodušeny postupy jejich registrace. „Jedním z opatření je zkrácení délky exkluzivity nových molekul z nynějších osmi let na šest let v případě, že výrobce nedodá inovativní léčivo na všechny trhy v Evropské unii. Nyní tato osmiletá ochrana exkluzivního přístupu na trh takovou podmínku nemá, což podle Evropské komise vede k tomu, že výrobci nejsou motivováni k dodávkám léků všem pacientům v Evropské unii a na některé menší trhy začnou dodávat s několikaletým zpožděním,“ vysvětluje Česká asociace farmaceutických firem (ČAFF) v reakci na oznámení revize lékové legislativy s tím, že současná osmiletá ochranná lhůta, která platí v Evropě, je nejdelší na světě. Podle návrhu by však mohly farmaceutické firmy získat oproti současným 11 letům o rok delší dodatečnou ochranu nového léku. Až 12 let by byl lék „chráněn“, pokud by byl určen k terapii onemocnění, které dosud nebylo účinně léčitelné, nebo v případě, že jsou prováděny srovnávací studie, jež usnadní i srovnávání nákladové efektivity léků, nebo pokud je vyvinuta nová terapeutická indikace. „Záměr Komise byl jednoduchý – motivovat farmaceutický průmysl k tomu, aby soustředil výzkum a vývoj na dosud neuspokojené potřeby medicíny a zároveň aby společnosti dodávaly lék na celý unijní trh. Komise ale nijak neřeší ceny léků a zařazování léků do národních systémů zdravotního pojištění. A tam je kámen úrazu. Firma může sebevíce chtít uvést lék na některý trh, ale pokud v menších státech s přísnými úhradovými pravidly není ochota regulačních autorit a zdravotních pojišťoven lék do systému vpustit, protože by jej musely pojištěncům hradit, na což nemají dost peněz, situace nemá řešení,“ poznamenal výkonný ředitel ČAFF Filip Vrubel.
Zjednodušení regulace
Evropská komise chce podpořit inovace a konkurenceschopnost tím, že celý regulační rámec zjednoduší a vytvoří prostředí přátelské k inovacím a vývoji nových léčiv. „Evropská léková agentura poskytne lepší včasnou regulační a vědeckou podporu vývojářům slibných léčiv, aby usnadnila rychlé schválení, a pomohla tak malým a středním podnikům a neziskovým vývojářům,“ uvedla ve zprávě Evropská komise. Zrychlit by se mělo i vědecké hodnocení a povolování léčiv. V současné době trvá schválení léku v průměru 400 dní, nové schvalovací postupy EMA počítají se 180 dny. Celková regulační zátěž by se měla díky zjednodušení postupů a digitalizaci významně snížit, a to při zachování nejvyšších standardů kvality, účinnosti a bezpečnosti léčiv.
Návrhy pod palbou kritiky
Novelizace evropské lékové legislativy je podle zainteresovaných stran jedním z nejdůležitějších evropských zdravotnických témat za posledních dvacet let. Její finální schválení se však může ještě notně zkomplikovat, a to i kvůli výhradám, které se po jejím zveřejnění objevily v odborných kruzích, a s ohledem na skutečnost, že Evropu čekají v blízké době volby, a tedy i obměna Evropského parlamentu. „Komise přichází s návrhem nového lékového práva se zpožděním. Ambiciózní plány se promítly do mnoha zcela nových opatření, z nichž některá jsou předmětem kritiky napříč zainteresovanými stranami. Je tak otázkou, zda se podaří text finálně schválit ještě před příštími volbami do Evropského parlamentu, které jsou už za rok. V opačném případě se vše může ještě více zdržet,“ říká k návrhu Filip Vrubel, který zastupuje výrobce generických a biosimilárních léčiv. Výrobci generik sice vnímají novelizaci lékových předpisů jako krok kupředu, v určitých ohledech jsou ale poměrně skeptičtí. „Zkrácení ochrany originálního přípravku o dva roky se nemusí vůbec projevit na dřívějším vstupu levnějších generik na trh, pokud se nevyřeší umělé prodlužování patentové ochrany,“ domnívá se předseda představenstva ČAFF a ředitel společnosti Sandoz Jiří Hanzlík. „Pokud si firma v době, kdy už originální lék dodává na trh, zapíše nějaký nový patent související s daným produktem, jeho výrobou nebo specifickým složením, může tím zabránit vstupu generika na další roky. A i když se následně u soudu prokáže, že takový patent neobstojí, po celou dobu trvání soudu není možné generikum uvádět na trh, což poškozuje nejen generickou firmu, ale i pacienty a rozpočty zdravotních pojišťoven,“ dodává Hanzlík.
Kritičtí k pasážím upravujícím ochranné lhůty jsou ovšem také zástupci inovativního farmaceutického průmyslu. Podle výkonného ředitele Asociace inovativního farmaceutického průmyslu (AIFP) Davida Koláře přináší novelizace řadu vítaných změn, jako třeba zefektivnění regulačního rámce, zrychlení rozhodovacího procesu při vstupu nových léků či boj proti antimikrobiální rezistenci. Inovacím však prý nenahrává tak, jak si tvůrci návrhů představovali. „Obsahuje výrazné oslabení evropských inovačně‑výzkumných aktivit, jejichž posílení mělo být jedním z původních záměrů novelizace. Zároveň návrh stále nedostatečně řeší dostupnost léčiv pro evropské pacienty. Dovolím si uvést dva příklady. Prvním z nich je de facto zkrácení nástrojů ochrany duševního vlastnictví inovativních léčivých přípravků o dva roky. Ochrana práv duševního vlastnictví je jediným mechanismem, jenž umožňuje návratnost investic do inovací. Nedokážu si představit scénář, ve kterém by její zúžení vedlo k zamýšlenému cíli, tj. ke zvýšení atraktivity Evropy z pohledu inovací,“ míní Kolář, podle kterého tento krok naopak snižuje konkurenceschopnost Evropy vůči ostatním státům. Oslabení ochrany duševního vlastnictví povede podle výkonného ředitele AIFP ke zpomalení investičních aktivit v Evropské unii a prohloubení problémů, se kterými se Evropa potýká na globalizovaném trhu. AIFP se pak nezamlouvá ani skutečnost, že by prodloužení ochrany duševního vlastnictví nového léku mělo být podmíněno uvedením ve všech 27 členských státech do dvou let od jeho registrace. „S ohledem na rozdílné zdravotní systémy, a tedy i rozdílný přístup ke stanovení cen a úhrad v zemích EU je tento požadavek a priori nesplnitelný. O vstupu léčivého přípravku na konkrétní evropské trhy rozhodují jednotlivé národní státy. Zlepšení dostupnosti léčiv pro pacienty tímto nástrojem je iluzorní,“ argumentuje David Kolář s tím, že navrhovaná novelizace předpisů nenabízí dostatečnou podporu inovativnímu průmyslu. „Domnívám se, že revize farmaceutických právních předpisů a patentového balíčku by měla odpovídat potřebám pacientů, realitě evropských zdravotních systémů a přinést potřebnou podporu evropského inovačního prostředí. Od tohoto stavu jsme ale v tuto chvíli velmi daleko,“ uzavírá.