Aktuální postavení digitálních terapeutik v moderní medicíně
Společně s rozvojem digitálních technologií a v důsledku nedávné pandemie se zvyšuje dostupnost a využití „vzdálených“ terapeutických možností v moderní medicíně. Digitální terapeutika (DTx) představují jednu z nabízených alternativ, přestože je jejich použití omezováno nedostatkem konsenzu v definicích, ve výzkumu a vývoji, limity v klinických studiích, standardizací regulačních a kvalitativních požadavků. Tento článek se zabývá definicí DTx, klinickými studiemi věnovanými problematice DTx a regulačními požadavky na jejich používání, opírá se při tom o publikovanou literaturu, screening webu ClinicalTrials.gov a o zdroje z webových stránek regulačních a soukromých organizací několika zemí. Závěrem lze shrnout, že pro úspěšné vyřešení dané problematiky by měla být posílena validace evidence based požadavků a měl by být vybudován systém spolupráce mezi výzkumníky, výrobci a regulátory s cílem vytvořit ucelené a nejlépe sjednocené parametry pro užití DTx v praxi.
Nové digitální produkty
S nástupem nových informačních technologií byla navržena řada zdravotních aplikací využívajících osobní chytrá zařízení, což předznamenalo změnu paradigmatu ve zdravotnictví. Tyto technologie, především ve formě aplikací, jsou určeny k podpoře lékařských postupů a k podpoře zdraví v prevenci a managementu onemocnění. S rostoucím objemem dat souvisejících se zdravím se pacienti, ale také poskytovatelé zdravotních služeb přesouvají od tzv. wellness produktů, které postrádají prokázanou klinickou účinnost, k tzv. digitálním terapeutikům (DTx), jež musejí prokázat účinnost v prevenci, zvládání nebo léčbě nemoci. De facto to znamená, že digitální technologie mohou doplnit, nebo dokonce nahradit tradiční léčebné postupy.3
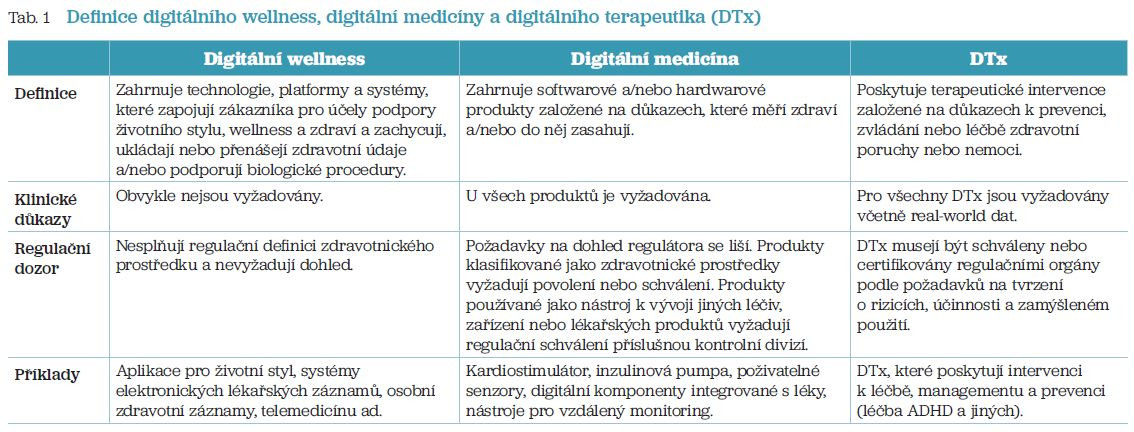 Problematika DTx představuje podkategorii digitální medicíny a spadá pod širší klasifikaci „digitálního zdraví“. Produkty digitálního wellness, digitální medicíny a DTx vyžadují různé úrovně evidence based dokladů o efektivitě a regulačním dohledu vzhledem k odlišným nárokům na jejich využití a vzhledem k jejich rizikovosti. Základní rozdíly mezi jednotlivými typy aplikací uvádí tabulka 1. DTx je možné předepsat (PDTx) a na rozdíl od wellness aplikací se musejí prokázat klinickými důkazy ve specifické indikaci. Tento text se pokusí přinést krátké shrnutí o aktuálním postavení DTx v moderní medicíně.6
Problematika DTx představuje podkategorii digitální medicíny a spadá pod širší klasifikaci „digitálního zdraví“. Produkty digitálního wellness, digitální medicíny a DTx vyžadují různé úrovně evidence based dokladů o efektivitě a regulačním dohledu vzhledem k odlišným nárokům na jejich využití a vzhledem k jejich rizikovosti. Základní rozdíly mezi jednotlivými typy aplikací uvádí tabulka 1. DTx je možné předepsat (PDTx) a na rozdíl od wellness aplikací se musejí prokázat klinickými důkazy ve specifické indikaci. Tento text se pokusí přinést krátké shrnutí o aktuálním postavení DTx v moderní medicíně.6
Definice digitálních terapeutik
V roce 2015 Sepah a kol. zavedli termín „digitální terapeutika“ (DTx) ve významu behaviorální, na důkazech založená léčba, která je poskytována online a která může zlepšit dostupnost a účinnost zdravotní péče.7 Digital Therapeutics Alliance (DTA), přední organizace zabývající se definováním a šířením DTx, definovala technologie jako evidence based terapeutické intervence, které využívají softwarové programy k léčbě, managementu nebo prevenci nemocí.2 Zde však neexistuje jasný mezinárodní konsenzus ohledně definice a tento termín je v různých zemích vykládán nebo používán odlišně. Jižní Korea je jedinou zemí, která poskytla definici DTx jakožto „softwaru sloužícího jako zdravotnický prostředek, který poskytuje pacientům terapeutickou intervenci založenou na důkazech k prevenci, zvládání nebo léčbě zdravotní poruchy nebo nemoci“. V jiných zemích, jako jsou Spojené státy americké, Německo, Velká Británie, Japonsko, Austrálie, Čína a Francie, nejsou DTx definovány na vládní úrovni a jsou obecně považovány za zdravotnické prostředky.2
Zatímco termín DTx je omezen na aplikaci, která prokázala klinické výsledky v léčbě, zvládání nebo prevenci nemocí nebo poruch a je podobný významu softwaru jako zdravotnického prostředku (SaMD) v tom, že oba odkazují na software používaný pro lékařské účely, SaMD je obecný termín pro software určený k použití pro jeden nebo více lékařských účelů. Většina veřejných nebo regulačních úřadů však považuje DTx za podkategorii SaMD bez bližší specifikace. Obsah je přitom základním prvkem DTx a jeho přidanou hodnotou. Mívá různé formy od dotazníků, osobního monitoringu přes hry po virtuální realitu. DTx hraje také důležitou roli při monitoringu terapeutického účinku, zvyšuje adherenci k léčbě a má potenciál zvýšit terapeutický účinek.5
Charakteristika digitálních terapeutik
Společným znakem konvenční farmakoterapie a digitálních terapeutik je prokázání klinické účinnosti v konkrétní indikaci a nutnost preskripce terapeutika. Od tohoto bodu se však charakteristiky značně liší. Vývoj, klinické studie, regulační schválení, distribuce, klinické využití a postmarketingové řízení jsou naprosto rozdílné. Na rozdíl od léčiv vyžadují DTx minimální náklady na vývoj (< 1 %) a doba vývoje je významně kratší. Navíc DTx nevyžadují dodatečné náklady nebo výrobní zařízení pro výrobu a distribuce je na rozdíl od léčiv velice jednoduchá, jelikož jsou pacientům doručena prostřednictvím vývojářů a poskytovatelů platforem.
Klinické studie pro DTx se liší od léčiv v tom, že pro ně nejsou potřeba klinické studie zahrnující bezpečnost a farmakokinetické hodnocení. Ve většině zemí mohou DTx získat marketingový souhlas prostřednictvím pilotních klinických studií skrze registraci zdravotnických prostředků. DTx poskytují softwarové intervence, a proto mají oproti léčivům méně nežádoucích účinků a vyšší míru adherence.
DTx je klasifikován jako PDTx, který vyžaduje předpis specialisty. Je zajímavé, že účinnost DTx je ovlivněna sociokulturními a kognitivními schopnostmi a vykazuje určité nevýhody, jako je nízká dostupnost kvůli digitální bariéře a problémům se zabezpečením dat. Přijetí intervence pacientem může ovlivnit určitá míra vzdělání a DTx lze využít pouze u pacientů s digitálním zařízením a neporušenou kognicí. Jelikož digitální terapeutické prostředky uchovávají uživatelská data, je nutné zde zmínit význam rizika úniku citlivých osobních údajů a předcházet mu preventivními opatřeními v oblasti kybernetické bezpečnosti. 4
Klinické studie s digitálními terapeutiky
Přestože se jedná o novinku, aktuálně podle portálu ClinicalTrials.gov probíhá celá řada klinických studií (randomised clinical trials, RCT) (k začátku března 2023 jich bylo 45), které zahrnovaly širokou škálu indikací, přičemž psychiatrie tvořila největší skupinu (31,1 %), následovaly neurologické indikace (22,2 %), endokrinologie (20 %), respirační indikace (11,2 %), otravy (8,9 %) a kardiovaskulární onemocnění (6,7 %). Současné studie ukazují, že neuropsychiatrická a chronická onemocnění představují většinu indikací, jako jsou Parkinsonova choroba, nádorová onemocnění, roztroušená skleróza, deprese, úzkost, bolesti zad, schizofrenie a další.
Pokud jde o regionální distribuci těchto RCT, nejvyšší počet byl zaznamenán v USA (60 %), dále ve Švýcarsku, Finsku, Jižní Koreji, Itálii, Brazílii, Malajsii a dalších zemích. Všechny studie jsou realizovány pouze v jednotlivých zemích. Výzkum prováděly různé instituce, včetně obchodních společností (53,3 %), farmaceutických společností (8,9 %), sedmi univerzit (15,6 %), čtyř nemocnic (8,9 %), tří výzkumných ústavů (6,7 %) a dvou lékařských konsorcií (4,4 %).9
Regulace digitálních terapeutik
Regulační prostředí pro DTx se značně liší podle regionu. Americký úřad pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) nastínil, že povolí distribuci a používání DTx za mimořádných okolností, protože nepovažuje tuto léčbu za rizikovou. Ministerstvo pro bezpečnost potravin a léčiv (MFDS) v Jižní Koreji zveřejnilo šest pokynů pro předpisy související s DTx, včetně pokynů k definování DTx a seznamu dokumentů požadovaných pro schválení DTx v korejském regulačním systému. Dále MFDS poskytlo metody hodnocení bezpečnosti a účinnosti pro DTx zaměřené na alkoholismus, depresivní poruchu, nespavost, závislosti na nikotinu a panickou poruchu a uvedlo příklady protokolů klinických studií s primárními cílovými body, velikostí vzorku a hypotézami pro každou indikaci.
I když mimo Koreu neexistují žádné specifické směrnice, řada DTx získala schválení od regulačních úřadů v USA, Evropě a Japonsku. Odborníci z oboru však navrhují vytvoření jednotného regulačního systému vhodného pro DTx, jelikož současné předpisy jsou považovány za nedostatečné a vágní. Také výzkumníci naléhají na vývoj mezinárodních regulačních modelů ke zlepšení bezpečnosti a kvality DTx.1
Na tomto místě je nutno vzpomenout na Evropu, kde jsou již definované modely vstupu na trh DTx v Německu (DiGA), Francii (Pecan) nebo Belgii (mHealthBelgium). Evropa je v tomto ohledu “napřed” a dokonce v Německu a Francii existuje model Fast‑track, kdy se DTx může dostat do veřejného zdravotního systému na zkrácenou dobu 12 měsíců, aby získalo dodatečná podpůrná data o účinnosti, pokud byl výrobce schopen doložit předběžná data a splnil všechny podmínky bezpečnosti.
Diskuse
Digitální terapeutické prostředky jsou regulovaná zdravotnická zařízení a představují unikátní typ zdravotnického prostředku odlišný od jiných. Regulační úřady jednotlivých zemí se řídí specifickou nomenklaturou zdravotnických prostředků k definování DTx, nicméně dosud neexistuje globálně žádná formální shoda mezi regulačními orgány. Definice DTx zahrnuje intervenci založenou na důkazech, a to na úrovni prevence, léčby a managementu chorob. DTx ale musejí splňovat také další specifické požadavky, včetně uživatelsky přívětivé dostupnosti, kvality a ochrany osobních údajů. Dosud však neexistuje jasná metodologie, která by tyto požadavky dokázala shrnout. Vzhledem k tomu, že DTx jsou primárně poskytovány prostřednictvím chytrých zařízení, mohou být úzce spojeny s každodenním životem uživatele a provádět nepřetržité aktivní zásahy. Vzhledem k těmto výhodám byly tyto prostředky vyvinuty převážně se záměrem zvládání chronických onemocnění, prevence zneužívání drog, zvládání spánku a léčby psychologických a psychiatrických onemocnění, jež vyžadují nepřetržitou interakci.
Klinické využití DTx se postupně rozšiřuje na onkologii, porodnictví, gynekologii, urologii, ortopedii, imunologii a do oblasti léčby infekčních onemocnění, nicméně literární rešerše ani přehled klinických studií nenaznačují společné rysy nových oblastí ve výzkumu a vývoji DTx. Sim a kol. předpověděli, že DTx budou přednostně zavedeny v oborech, ve kterých jsou možné kognitivně‑behaviorální intervence a kde poptávka zdaleka převyšuje nabídku.8
Pro zajištění terapeutického účinku DTx je klíčová angažovanost pacienta, která může být ovlivněna sociokulturním zázemím a demografickými charakteristikami. Tato skutečnost prozatím nebyla dostatečně empiricky prokázána, nicméně z několika příkladů praktického použití DTx lze usuzovat, že jeho dopad na pacienta se značně liší podle vnějších faktorů, jako jsou věk, úroveň vzdělání a výše příjmů.4
Dalším limitem v problematice DTx jsou RCT. Jedná se samozřejmě o nejlepší způsob hodnocení při určování důkazu, podle kterého se mohou výrobci a regulační orgány shodnout na validaci účinnosti a bezpečnosti zařízení. Velkou výzvou je však pro DTx v rámci RCT vytvoření vhodných kontrolních skupin. Design většiny RCT vyřešil tento problém jejich vynecháním, jelikož u softwaru lze velice těžko srovnávat efekt s placebem. Pouze se nabízí možnost srovnání se standardní nebo doporučenou léčbou včetně léčiv. S tím souvisí i problém s odstíněním vlivu léčby. Svým intervenčním principem DTx eliminují možnost zaslepení intervence, tudíž i zde se setkáváme s určitou „tolerancí“.
DTx jsou klasifikovány jako SaMD a schváleny stejným způsobem jako běžné zdravotnické prostředky. V německých postupech DiGA52 se procedury vztahují pouze na produkty, které získaly schválení v souladu s evropskou směrnicí o zdravotnických prostředcích / evropským zákonem o zdravotnických prostředcích. Výrobci DTx však nejsou tradičními společnostmi zabývajícími se zdravotnickými zařízeními, a nejsou tak obeznámeni s předpisy o zdravotnických pomůckách a regulační systémy a podmínky neznají ani výzkumní pracovníci. Proto je zapotřebí apelovat na vlády, aby zveřejnily jednotlivé metodiky nebo svolaly online semináře, které pomohou výrobcům DTx pochopit regulační systém. Další z možností je oslovit specializované týmy na úrovni konzultačních společností, které dokáží výrobcům vyřešit dílčí problémy.
Důležitým limitem tohoto textu je absence diskuse nad úhradou DTx. Úhradový systém DTx je největším kamenem úrazu při šíření inovativních zdravotnických prostředků a existuje jen málo případů, jako je DiGA v Německu a IAPT ve Spojeném království. Ačkoli zákon o digitální terapii na předpis vstoupil v USA do legislativní fáze, nebyl dosud implementován, a neexistuje tak dostatek případů pro porovnání případných platebních schémat.
Většina DTx je poskytována v rámci chytrých telefonů nebo webové aplikace podle základních technologických prvků a cílového uživatele. Například DTx pro dětskou ADHD (attention deficit hyperactivity disorder, porucha pozornosti s hyperaktivitou), oční onemocnění a psychiatrické indikace mohou mít podobu zařízení pro virtuální realitu, herní obsah nebo formu specifických programů pro mobilní zařízení nebo PC. Dosud vyvinuté základní technologie DTx jsou primárně zaměřeny na mobilní a webové aplikace, a to vzhledem k vysoké dostupnosti chytrých telefonů a potřebě monitoringu a zpětné vazby léčby.
PharmDr. Marek Lapka
Ústav farmakologie 3. LF UK, Praha
E‑mail: marek.lapka@lf3.cuni.cz
Literatura
- Carl JR, et al. Regulating digital therapeutics for mental health: opportunities, challenges, and the essential role of psychologists. Br J Clin Psychol 2022;61:130–135.
- Digital Therapeutics Alliance. Digital Therapeutics Definition and Core Principles https://dtxalliance.org/ (2023).
- Hong JS, et al. Introduction of digital therapeutics. Comput Methods Prog. Biomed 2021;209:106319.
- Huh KY, et al. Clinical evaluation of digital therapeutics: present and future. Health Inf Res 2022;28:188–197.
- Hutchinson K, et al. A music‑based digital therapeutic: proof‑of‑concept automation of a progressive and individualized rhythm‑based walking training program after stroke. Neurorehabil Neural Repair 2020;34:986–996.
- Patel NA, Butte AJ. Characteristics and challenges of the clinical pipeline of digital therapeutics. NPJ Digit Med 2020;3:159.
- Sepah SC, et al. Long‑term outcomes of a Web‑based diabetes prevention program: 2‑year results of a single‑arm longitudinal study. J Med Internet Res 2015;17:e92.
- Sim JY, et al. Establishment of policies for the growth of the digital therapeutics industry based on a stakeholder survey. Health Insurance Rev Assess Serv Res 2022;2:47–56.
- Wang C, et al. Digital therapeutics from bench to bedside. NPJ Digit Med 2023;6:38.