Bimekizumab v léčbě psoriázy
Psoriáza je chronický, imunitně a geneticky podmíněný zánět, který je vzhledem k asociaci s dalšími chorobami považován za systémovou nemoc. Manifestuje se variabilním klinickým kožním obrazem, průběh charakterizují remise a exacerbace.
Provokující faktory psoriázy dělíme na vnitřní (infekce, léky, alkohol, kouření, stres) a zevní (fyzikální a chemické). Pacienti mají významně zhoršenou kvalitu života.1 V patofyziologii psoriázy se účastní prozánětlivé cytokiny IL‑12, TNFα, interleukiny IL‑17 a IL‑23. Cytokiny IL‑17A a IL‑17F tvoří homodimery (interleukin IL‑17A/17A a interleukin IL‑17F/17F) a heterodimery (interleukin IL‑17A/17F) a synergicky s TNF stimulují zánět.
Léčba psoriázy se řídí klinickým typem a závažností onemocnění, věkem a celkovým zdravotním stavem (asociovaná onemocnění, léky atd.). Závažnost psoriázy se určuje podle procenta postižení povrchu těla lézemi psoriázy (BSA, Body Surface Area), indexem PASI (Psoriasis Area and Severity Index) a kvalitou života pacienta měřenou pomocí dotazníku DLQI (Dermatology Quality Life Index).1
V terapii mírně závažné formy psoriázy se uplatňují deriváty vitaminu D3 a kortikoidy, v léčbě středně závažné a závažné formy se přidává fototerapie pomocí UVB záření a dále léčba systémová, konvenčními léky nebo cílenými léčivy – biologiky. Biologické léky se klasifikují do několika tříd na inhibitory TNFα, interleukiny IL‑17 a interleukiny IL‑23. Do druhé skupiny patří nyní nově schválený inhibitor IL‑17A a IL‑17F bimekizumab.
Bimekizumab je humanizovaná monoklonální protilátka IgG1, která selektivně váže a neutralizuje biologickou funkci IL‑17A a IL‑17F. Tím inhibuje všechny tři dimerické formy (IL‑17A/IL‑17A, IL‑17A/IL‑17F a IL‑17F/IL‑17F).2 Inhibice cytokinů IL‑17A a IL‑17F je zřejmě účinnější než inhibice jen jednoho z nich.3
Bimekizumab v klinických studiích
V úvodních klinických studiích prokázal bimekizumab účinnost u nemocných s mírnou a středně těžkou psoriázou a psoriatickou artritidou, proto byly provedeny další studie. BE ABLE 1, klinická studie fáze 2b provedená u pacientů se středně těžkou až těžkou psoriázou prokázala 90% efekt (PASI90) u 46,2–79,1 % nemocných ve 12. týdnu léčby. Navazující studie BE ABLE 2 probíhala v letech 2016–2018 u 217 pacientů. Dávka bimekuzumabu byla určena podle odpovědi na léčbu v úvodní studii a představovala 64 mg (15 pacientů), 160 mg (111 pacientů) a 320 mg (91 pacientů). Bimekuzumab byl podáván v subkutánní injekci každé 4 týdny. Celkem 182 pacientů (83,9 %) studii dokončilo.
V této klinické studii fáze 2b u nemocných se středně těžkou a těžkou psoriázou demonstroval bimekizumab úplné nebo téměř úplné zhojení kožních lézí po 60 týdnech léčby. U většiny pacientů se jednalo o účinnost na úrovni PASI90 (tj. 90% zlepšení) po celou dobu studie. Randomizovaní pacienti, kteří zpočátku dostávali placebo a byli ve 12. týdnu převedeni do skupiny léčené 160 mg denně, dosáhli srovnatelné účinnosti. Pacienti, kteří dosáhli 90% zlepšení v úvodní studii BE ABLE 1, tj. do 12. týdne, se dále zlepšili během následující studie a celkem 69–83 % z nich dosáhlo úplné remise onemocnění. U 50–84 % nemocných koncem 60. týdne kleslo skóre BSA na 0–1. Tomu odpovídal i pokles ve skóre DLQI na 0–1 neboli významně se zlepšila kvalita života pacientů.
Léčba bimekizumabem byla celkově dobře tolerována. Nežádoucí účinky byly většinou mírné a lokalizované a s výjimkou jednoho případu kandidózy jícnu nevedly k ukončení terapie. Nejčastějším vedlejším nežádoucím účinkem byla orální kandidóza (vzhledem k mechanismu účinku IL‑17A a IL‑17F). Nebyly porovnány závažné kardiovaskulární příhody, vzplanutí nespecifického střevního zánětu ani suicidiální tendence. Výsledky této klinické studie prokázaly, že bimekizumab je velmi účinné léčivo, jež u většiny nemocných vede k úplné remisi kožních projevů, která trvá déle než rok. Je dobře tolerován.1
Následovaly další klinické studie, včetně srovnání účinnosti s adalimumabem.2 Pacienti dostávali bimekizumab 320 mg každé 4 týdny nebo byl interval podávání prodloužen od 16. týdne na dvojnásobek (po 8 týdnech) nebo byli léčeni adalimumabem 40 mg po 2 týdnech do 24 týdnů a poté byli převedeni na bimekizumab 320 mg po 4 týdnech. Studie trvala 56 týdnů a bylo do ní zařazeno 478 pacientů. V 16. týdnu došlo k 90% zlepšení (PASI90) u celkem 275 z 319 pacientů (86,2 %) léčených oběma režimy bimekuzimabem a 75 ze 159 pacientů (47,2 %) léčených adalimumabem. Mezi nejčastější nežádoucí vedlejší účinky patřily infekce horních cest dýchacích, kandidóza úst, hypertenze a diarea, tyto nežádoucí účinky byly častější ve skupině nemocných léčených bimekizumabem.2 Během dvouletého sledování se případy orální kandidózy nevyskytly častěji, byly více pozorovány ve skupině nemocných léčených bimekizumabem aplikovaným v intervalu po 4 týdnech než při 8týdením podávání.
Jiná klinická studie fáze 3b srovnávala účinnost bimekizumabu a sekukinumabu.4 Bimekizumab byl podáván v dávce 320 mg po 4 týdnech, od 16. týdne byl interval u poloviny pacientů prodloužen na 8 týdnů. Sekukinumab byl aplikován v dávce 300 mg týdně do 4. týdne a poté po 4 týdnech, celkem do 48. týdne. Cílem byla 100% redukce PASI v 16. týdnu. Bylo zařazeno 743 pacientů. V 16. týdnu mělo 230 pacientů z 373 (61,7 %) léčených bimekizumabem a 181 z 370 (48,9 %) pacientů léčených sekukinumabem PASI100 (100% zlepšení). Mezi nejčastější nežádoucí účinky patřily jako v jiných studiích infekty horních cest dýchacích a kandidóza ústní dutiny. Ulcerózní kolitida se manifestovala u jednoho nemocného léčeného bimekizumabem a jednoho léčeného sekukinumabem.
Indikace a kontraindikace
Na základě registračních klinických studií byl bimekizumab schválen v EU. Bimekizumab je indikován k léčbě středně těžké až těžké formy ložiskové psoriázy u dospělých, u nichž je indikována systémová léčba. Doporučená dávka pro dospělé pacienty je 320 mg (podaných jako 2 subkutánní injekce po 160 mg) v 0., 4., 8., 12. a 16. týdnu a poté každých 8 týdnů. U pacientů, kde nebylo dosaženo zlepšení po 16 týdnech léčby, je třeba zvážit ukončení léčby.
Kontraindikací je hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku. Bimekizumab může zvýšit riziko infekcí, jako jsou infekce horních cest dýchacích a orální kandidóza. Léčba bimekizumabem se nesmí zahájit u pacientů s jakoukoli klinicky významnou aktivní infekcí, dokud není infekce vyřešena nebo adekvátně léčena. Před zahájením léčby bimekizumabem mají být pacienti vyšetřeni na přítomnost TBC. Bimekizumab se pro pacienty se zánětlivým střevním onemocněním nedoporučuje. U inhibitorů IL‑17 byly pozorovány závažné hypersenzitivní reakce včetně anafylaktických reakcí. Shrnutí nežádoucích účinků ukazuje tabulka 1.
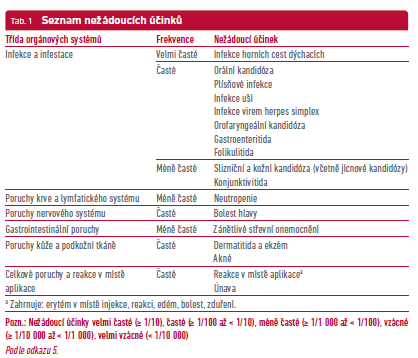
Před zahájením léčby bimekizumabem má být zváženo dokončení všech očkování příslušných pro daný věk v souladu s aktuálními vakcinačními doporučeními. Pacientům léčeným bimekizumabem nemají být podávány živé vakcíny.
Ženy ve fertilním věku musejí během léčby a ještě nejméně 17 týdnů po ukončení léčby používat účinnou antikoncepci. Podávání bimekuzumabu v těhotenství se z preventivních důvodů nedoporučuje. Není známo, zda se bimekizumab vylučuje do lidského mateřského mléka.5
Bimekizumab je v ČR registrován pod názvem Bimzelx, nemá zatím schválenu úhradu ze zdravotního pojištění. Představuje rozšíření léčebných možností středně těžké a těžké psoriázy s velmi rychlým nástupem účinku a vysokou účinností. Rozšiřuje také spektrum inhibitorů interleukinu IL‑17.6,7
Literatura
- Vašků V. Psoriáza. In: Hercogová J, et al. Klinická dermatovenerologie, 1. díl. Praha: Mladá fronta 2019; 166–179.
- Warren RB, Blauvelt A, Bagel J, et al. Bimekizumab versus Adalimumab in Plaque Psoriasis. N Engl J Med 2021; 385:130–141.
- Blauvelt A, Papp KA, Merola JP, et al. Bimekizumab for patients with moderate to severe plaque psoriasis: 60‑week results from BE ABLE 2, a randomized, double‑blinded, placebo‑controlled, phase 2b extension study. J Am Acad Derm 2020;83:1367–1374.
- 4. Reich K, Warren RB, Lebwohl M, et al. Bimekizumab versus Secukinumab in Plaque Psoriasis. N Engl J Med 2021;385:142–152.
- BIMZELX, 160MG INJ SOL 3(3X1)X1ML, Státní ústav pro kontrolu léčiv (sukl.cz).
- Třešňák Hercogová J, Vašků V, Zelenková D, et al. Psoriáza. Doporučený diagnostický a léčebný postup. Čes. Dermatovenerol. 2021;11:3–17.
- Třešňák Hercogová J. Novinky v léčbě psoriázy. Čes Dermatovenerol 2022 – v tisku.