CHOPN jako kardiovaskulární riziko
Souhrn
Chronická obstrukční plicní nemoc (CHOPN) je potvrzená a významná kardiovaskulární komorbidita. Článek se zaměřuje na současný pohled na CHOPN a jeho vliv na kardiovaskulární riziko. (Kap Kardiol 2023; 15: 31–35)
Klíčová slova
· exacerbace CHOPN · CHOPN · kardiovaskulární riziko · léčba CHOPN
Úvod
Chronická obstrukční plicní nemoc (CHOPN) je podle doporučení Globální iniciativy pro CHOPN (GOLD) z roku 2023 definována jako heterogenní plicní stav charakterizovaný respiračními příznaky (dušnost, kašel, produkce sputa a/nebo exacerbace), způsobený abnormalitami dýchacích cest (bronchitida, bronchiolitida) a/nebo alveolů (emfyzém), které vyvolávají perzistující, často progredující bronchiální obstrukci.1 CHOPN je heterogenní onemocnění, na kterém se nepodílí pouze kouření cigaret, ale řada genetických faktorů, abnormální vývoj plic, znečištěné venkovní, ale i domácí prostředí, infekce, astma a i některé dosud nepoznané příčiny.
CHOPN tedy není jedna nemoc, nýbrž představuje klinicky heterogenní syndrom, který je charakteristický ne zcela reverzibilní bronchiální obstrukcí, dynamickou hyperinflací plic, destrukcí parenchymu a omezením průtoku vzduchu dýchacími cestami. Pro nemocné je typická tendence k progresivnímu poklesu plicních funkcí. Obstrukce u CHOPN vzniká pomalu během let, a to v důsledku chronického neinfekčního progredujícího zánětu dýchacích cest a plicního parenchymu u geneticky vnímavého jedince. V rámci diferenciální diagnostiky je nutné rozpoznat průduškové astma (asthma bronchiale) a přesah obou nemocí ‒ tzv. syndrom ACO (asthma and chronic obstructive pulmonary disease overlap), ale také městnavé srdeční selhání nebo jiné příčiny bronchiální obstrukce.
Progredující chronický zánět u CHOPN postupně postihuje i jiné orgány a vznikají mimoplicní postižení v rámci systémového zánětu. Změny nacházíme hlavně v kardiovaskulárním (KV) a v muskuloskeletálním systému, skeletu (osteoporóza), v centrálním nervovém systému (CNS) (deprese), v endokrinním systému (diabetes mellitus) spolu s metabolickým syndromem. CHOPN tedy stojí za řadou významných komorbidit, které je třeba rozpoznat a léčit současně. CHOPN je rovněž prokázanou prekancerózou pro vznik bronchogenního karcinomu.
Definice exacerbace CHOPN
GOLD 2023 aktualizuje definici exacerbace CHOPN. Exacerbace CHOPN je definována jako příhoda charakterizovaná nárůstem dušnosti a/nebo kašle a/nebo sputa, které se zhoršují v průběhu méně než 14 dní a mohou být provázeny tachypnoí a/nebo tachykardií a jsou asociovány často se zvýšeným lokálním nebo systémovým zánětem, který je způsoben infekcí, znečištěním nebo jinou příčinou vedoucí k poškození dýchacích cest. V rámci prevence exacerbací se doporučuje stanovovat hladiny periferní eozinofilie a odlišovat příčiny vzniku exacerbací od infekční komponenty s ohledem na indikaci podání inhalačních kortikosteroidů (IKS) a antibiotik v kombinaci s inhalačními dlouhodobými bronchodilatancii.1
Kategorizace a léčba CHOPN
GOLD 2023 mění kategorizaci skupin ABCD. Podle nového doporučení zůstávají neměnné skupiny A a B, naopak skupiny C a D jsou sloučeny pod skupinu E, která je definována přítomností alespoň dvou středně těžkých exacerbací, anebo alespoň jedné těžké exacerbace vyžadující hospitalizaci, bez ohledu na závažnost symptomů CHOPN (dle Modifikované škály dušnosti Medical Research Council [mMRC] a COPD Assessment Test [CAT]) (obr. 1). 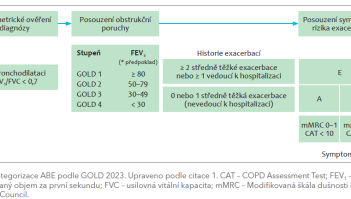 Skupina A má nadále indikováno podání inhalačního krátkodobě působícího nebo raději dlouhodobě působícího bronchodilatancia. Skupina B doporučuje volné nebo raději fixní kombinace LABA (inhalační β2‑agonisté s dlouhodobým účinkem) + LAMA (inhalační anticholinergika s dlouhodobým účinkem). Ve skupině E je preference podání fixní dvojkombinace LABA + LAMA nebo trojkombinace LABA + LAMA + IKS (obr. 2). Tato trojkombinace je doporučena právě pro pacienty s periferní eozinofilií. Po zavedení léčby je nutné provést komplexní zhodnocení efektu a v případě nutnosti provést změnu.1
Skupina A má nadále indikováno podání inhalačního krátkodobě působícího nebo raději dlouhodobě působícího bronchodilatancia. Skupina B doporučuje volné nebo raději fixní kombinace LABA (inhalační β2‑agonisté s dlouhodobým účinkem) + LAMA (inhalační anticholinergika s dlouhodobým účinkem). Ve skupině E je preference podání fixní dvojkombinace LABA + LAMA nebo trojkombinace LABA + LAMA + IKS (obr. 2). Tato trojkombinace je doporučena právě pro pacienty s periferní eozinofilií. Po zavedení léčby je nutné provést komplexní zhodnocení efektu a v případě nutnosti provést změnu.1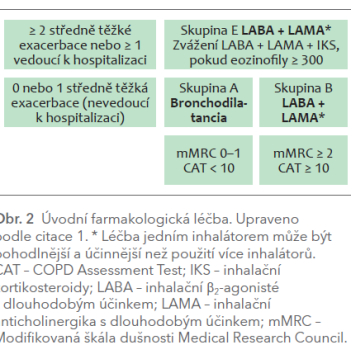
GOLD maximalizuje farmakoterapii už v úvodu. GOLD 2023 také zdůrazňuje závěry studií IMPACT a ETHOS s použitím fixních trojkombinací IKS + LABA + LAMA ve srovnání s dvojkombinační léčbou LABA + LAMA v redukci mortality u symptomatických pacientů s častými exacerbacemi.2,3 Rozhodující vliv má i výběr co nejjednodušší nekomplikované inhalační léčby ve smyslu fixního podání, jednoduchosti inhalačního systému, správné edukace a zvýšení adherence k inhalační léčbě. Aktuální přehled fixních kombinací LABA + LAMA a fixních trojkombinací LABA + LAMA + IKS dostupných v ČR jsou shrnuty v tabulkách 1, 2.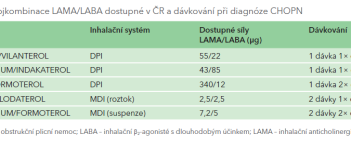
CHOPN jako kardiovaskulární riziko
CHOPN je již potvrzenou a důkladně zkoumanou kardiovaskulární komorbiditou, ale jako rizikový faktor je stále studována. Nemocní s CHOPN mají dvakrát až třikrát vyšší riziko kardiovaskulárního onemocnění (KVO) ve srovnání s věkově odpovídajícími kontrolami i po adjustaci na kouření tabáku. Pacienti s lehkou až středně těžkou CHOPN mají 8–10× vyšší pravděpodobnost úmrtí na KVO způsobené aterosklerózou (ASKVO) než na respirační selhání. Mají rovněž větší míru hospitalizací a úmrtí v důsledku kardiovaskulárního onemocnění, cévních mozkových příhod a srdečního selhání.4,5 Kardiovaskulární onemocnění jsou často nedostatečně diagnostikována. Jen asi u třetiny pacientů s CHOPN s EKG průkazem infarktu myokardu je diagnostikováno KVO.6 Úmrtnost na KVO se zvyšuje o 28 % a četnost nefatálních koronárních příhod o 20 % na každých 10 % poklesu usilovného vydechovaného objemu za první sekundu (FEV1).7 Akutní exacerbace CHOPN v důsledku infekce jsou časté a jsou příčinou čtyřnásobného nárůstu KV příhod.8 Riziko infarktu myokardu a ischemické CMP se zvyšuje během tří měsíců po akutní exacerbaci CHOPN.9 Vysoký výskyt KVO u pacientů s CHOPN lze vysvětlit tím, že obě onemocnění mají společné rizikové faktory, jako jsou kouření cigaret, stárnutí, hypertenze, dyslipidemie a ostatní chronické zánětlivé nemoci.10 Metabolický syndrom a snížená fyzická aktivita je přítomna u 34 % pacientů s CHOPN, přičemž nejčastějšími složkami jsou hypertenze (56 %), abdominální obezita (39 %) a hyperglykemie (44 %).11 KVO může být způsobeno hypoxií během cvičení v důsledku hyperinflace plic, vysoké klidové tepové frekvence, zhoršené vazodilatační kapacity a periferního, srdečního a neurohumorálního stresu vyvolaného sympatikem. Ateroskleróza a kalcifikace koronárních tepen mohou být důsledkem oxidačního stresu a snížení množství anti‑agingových molekul způsobujících stárnutí plic a cév.12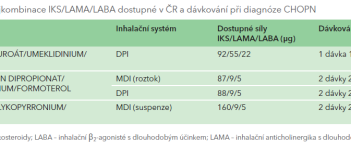
Systémový zánět je u CHOPN nadměrný, cirkulující biomarkery jsou ve vysokých koncentracích a jsou spojeny se zvýšenou mortalitou.13 Troponin se například zvyšuje během akutní exacerbace CHOPN a u 10 % hospitalizovaných splňuje definici akutního infarktu myokardu.14
Systémový zánět a oxidační stres u CHOPN podporují remodelaci cév, jejich tuhost a aterosklerózu a navozují prokoagulační stav.15 Se závažností CHOPN korelují kognitivní poruchy a demence v důsledku mikrovaskulárního poškození mozku. Pacienti mají o 20 % vyšší riziko ischemické a hemoragické cévní mozkové příhody, které může být po akutní exacerbaci CHOPN až sedmkrát vyšší.16 Onemocnění periferních tepen, tzv. peripheral artery disease (PAD), je přítomno přibližně u 9 % pacientů s CHOPN,17 u nichž je riziko vzniku PAD téměř dvojnásobné,18 stejně tak je zvýšený výskyt krčních cévních uzávěrů v závislosti na závažnosti onemocnění.19 CHOPN je také spojena s vyšším výskytem abdominálního aortálního aneurysmatu nezávisle na kouření cigaret.20
Srdeční arytmie jsou časté a mohou být způsobeny různými hemodynamickými vlivy (plicní hypertenzí, diastolickou dysfunkcí, strukturální a elektrickou remodelací síní) v kombinaci s autonomní nerovnováhou a abnormální repolarizací komor.21 Fibrilace síní je častá a je přímo spojena s hodnotou FEV1, obvykle je vyvolána akutní exacerbací CHOPN a je nezávislým prediktorem úmrtnosti na CHOPN v nemocnici.22,23 CHOPN je také rizikovým faktorem pro komorovou tachykardii nezávisle na ejekční frakci (EF)24 a pro náhlou srdeční smrt nezávisle na rizikovém profilu KVO.25
Nerozpoznaná komorová dysfunkce je u CHOPN běžná26 a selhání komory je u pacientů s CHOPN 3,8krát častější než u kontrol.27 Pacienti s častými akutními exacerbacemi mají vysokou frekvenci diastolické dysfunkce. Riziko kardiálního selhání je větší i kvůli vyšší prevalenci hypertenze a diabetu.28
Vzhledem k těmto výše uvedeným skutečnostem se zdá být nanejvýš důležité vyšetřovat pacienty s CHOPN na přítomnost kardiovaskulárních onemocnění způsobených aterosklerózou včetně jejích rizikových faktorů. Současně musíme mít na paměti, že samotná CHOPN ovlivňuje přesnost diagnostických testů na přítomnost KVO. Dosažení adekvátní fyzické zátěže je obtížné, vazodilatancia pro perfuzní vyšetření myokardu mohou být kontraindikována kvůli riziku bronchospasmu a zátěžová nebo transtorakální echokardiografie bývá vzhledem k plicní hyperinflaci málo přesná a špatně hodnotitelná. Alternativou může být koronarografické vyšetření výpočetní tomografií nebo magnetickou rezonancí. Tato vyšetření jsou ale nákladná a časově náročná a také ne vždy dostupná. Léčba CHOPN pomocí inhalačních LABA (inhalační β2‑agonisté s dlouhodobým účinkem) + inhalační LAMA (inhalační anticholinergika s dlouhodobým účinkem) nebo jejich často fixními kombinacemi není u pacientů se stabilní CHOPN spojena s celkovými KV nežádoucími účinky. Olodaterol může dokonce snížit riziko celkových KV nežádoucích příhod a formoterol může snížit riziko srdeční ischemie. LABA mohou snižovat výskyt hypertenze, ale mohou někdy zvyšovat riziko KV příhod podle různých studií, z tohoto důvodu by měly být u pacientů s KV příhodami používány s opatrností.29
Závěr
CHOPN se v současnosti stala heterogenní jednotkou, kterou je naprosto nezbytné co nejlépe poznat a určit individualizovanou léčbu klinicky významných cílů s ohledem na komorbidity. CHOPN má již potvrzené a důkladně zkoumané kardiovaskulární komorbidity, konkrétní rizika jsou ale stále v intenzivním výzkumu. Článek současná možná kardiovaskulární rizika shrnuje. Klíčovým parametrem je v současnosti screening a časný záchyt CHOPN ještě před akcelerací systémového zánětu s potenciálem preventivního ovlivnění výskytu kardiovaskulárních onemocnění a ostatních komorbidit.
Tato práce byla podpořena výzkumným programem Univerzity Karlovy, Cooperatio 34.
Literatura
- Global Strategy for Diagnosis, Management and Prevention of COPD 2023 Report, www.goldcopd.org. Navštíveno 8. 8. 2023.
- Lipson DA, Crim C, Criner GJ, et al. Reduction in All‑Cause Mortality with Fluticasone Furoate/Umeclidinium/Vilanterol in Patients with Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med 2020;201:1508–1516.
- Martinez FJ, Rabe KF, Ferguson GT, et al. Reduced All‑Cause Mortality in the ETHOS Trial of Budesonide/Glycopyrrolate/Formoterol for Chronic Obstructive Pulmonary Disease. A Randomized, Double‑Blind, Multicenter, Parallel‑Group Study. Am J Respir Crit Care Med 2021;203:553–564.
- Chen W, Thomas J, Sadatsafavi M, et al. Risk of cardiovascular comorbidity in patients with chronic obstructive pulmonary disease: a systematic review and meta‑analysis. Lancet Respir Med 2015;3:631–639.
- Vanfteteren LEGW, Spruit MA. Wouters EFM, et al. Management of chronic obstructive pulmonary disease beyond the lungs. Lancet Respir Med 2016;4:911–924.
- Brekke PH, Omland T, Smith P, et al. Underdiagnosis of myocardial infarction in COPD – Cardiac Infarction lnjury Score (CIIS) in patients hospitalised for COPD exacerbation. Respir Med 2008;102:1243–1247.
- Sin DD, Man SF. Chronic obstructive pulmonary disease as a risk factor for cardiovascular morbidity and mortality. Proc Am Thorac Soc 2005;2:8–11.
- Kunisaki KM, Dransfield MT, Anderson JA, et al. SUMMIT Investigators. Exacerbations of Chronic Obstructive Pulmonary Disease and Cardiac Events. A Post Hoc Cohort Analysis from the SUMMIT Randomised Clinical Trial. Am J Respir Crit Care Med 2018;198:51–57.
- Rothnie KJ, Connell O, Mullerova H, et al. Myocardial Infarction and Ischemic Stroke after Exacerbation s of Chronic Obstructive Pulmonary Disease. Ann Am Thorac Soc 2018;15:935–946.
- Huiart L Emst P, Suissa S. Cardiovascular morbidity and mortality in COPD. Chest 2005;128:2640–2646.
- Cebron Lipovec N, Beijers RJ, van den Borst B, et al. The Prevalence of Metabolic Syndrome in Chronic Obstructive Pulmonary Disease: A Systematic Review. COPD 2016;13:399–406.
- Wang LY, Zhu YN, Cui JJ, et al. Subclinical atherosclerosis risk markers in patients with chronic obstructive pulmonary disease: A systematic review and meta‑analysis. Respir Med 2017;123:18–27.
- Agusti A, Edwards LD, Rennard SI, et al. Evaluation of COPD Longitudinally to Identify Predictive Surrogate Endpoints (ECLIPSE) Investigators. Persistent systemic inflammation is associated with poor clinical outcomes in COPD: a novel phenotype. PLoS One 2012;7: e37483.
- MacDonald MI, Shafuddin E, King PT, et al. Cardiac dysfunction during exacerbations of chronic obstructive pulmonary disease. Lancet Respir Med 2016;4:138–148.
- Maclay JD, McAllister DA, Johnston S, et al. Increased platelet activation in patients with stable and acute exacerbation of COPD. Thorax 2011;66:769–774.
- Lahousse L, Tiemeier H, Ikram MA, et al. Chronic obstructive pulmonary disease and cerebrovascular disease: A comprehensive review. Respir Med 2015;109:1371–1380.
- Houben‑Wilke S, Jorres RA, Bals R, et al. Peripheral Artery Disease and Its Clinical Relevance in Patients with Chronic Obstructive Pulmonary Disease in the COPD and Systemic Consequences – Comorbidities Network Study. Am J Respir Crit Care Med 2017;195:189–197.
- Terzikhan N, Lahousse L, Verhamme KMC, et al. COPD is associated with an increased risk of peripheral artery disease and mortality. ERJ Open Res 2018;4:00086‑2018.
- Ambrosino P, Lupoli R. Cafaro G, et al. Subclinical carotid atherosclerosis in patients with chronic obstructive pulmonary disease: a meta‑analys of literature studies. Ann Med 2017;49:513–524.
- Xiong J, Wu Z. Chen C, et al. Chronic obstructive pulmonary disease effect on the prevalence and postoperative outcome of abdominal aortic aneurysms: A meta‑analysis. Sci Rep 2016;6:25003.
- Goudis CA, Konstantinidis AK, Ntalas IV, et al. Electrocardiographic abnormalities and cardiac arrhythmias in chronic obstructive pulmonary disease. Int J Cardiol 2015;199:264–273.
- Buch P, Friberg J, Scharling H, et al. Reduced lung function and risk of atrial fibrilation in the Copenhagen City Heart Study. Eur Respir J 2003;21:1012–1016.
- Goudis CA. Chronic obstructive pulmonary disease and atrial fibrillation: An unknown relationship. J Cardiol 2017;69:699–705.
- Konecny T, Somers KR, Park JY, et al. Chronic obstructive pulmonary disease as a risk factor for ventricular arrhythmias independent of left ventricular function. Heart Rhythm 2018;15:832–838.
- van den Berg ME, Stricker BH, Brusselle GG, et al. Chronic obstructive pulmonary disease and sudden cardiac death: A systematic review. Trends Cardiovasc Med 2016;26:606–613.
- Macchia A, Rodriguez Moncalvo JJ, Kleinert M, et al. Unrecognised ventricular dysfunction in COPD. Eur Respir J 2012;39:51–58.
- Curkendall SM, De Luise C, Jones JK, et al. Cardiovascular disease in patients with chronic obstructive pulmonary disease. Saskatchewan Canada cardiovascular disease in COPD patients. Ann Epidemiol 2006;16:63–70.
- Mannino DM, Thom D, Swensen A, et al. Prevalence and outcomes of diabetes, hypertension and cardiovascular disease in COPD. Eur Respir J 2008;32:962–969.
- Li C, Cheng W, Guo J, et al. Relationship of inhaled long‑acting bronchodilators with cardiovascular outcomes among patients with stable COPD: a meta‑analysis and systematic review of 43 randomized trials. Int J Chron Obstruct Pulmon Dis 2019;14:799–808.