Diagnostika infekčních komplikací a jejich léčba u syndromu diabetické nohy
Souhrn
Infekční komplikace vzniklé u syndromu diabetické nohy (SDN) jednoznačně zvyšují morbiditu nemocných se SDN, přispívají k vyšší incidenci amputací dolních končetin, ale v některých případech mohou zvýšit i riziko úmrtí. Proto je třeba infekci vždy včasně a řádně diagnostikovat a rychle zahájit její agresivní léčbu. Součástí tohoto sdělení budou bližší informace týkající se diagnostiky a léčby infekce SDN. Tyto informace budou vycházet z recentních doporučení Mezinárodní pracovní skupiny pro management SDN – International Working Group on the Diabetic Foot (IWGDF).1
Klíčová slova: syndrom diabetické nohy • infekce • ATB
Summary
Infectious complications of diabetic foot syndrome (DFS) clearly increase the morbidity of patients with DFS, contribute to a higher incidence of lower limb amputations, but in some cases may increase the risk of death. Therefore, it is always necessary to diagnose the infection early and properly and quickly start its aggressive treatment. This manuscript describes in detail the diagnosis and treatment of DFS infection based on recent recommendations of the International Working Group on Diabetic Foot (IWGDF) DFS.1
Key words: diabetic foot syndrome • infection • ATB
Úvod
Infekce, která se rozvine u syndromu diabetické nohy (SDN), se vyskytuje oproti nediabetickým ranám častěji. Pro pacienty je nebezpečná svým rychlým nástupem, často s menší klinickou symptomatologií, jež neodpovídá rozsahu problému. V některých případech je hůře diagnostikovatelná, u části pacientů hůře odpovídá na léčbu. Infekce při SDN bývá nejčastější příčinou hospitalizací pacienta-diabetika. Zvyšuje riziko amputací dolních končetin2,3 – až 75–85 % amputací předchází infekce defektu/rány.4 Stojí i za vyšší mortalitou nemocných se SDN – Ndosi a kol. popsali ve své studii během jednoho roku až 15% úmrtnost nemocných s infekčními komplikacemi.2
Častější výskyt infekcí může být dán alterací imunitních funkcí u pacientů s diabetes mellitus (DM) oproti nemocným bez diabetu. Jak postižení v oblasti nespecifické, tak specifické imunity predisponuje nemocné k poruše rozpoznávání patogenu a adekvátní imunitní odpovědi, což bylo prokázáno i v jedné z našich studií.5 Toto může vést k rychlejšímu nástupu infekce s menší klinickou odezvou, než kterou bychom očekávali. Systémové příznaky (např. horečka, zimnice), výrazná leukocytóza nebo závažné metabolické poruchy nejsou tak časté u pacientů s infekcí při SDN, ale jejich přítomnost ukazuje na závažnější, potenciálně končetinu ohrožující (nebo dokonce život ohrožující) infekci.6
Diagnostika infekce může být v některých případech poměrně svízelná, jejímu rozpoznání brání např. ztráta algické reakce vlivem periferní neuropatie. Pokud se objevuje u pacienta s těžkou distální senzorimotorickou neuropatií bolest, obvykle je to špatné znamení, jelikož se jedná o pokročilý infekční nebo ischemický nález. Dalším problémem je správně provedená diagnostika osteomyelitidy (OM), kdy lze někdy hůře rozeznat např. OM od Charcotovy osteoartropatie. Mnohdy je nutno použít řadu sofistikovanějších diagnostických metod, které ovšem nemusejí být vždy ve všech zdravotnických zařízeních k dispozici.
Léčba infekce může být svízelná z několika důvodů – terapii může komplikovat přítomnost ischemické choroby dolních končetin (ICHDK) nedovolující dosahovat patřičných terapeutických koncentrací antibiotik (ATB) v místě defektu/rány, přítomnost bakteriální rezistence bránící použít mnohdy účinná ATB v ambulantní sféře. Otázkou je i ekonomická náročnost dané terapie, tolerance ATB léčby a množství vedlejších účinků.
Zvládnout infekci u SDN znamená věnovat se pečlivě správné diagnostice, získat vhodné vzorky pro kultivaci, indikovat racionální antimikrobiální terapii, rychle rozhodnout, kdy je zapotřebí chirurgický zákrok, a poskytnout veškerou další potřebnou komplexní terapii. Jistě je třeba souběžně řešit problém cévních změn a odlehčení.7,8
Zhodnocení závažnosti infekce, zejména u hospitalizovaných pacientů, by mělo být provedeno vždy do 24 hodin.9
Definice
Infekce u SDN je definována jako přítomnost zánětlivého procesu v kterékoli části tkáně od kotníku distálně u osoby s DM.4 Zahrnuje paronychia, celulitidy, myozitidy, abscesy, nekrotizující fasciitidy, septické artritidy, tendinitidy a OM. Mezi klasické symptomy infekce SDN řadíme zarudnutí, proteplení, otok či hnisavou sekreci. Někdy mohou být projevy infekce spojeny s tzv. sekundárními znaky – např. s přítomností křehké granulační tkáně, podminovanými okraji ulcerace, nepříjemným zápachem nebo se zvýšením objemu exsudátu.
Ačkoli řada infekcí vzniká povrchově, může dojít při opožděném zahájení léčby nebo při nedostatečné léčbě k rychlému rozšíření zánětu do hlubších struktur (fascií, šlach, svalů, kloubů a kostí).4 Rizikovými faktory pro rozvoj infekčních komplikací jsou alterace imunitního systému (viz výše), diabetická neuropatie znesnadňující rozpoznání infekce (pacientům s DM trvá až trojnásobek času oproti nediabetikům, nežli vyhledají odbornou pomoc),10 ICHDK, která zvyšuje až dvojnásobně riziko infekce,11 omezuje schopnost imunitního systému bojovat proti infekci a pravděpodobně poškozuje i dodávku ATB do cílových tkání. Přispět k infekčním komplikacím může i postižení ledvin.12 Dalšími nezávislými rizikovými faktory jsou hluboké rány, rány penetrující ke kostem, recidivující rány, rány trvající více než 30 dní a předchozí amputace.
Infekční komplikace v rámci SDN je třeba řádně klasifikovat, neboť závažnost infekce ovlivňuje prognózu nemocných. Od závažnosti infekce se odvíjí další diagnosticko‑terapeutický postup.
Klasifikace
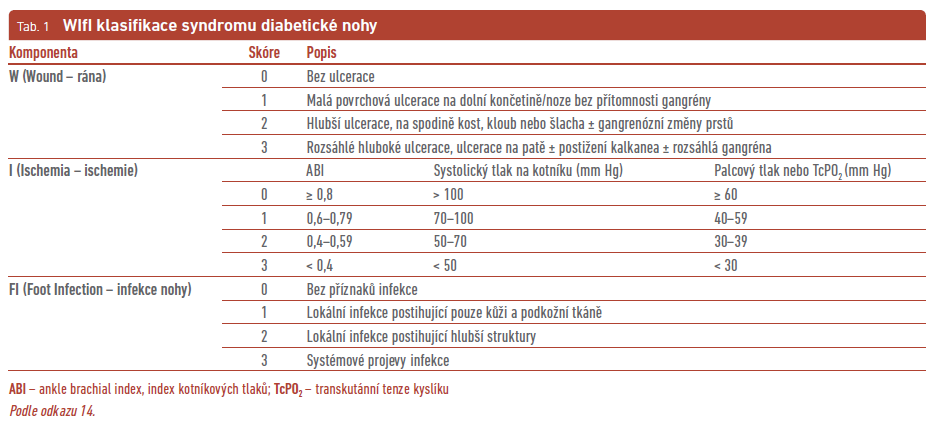
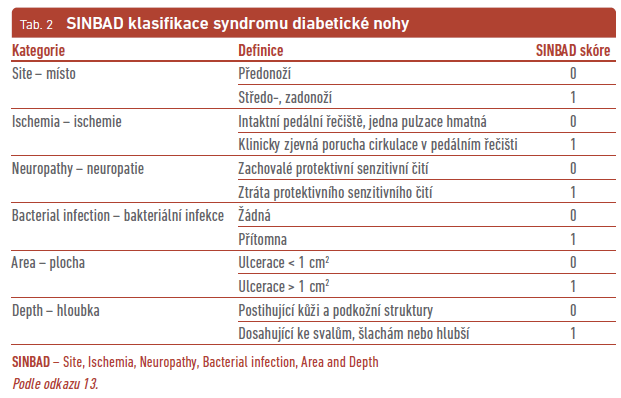
Řada klasifikačních systémů SDN zohledňuje přímo nebo nepřímo přítomnost infekce. Hodnocení infekce zahrnují zejména dva klasifikační systémy – WIfI (Wound, Ischemia, foot Infection; tab. 1) a SINBAD (Site, Ischemia, Neuropathy, Bacterial infection, Area and Depth; tab. 2), jejichž součástí je klasifikace IWGDF/IDSA (International Working Group on the Diabetic Foot/Infectious Diseases Society of America) pro infekci.13 Klasifikační systém IWGDF/IDSA pro infekci je relativně snadné používat, vyžaduje pouze klinické vyšetření, standardní laboratorní a zobrazovací metody, pomáhá v diagnostice i léčbě infekce, není rizikový a je široce akceptován akademickou veřejností (tab. 3). Nově byla do této klasifikace přidána i OM.

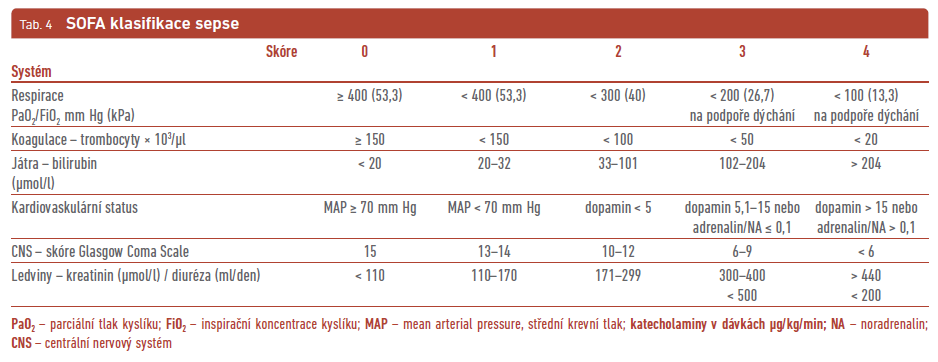
Sepse při infekci SDN byla dříve spojována se syndromem systémové zánětlivé odpovědi (SIRS; systemic inflammatory response syndrome). Ovšem ne vždy se dané příznaky mohou např. u polymorbidních starších nemocných se SDN vyskytovat. Daní nemocní nemají vždy kapacitu rozvinout systémové změny uvedené v definici SIRS nebo změny zánětlivých parametrů, na kterých je definice SIRS postavena. Proto se podle posledních doporučení používá definice sepse založená hlavně na orgánovém poškození15 – „Sepse je definována jako život ohrožující orgánová dysfunkce způsobená deregulovanou odezvou hostitelského organismu na přítomnost infekce“. Tomu odpovídá klasifikace sepse SOFA (Sepsis‑related Organ Failure Assessment; tab. 4). Skóre dosahující více než 2 bodů je asociováno s hospitalizační mortalitou vyšší než 10 %. Rychle lze zhodnotit závažnost sepse pomocí tzv. quick SOFA (qSOFA). Za závažnou sepsi je považován klinický stav mající alespoň dvě z následujících kritérií: dechovou frekvenci převyšující 22/min, alteraci vědomí nebo systolický tlak nižší než 100 mm Hg.
Diagnostika
Infekční komplikace SDN se obvykle diagnostikují dle klinického stavu – na základě lokálních nebo systémových projevů zánětu. Kromě lokálních známek zánětu (erytém, indurace, otok, bolest, hnisavá sekrece, zvýšená teplota, hluboké defekty) mohou přispět k diagnostice i zvýšené parametry zánětu (CRP, FW, prokalcitonin). Zvýšené počty leukocytů nemají příliš vysokou výpovědní hodnotu (přibližně pouze u poloviny nemocných dochází k jejich elevaci).16 Více výpovědní jsou hodnoty sedimentace erytrocytů (FW – Fahræus Westergren), i přestože mohou být ovlivněny různými komorbiditami (např. anémie, uremie) a nemusejí být zvýšeny u akutních infekcí v důsledku relativně pomalé odezvy tohoto zánětlivého biomarkeru. Většina studií zaměřených na sérové hladiny prokalcitoninu zjistila, že tyto hodnoty bývají u infikovaných diabetických ulcerací významně vyšší než u neinfikovaných, ale mezi hodnotami a závažností infekce existuje pouze malá korelace.17 Sérové koncentrace C‑reaktivního proteinu (CRP) bývají významně vyšší u infikovaných diabetických ulcerací než u neinfikovaných. Hodnota CRP signifikantně stoupá v závislosti na závažnosti infekce.18 Proto hodnoty CRP a prokalcitoninu vykazují vyšší diagnostickou přesnost než počty leukocytů nebo FW.
Diagnostika infekce SDN, která je převážně bakteriálního původu, se provádí především mikrobiálním vyšetřením vzorků měkkých tkání (odběr vzorku asepticky kyretáží či biopsií tkání), kostí (mikrobiologicky i histologicky), výjimečně ze stěrů (pravděpodobná kontaminace).19 Mikrobiální odběry slouží ke zjištění kauzálního agens a ke stanovení následné ATB terapie. Nedoporučuje se provádět PCR (polymerase chain reaction, polymerázová řetězová reakce) diagnostiku, jelikož zachycuje živé i neživé organismy a neurčuje citlivost na ATB.
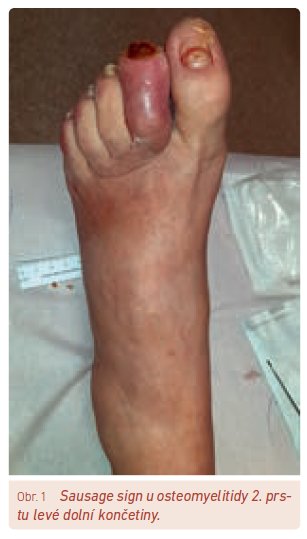
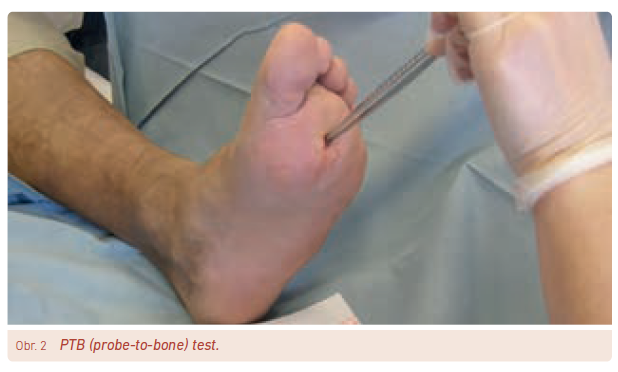
Na OM bychom měli pomýšlet u ulcerací/ran na nohou diabetiků, pokud tyto ulcerace trvaly několik týdnů nebo pokud jsou rozsáhlé, hluboké, lokalizované nad kostními prominencemi nebo se jedná o rány s viditelnou kostí na spodině. Dalším klinickým příznakem může být tzv. sausage sign (obr. 1).20 Při podezření na OM se doporučuje provést kombinaci probe‑to‑bone testu (PTB), FW nebo zjištění hodnot CRP/prokalcitoninu a vyšetření pomocí RTG (rentgen). PTB test je spolehlivým diagnostickým nástrojem, ale spolehlivost vyšetření závisí na technice a zkušenostech lékaře a na lokalizaci ulcerace.21 Senzitivita testu se pohybuje okolo 87 % a specificita činí 83 %. Jeho provedení je jednoduché a technicky nenáročné – k PTB testu je potřeba pouze kovová sonda, výjimečně pinzeta (obr. 2). Rentgenové snímky pomáhají odhalit OM, ale příslušné RTG změny se projevují až s určitým časovým zpožděním (dle našich zkušeností kolem 2–3 týdnů). Pokud RTG snímek spolu s klinickými a laboratorními nálezy jasně svědčí o OM, není již třeba provádět další vyšetření. Pokud je ale diagnóza OM stále nejistá, měla by se provést další vyšetření – např. magnetická rezonance (MR – senzitivita 90 %, specificita 80 %),22 scintigrafie značenými leukocyty (s CT nebo bez CT) či 18F‑fluorodeoxyglukóza (FDG)‑pozitronová emisní tomografie/výpočetní tomografie (PET/CT). Vyšetření MR je v mnohých centrech dostupné, přináší informace o lokalizaci a rozsahu infekčního postižení jak v oblasti měkkých tkání, tak v kostech nohy. Vhodné je provést dané vyšetření zejména před rozsáhlejším chirurgickým či ortopedickým výkonem. Vyšetření může být zkresleno traumatem, předchozím operativním zákrokem na noze nebo Charcotovou neuroosteoartropatií. Novější pokročilé zobrazovací metody, jako je zejména FDG‑PET/CT a 99mTc‑exametazim (HMPAO) – leukocytární scintigrafie, lze indikovat u pacientů s kontraindikací MR.23
Dalším vyšetřením, které může upřesnit diagnostiku OM, je kostní biopsie (osteobiopsie, OB). Vyšetření je indikováno v případě diagnostických pochybností nebo k určení kauzálního patogenu pro cílenou ATB léčbu a je považováno za referenční standard pro diagnostiku kostní infekce. Jak prokázal ve své studii Ertuglura a kol.,24 výsledky mikrobiálního vyšetření z měkkých tkání se ve srovnání s kultivací z kostí shodují pouze ve 49 %, přičemž měkké tkáně častěji obsahují polymikrobiální flóru, a neumožní tak úzce cílenou ATB terapii OM. OB je výkon technicky nenáročný, bezpečný a obvykle nevyžaduje anestezii. Abychom se vyhnuli falešně negativním výsledkům, doporučuje se ukončení nebo přerušení ATB léčby po dobu dvou týdnů před OB,25 pokud to není vzhledem ke klinickému stavu možné, doporučuje se přerušení ATB léčby alespoň na 48 hodin. Vzorek kostní tkáně odebraný během operace přímo nebo perkutánně přes intaktní kůži za aseptických podmínek je ideální vyšetřit mikrobiologicky i histologicky. Stupeň shody je nízký, v naší studii 38 OB jsme našli současně pozitivní histopatologický nález a kultivaci u 52 % pacientů, zatímco pozitivní alespoň jedno vyšetření mělo 87 % pacientů.26 Podobné výsledky potvrzují i zahraniční studie. Přestože OB je považována za zlatý standard v diagnostice OM, v praxi je bohužel málo využívána, často z logistických či časových důvodů. Měla by však být vždy provedena tam, kde jsou pochybnosti o diagnóze, typicky při výskytu možné OM v terénu Charcotovy osteoartropatie nebo při podezření na jiné kauzální agens s jinou mikrobiální citlivostí.
Léčba
Léčba infekčních komplikací SDN musí být poměrně promptní a agresivní, neboť jak bylo již uvedeno, šíření infekce je poměrně rychlé, rychle progreduje do závažných stavů a může vést poměrně záhy k amputacím dolních končetin nebo k rozvoji těžké sepse ohrožující pacienta na životě. Nikdy by neměly být ATB léčeny klinicky neinfikované ulcerace nohou za účelem snížení rizika infekce nebo na podporu jejich hojení.27 Tato léčba by byla zbytečná, mohla by přinést celou řadu nežádoucích účinků a mohla by vést k indukci mikrobiální rezistence.
Nejčastější branou vstupu infekce bývá exkoriace kůže, defekt nebo rána po resekci/amputaci. Pokud se jedná o infekci indukovanou chirurgickým výkonem, řadíme ji mezi tzv. SSI – surgical site infection neboli infekci chirurgického místa. Ta obvykle vzniká kontaminací operačního pole a manifestuje se do 30 dnů od invazivního výkonu. Prevence SSI spočívá v dekolonizaci pacienta (např. přípravky Mupirocin, Actimarys u nosičů Staphylococcus aureus) a v ATB profylaxi v předoperačním období. Perioperačně je třeba provádět řádnou dezinfekci kůže založenou na alkoholických roztocích s chlorhexidinem a další obvyklé metody předoperační přípravy včetně předoperační přípravy pacienta (kompenzace DM), přípravy operačního pole apod.28
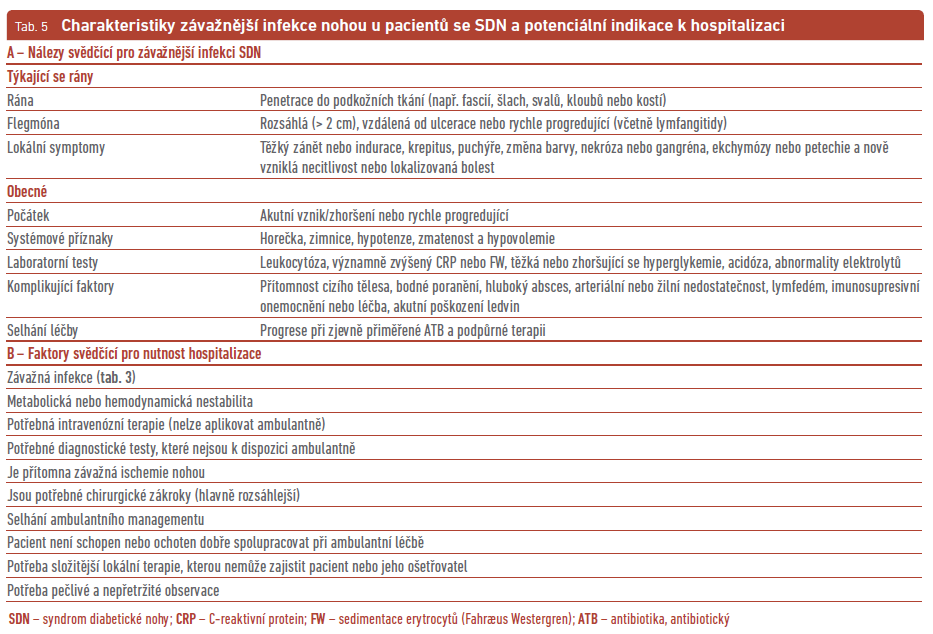
Lehkou infekci SDN lze zvládnout ve většině případů pomocí perorálních ATB, podobně i středně závažnou.29 Ale u nemocných se středně závažnou infekcí a s celkovými příznaky nebo se závažnými komorbiditami je vhodné zvážit hospitalizaci. Ta je plně indikovaná u závažných infekcí. Za hospitalizace můžeme intenzivněji monitorovat nemocné a sledovat lokální a systémové známky infekce; lze urychlit i diagnostiku včetně té vaskulární. Během hospitalizace se podávají parenterální ATB, rehydratace s úpravou iontových dysbalancí, korigují se metabolické a kardiovaskulární komplikace, provádí se řada konziliárních vyšetření včetně chirurgických. Z hospitalizace také mohou těžit i pacienti vyžadující urgentní chirurgický zákrok (např. pro rozsáhlou gangrénu, absces nebo kompartment syndrom), pacienti s pokročilými komorbiditami (např. se závažnou ICHDK, selháním ledvin, imunokompromitovaní) nebo pacienti se sociální, fyzickou nebo psychologickou vulnerabilitou (tab. 5). Pacienty s OM není nutné vždy hospitalizovat. Hospitalizace je vhodná u OM, které jsou komplikovány infekcí měkkých tkání nebo pokud OM vyžaduje speciální diagnostiku nebo chirurgický zákrok.
Dle doporučení lze použít k léčbě infekčních komplikací SDN peniciliny, cefalosporiny, karbapenemy, metronidazol (v kombinace s jiným ATB), klindamycin, linezolid, daptomycin, fluorochinolony nebo vankomycin.1 Pro tigecyklin neexistují přesvědčivá data o účinnosti u infekce SDN, dokonce ve studii Laufa a kol. s velkým počtem nemocných byl tento lék inferiorní oproti jinému ATB.30 Studie Arda a kol. prokázala, že tigecyklin vedl ke zlepšení pouze u 57 % nemocných s pokročilou infekcí v rámci SDN, přičemž horší efektivita byla pozorována především u nemocných s ICHDK.
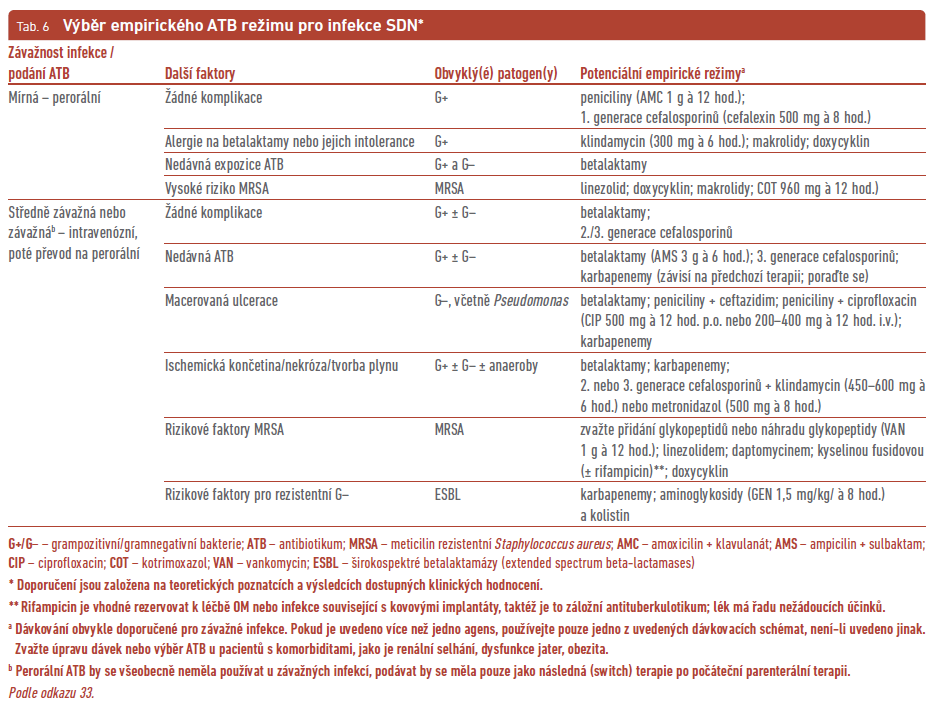
Antibiotika se vybírají podle pravděpodobného výskytu patogenu nebo jasně prokázaného mikrobiálního agens a jeho citlivosti na ATB. Roli při výběru hraje i závažnost infekce, možné nežádoucí účinky ATB terapie včetně střevní dysmikrobie, alergická anamnéza, komorbidity (např. hemodialýza), možné lékové interakce a finanční náklady. U pacientů, kteří nebyli v poslední době léčeni ATB a mají lehkou infekci, by měla být empiricky zvolena ATB léčba zaměřená na grampozitivní patogeny (beta‑hemolytické streptokoky a Staphylococcus aureus, jež byly řadu let hlavními patogeny přítomnými v ulceracích; tab. 6).31,32 Ti, kteří byli léčeni ATB v průběhu posledních několika týdnů, mají pokročilou ICHDK nebo jsou imunokompromitovaní, a ti, již trpí středně závažnou nebo závažnou infekcí diabetické nohy, by měli dostat ATB pokrývající grampozitivní i gramnegativní patogeny, případně anaeroby. Často jsou v tomto případě výsledky kultivací z ran polymikrobiální (tab. 6). Můžeme použít některé novější cefalosporiny (v kombinaci s inhibitory enzymů) a fluorochinolony mající aktivitu proti většině obligátních anaerobů, což by mohlo odstranit nutnost jejich kombinace s antianaerobními agens. Problémem mohou být infekce způsobené Pseudomonas sp., které jsou ambulantně poměrně svízelně léčitelné, prakticky pouze pomocí fluorochinolonů. Často ale vykazuje tato bakterie rezistenci i na řadu parenterálně aplikovatelných ATB. Lékaři by měli vždy zvážit v obtížných případech, jimiž jsou např. infekce způsobené neobvyklými nebo vysoce rezistentními patogeny, konzultaci ATB terapie s infekcionistou a/nebo mikrobiologem (tab. 6).
U lehkých nebo středně závažných infekcí bez závažných komorbidit zvolte perorální ATB, a to v délce podávání 1–2 týdny, popřípadě 3–4 týdny, pokud se infekce sice zmírňuje, ale je rozsáhlá, ustupuje pomaleji nebo pokud má pacient závažnou ICHDK (zpomalující proces hojení a snižující dostupnost ATB v periferních tkáních) nebo imunodeficienci. U závažných infekcí (stupeň 3 a hlavně stupeň 4; tab. 3) je vhodné aplikovat ATB zpočátku parenterálně (k rychlému docílení vysokých sérových koncentrací ATB). Na perorální podávání je vhodné převést léčbu, pokud se pacient klinicky zlepšuje, nemá žádné kontraindikace k perorální terapii a je‑li k dispozici vhodné perorální agens. U středně závažné a závažné infekce je třeba vždy konzultovat chirurga, pokud je přítomna rozsáhlá gangréna, nekrotizující infekce, známky hlubokého (pod fascií) abscesu nebo kompartment syndrom.
Pokud známky infekce neustoupí do čtyř týdnů od zahájení adekvátní terapie, je nutné zvážit aktualizaci diagnostických postupů nebo zvolit jiné či alternativní léčebné postupy, jelikož nechceme pacienty zbytečně dlouho zatěžovat ATB terapií. Ta by kromě diskomfortu mohla pacientovi přinést celou řadu nežádoucích účinků včetně střevní dysmikrobie, dále by i prodražovala terapii SDN.
K léčbě infekce u SDN nemá smysl používat jak lokální antimikrobiální prostředky, tak ATB lokálně. Neexistují přesvědčivá data o účinnosti lokálních prostředků např. s obsahem stříbra, medu apod. v léčbě infekce u SDN. Podobně podtlaková terapie neřeší infekční komplikace. Léčba lokálními ATB může mít řadu výhod – používají se malé dávky, které jsou ale schopny docílit vysokých lokálních koncentrací, jež nepřecházejí do systémového oběhu. Lokální ATB působí pouze v místě infekce, což snižuje nežádoucí účinky a pravděpodobně i rezistenci na ATB. Bohužel, žádné publikované studie nepodporují léčbu mírných nebo středně závažných infekcí tímto způsobem.34 Konkrétně léčba mírné infekce u SDN pexigananem (antimikrobiální peptid)35 nebo léčba středně závažné infekce kolagenovou houbou obohacenou gentamicinem36,37 neprokázaly superioritu ve srovnání se standardní terapií. Ani hyperbarická oxygenoterapie by se neměla objevit jako první volba v léčbě infekce, přestože má kromě příznivého efektu na hojení ran i antimikrobiální účinek. Evidence v této oblasti je prozatím nedostatečná.1
Léčba OM je poněkud složitější. V případě nekomplikované OM s postižením předonoží, kde není třeba provést chirurgický zákrok, lze zvážit konzervativní léčbu. Ta kromě odlehčení, lokální léčby a řešení vaskulárních změn spočívá v ATB terapii. Léčba má být dostatečně dlouhá – minimálně 2–4 týdny, maximálně však 6 týdnů. Delší léčba již dle dostupných studií není efektivní.38 Jedinou výjimkou je OM u osob s infikovaným ortopedickým materiálem nebo s rozsáhlou kostní nekrózou, která není přístupná dostatečnému debridementu. ATB by měla být vždy podávána v maximálních dávkách.1 Pokud se ale nezlepšují klinické nálezy již po 2–4 týdnech, je potřeba zvážit kostní biopsii s následnou změnou ATB terapie, vhodné je pomýšlet i na chirurgickou resekci/amputaci.
Zda léčit OM konzervativně, nebo chirurgicky, je diskutabilní. Ještě před několika lety panoval jasný názor ve prospěch radikálnějšího přístupu – operativy. Nicméně objevily se četné důkazy z několika studií,39–41 které ukazují, že u správně vybraných pacientů je efektivní i konzervativní ATB terapie. Konzervativní léčba OM by měla být zvážena na začátku léčby každého pacienta. Pro konzervativní terapii jsou nejvhodnějšími kandidáty pacienti s OM lokalizovanou v oblasti předonoží, stabilní, u kterých není přítomna deformita vyžadující chirurgický zákrok a pro které existuje vhodný ATB režim.42
Pokud je ale OM rozsáhlejší včetně postižení měkkých tkání, je třeba zkonzultovat chirurga co nejdříve s cílem zjistit, zdali není třeba provést operativní výkon – např. debridement rány, incizi, drenáž, ale i rozsáhlejší nekrektomii, resekci, drenáž abscesových dutin, řešení kompartment syndromu nebo resekci/amputaci kostí. Neodkladnou operaci vyžadují hluboké abscesy, rozsáhlé nekrózy nebo gangrény, přítomnost plynu v tkáních nebo kompartment syndrom. Ostatní změny spojené s OM lze operovat odloženě. Po operativním odstranění infekčního ložiska je doporučována již jen krátkodobá ATB léčba (několik dní – maximálně 1–2 týdny).43 Podmínkou by měl být negativní vzorek kosti odebraný perioperačně z ponechaného kostního skeletu resekované kosti. Toto vyšetření může pomoci odhalit reziduální infekci. Pokud se ve vzorku prokáže reziduální infekce, je třeba postupovat stejně jako v případě dříve diagnostikované OM, tedy přeléčit pacienta ATB po dobu cca 6 týdnů. Několik studií prokázalo, že jedna až dvě třetiny pacientů, u nichž chirurg odebere po resekci vzorek z klinicky neinfikované kosti (z okraje resekční linie), má pozitivní nález reziduální infekce.44,45 Tento nález pravděpodobně odpovídá ponechání infikované kostní tkáně na okraji pahýlu. Ovšem je třeba poznamenat, že vzorek kosti se musí perioperačně odebrat maximálně asepticky, včetně použití nové sady sterilních nástrojů.
Závěr
Infekční komplikace SDN mohou jednoznačně přispět k progresi této pozdní komplikace, která nejenže může zvyšovat frekvenci hospitalizací nemocných se SDN, ale může vyžadovat kromě ATB terapie i řadu dalších úkonů – řadu chirurgických procedur, odlehčení, revaskularizace, ale mnohdy je nutno – zvláště při sepsi způsobené infekcí při SDN – řešit i komorbidity našich již tak křehkých pacientů.
Do budoucna je důležité zrychlit procesy diagnostiky infekčních komplikací, v návaznosti na tíži stavu podat rychleji v adekvátním množství patřičná ATB, pokud to stav vyžaduje, rychle nemocného hospitalizovat s cílem urychlit další diagnosticko‑léčebné procesy. Roli v budoucnu možná budou mít nové ATB režimy nebo např. bakteriofágy (viry napadající bakterie), jejichž nespornou výhodou je, že nezvyšují mikrobiální rezistenci, a další nové organismy nebo nové diagnosticko-lečebné metody.
Podpořeno NU20‑01‑00078
a VZ 00023001.
Literatura
- IWGDF doporučení – https://iwgdfguidelines.org/guidelines.
- Ndosi M, Wright‑Hughes A, Brown S, et al. Prognosis of the infected diabetic foot ulcer: 12‑month prospective observational study. Diabet Med 2018;35:78–88. doi:10.1111/dme.13537.
- Tan TW, Shih CD, Concha‑Moore KC, et al. Disparities in outcomes of patients admitted with diabetic foot infections. PLoS One 2019;14:e0211481. doi: 10.1371/journal.pone.0211481.
- Grigoropoulou P, Eleftheriadou I, Jude EB, Tentolouris N. Diabetic Foot Infections: an Update in Diagnosis and Management. Curr Diab Rep 2017;17:3. doi: 10.1007/s11892‑017‑0831‑1. PMID: 28101794.
- Fejfarová V, Jirkovská A, Dubský M, et al. An Alteration of Lymphocytes Subpopulations and Immunoglobulins Levels in Patients with Diabetic Foot Ulcers Infected Particularly by Resistant Pathogens. J Diabetes Res 2016;2016:2356870. doi: 10.1155/2016/2356870. Epub 2016 Dec 5. PMID: 28050566; PMCID: PMC5165150.
- Wukich DK, Hobizal KB, Brooks MM. Severity of diabetic foot infection and rate of limb salvage. Foot Ankle Int 2013;34:351–358. doi: 10.1177/1071100712467980.
- DOPORUĆENÝ POSTUP PRO PREVENCI, DIAGNOSTIKU A TERAPII SYNDROMU DIABETICKÉ NOHY. www.diab.cz
- Jirkovská A. Syndrom diabetické nohy – co nového přináší aktuální Mezinárodní konsenzus? Aktuální medicína 2020;1:59–64.
- National Institute for Health and Clinical Excellence. Diabetic foot problems: Inpatient management of diabetic foot problems. NICE Guidelines. 2011.
- Centers for Disease Control and Prevention. Diabetes Public Health Resource. Age‑Adjusted Hospital Discharge Rates for Peripheral Arterial Disease (PAD), Ulcer/Inflammation/Infection (ULCER), or Neuropathy as First‑Listed Diagnosis per 1,000 Diabetic Population, United States, 1988–2007. http://www.cdc.gov/diabetes/statistics/hosplea/diabetes_complications/fig2_pop.htm. Accessed 21 Sept 2016.
- Lavery LA, Armstrong DG, Wunderlich RP, et al. Risk factors for foot infections in individuals with diabetes. Diabetes Care 2006;29:1288–1293.
- Ndip A, Lavery LA, Boulton AJM. Diabetic foot disease in people with advanced nephropathy and those on renal dialysis. Curr Diab Rep 2010;10:283–290.
- Ïnce P, Abbas ZG, Lutale JK, et al. Use of the SINBAD classification system and score in comparing outcome of foot ulcer management on three continents. Diabetes Care 2008;31:964–967. doi: 10.2337/dc07‑2367.
- Mills JL Sr, Conte MS, Armstrong DG, et al.; Society for Vascular Surgery Lower Extremity Guidelines Committee. The Society for Vascular Surgery Lower Extremity Threatened Limb Classification System: risk stratification based on wound, ischemia, and foot infection (WIfI). J Vasc Surg 2014;59:220–234. e1‑2. doi: 10.1016/j.jvs.2013.08.003. Epub 2013 Oct 12.
- Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis‑3). JAMA 2016;315:801–810. doi: 10.1001/jama.2016.0287. PMID: 26903338; PMCID: PMC4968574.13.08.003. Epub 2013 Oct 12.
- Armstrong DG, Perales TA, Murff RT, et al. Value of white blood cell count with differential in the acute diabetic foot infection. J Am Podiatr Med Assoc 1996;86:224–227. doi: 10.7547/87507315‑86‑5‑224.
- Park JH, Suh DH, Kim HJ, et al. Role of procalcitonin in infected diabetic foot ulcer. Diabetes Res Clin Pract 2017;128:51–57. doi: 10.1016/j.diabres.2017.04.008.
- Jeandrot A, Richard JL, Combescure C, et al. Serum procalcitonin and C‑reactive protein concentrations to distinguish mildly infected from non‑infected diabetic foot ulcers: a pilot study. Diabetologia 2008;51:347–352. doi: 10.1007/s00125‑007‑0840‑8.
- Nelson A, Wright‑Hughes A, Backhouse MR, et al. CODIFI (Concordance in Diabetic Foot Ulcer Infection): a cross‑sectional study of wound swab versus tissue sampling in infected diabetic foot ulcers in England. BMJ Open 2018;8:e019437. doi: 10.1136/bmjopen‑2017‑019437.
- Lazaro‑Martinez JL, Tardaguila‑Garcia A, Garcia‑Klepzig JL. Diagnostic and therapeutic update on diabetic foot osteomyelitis. Endocrinol Diabetes Nutr 2017;64:100–108. doi: 10.1016/j.endinu.2016.10.008.
- Lam K, van Asten SA, Nguyen T, et al. Diagnostic Accuracy of Probe to Bone to Detect Osteomyelitis in the Diabetic Foot: A Systematic Review. Clin Infect Dis 2016;63:944–948. doi: 10.1093/cid/ciw445.
- Dinh MT, Abad CL, Safdar N. Diagnostic accuracy of the physical examination and imaging tests for osteomyelitis underlying diabetic foot ulcers: meta‑analysis. Clin Infect Dis 2008;47:519–527. doi: 10.1086/590011.
- Lauri C, Tamminga M, Glaudemans A, et al. Detection of Osteomyelitis in the Diabetic Foot by Imaging Techniques: A Systematic Review and Meta‑analysis Comparing MRI, White Blood Cell Scintigraphy, and FDG‑PET. Diabetes Care 2017;40:1111–1120. doi: 10.2337/dc17‑0532.
- Ertugrul MB, Baktiroglu S, Salman S, et al. Pathogens isolated from deep soft tissue and bone in patients with diabetic foot infections. J Am Podiatr Med Assoc 2008;98:290–295. doi: 10.7547/0980290.
- Senneville E, Morant H, Descamps D, et al. Needle puncture and transcutaneous bone biopsy cultures are inconsistent in patients with diabetes and suspected osteomyelitis of the foot. Clin Infect Dis 2009;48:888–893. doi: 10.1086/597263.
- Wosková V, Jirkovská A, Bém R, et al. A COMPARISON OF BONE HISTOPATHOLOGY AND MICROBIOLOGY IN THE DIABETIC PATIENT WITH SUSPECTED FOOT OSTEOMYELITIS. Abstrakt in Abstract book DFSG, 16. symposium DFSG 2020‑ virtual, https://dfsg.org/fileadmin/user_upload/DFSG/Documents/Final_abstract_and_programme_book_DFSG_2020.pdf.
- Abbas M, Uçkay I, Lipsky BA. In diabetic foot infections antibiotics are to treat infection, not to heal wounds. Expert Opin Pharmacother 2015;16:821–832. doi: 10.1517/14656566.2015.1021780.
- Global guidelines for the prevention of surgical site infection, WHO 2018, ISBN 978‑92‑4‑155047‑5.
- Barwell ND, Devers MC, Kennon B, et al. Diabetic foot infection: Antibiotic therapy and good practice recommendations. Int J Clin Pract 2017;71. doi: 10.1111/ijcp.13006.
- Lauf L, Ozsvár Z, Mitha I, et al. Phase 3 study comparing tigecycline and ertapenem in patients with diabetic foot infections with and without osteomyelitis. Diagn Microbiol Infect Dis 2014;78:469–480. doi: 10.1016/j.diagmicrobio.2013.12.007.
- Fejfarová V, Jirkovská A, Petkov V, et al. Comparison of microbial findings and resistance to antibiotics between transplant patients, patients on hemodialysis, and other patients with the diabetic foot. J Diabetes Complications 2004;18:108–112. doi: 10.1016/S1056‑8727(02)00276‑3. PMID: 15120705.
- Spellberg B, Lipsky BA. Systemic antibiotic therapy for chronic osteomyelitis in adults. Clin Infect Dis 2012;54:393–407. doi: 10.1093/cid/cir842.
- Lipsky BA, Berendt AR, Cornia PB, et al.; Infectious Diseases Society of America. 2012 Infectious Diseases Society of America clinical practice guideline for the diagnosis and treatment of diabetic foot infections. Clin Infect Dis 2012;54:e132–173. doi: 10.1093/cid/cis346. PMID: 22619242.
- Dumville JC, Lipsky BA, Hoey C, et al. Topical antimicrobial agents for treating foot ulcers in people with diabetes. Cochrane Database Syst Rev 2017;6:Cd011038. doi: 10.1002/14651858.CD011038.pub2.
- Pexiganan Versus Placebo Control for the Treatment of Mild Infections of Diabetic Foot Ulcers (OneStep‑2). 2017; https://clinicaltrials.gov/ct2/show/NCT01594762.
- Safety and Efficacy of an Antibiotic Sponge in Diabetic Patients With a Mild Infection of a Foot Ulcer. 2012; https://clinicaltrials.gov/ct2/show/NCT00593567.
- Uçkay I, Kressmann B, Malacarne S, et al. A randomized, controlled study to investigate the efficacy and safety of a topical gentamicin‑collagen sponge in combination with systemic antibiotic therapy in diabetic patients with a moderate or severe foot ulcer infection. BMC Infect Dis 2018;18:361. doi: 10.1186/s12879‑018‑3253‑z.
- Tone A, Nguyen S, Devemy F, et al. Six‑week versus twelve‑week antibiotic therapy for nonsurgically treated diabetic foot osteomyelitis: a multicenter open‑label controlled randomized study. Diabetes Care 2015;38:302–307. doi: 10.2337/dc14‑1514.
- Senneville E, Lombart A, Beltrand E, et al. Outcome of diabetic foot osteomyelitis treated nonsurgically: a retrospective cohort study. Diabetes Care 2008;31:637–642. doi: 10.2337/dc07‑1744.
- Acharya S, Soliman M, Egun A, Rajbhandari SM. Conservative management of diabetic foot osteomyelitis. Diabetes Res Clin Pract 2013;101:e18–20. doi: 10.1016/j.diabres.2013.06.010.
- Lázaro‑Martínez JL, Aragón‑Sánchez J, García‑Morales E. Antibiotics versus conservative surgery for treating diabetic foot osteomyelitis: a randomized comparative trial. Diabetes Care 2014;37:789–795. doi: 10.2337/dc13‑1526.
- Lipsky BA. Treating diabetic foot osteomyelitis primarily with surgery or antibiotics: have we answered the question? Diabetes Care 2014;37:593–595. doi: 10.2337/dc13‑2510.
- Senneville E, Nguyen S. Current pharmacotherapy options for osteomyelitis: convergences, divergences and lessons to be drawn. Expert Opin Pharmacother 2013;14:723–734. doi: 10.1517/14656566.2013.780596.
- Mijuskovic B, Kuehl R, Widmer AF, et al. Culture of Bone Biopsy Specimens Overestimates Rate of Residual Osteomyelitis After Toe or Forefoot Amputation. J Bone Joint Surg Am 2018;100:1448–1454. doi: 10.2106/jbjs.17.01152.
- Schmidt BM, McHugh JB, Patel RM, Wrobel JS. Prospective Analysis of Surgical Bone Margins After Partial Foot Amputation in Diabetic Patients Admitted With Moderate to Severe Foot Infections. Foot Ankle Spec 2019;12:131–137. doi: 10.1177/1938640018770285.