Endoskopická resekce neoplastických lézí
Úvod
Digestivní endoskopie prošla v posledních letech bouřlivým vývojem a má v dnešní době zásadní vliv na diagnostiku, prevenci a léčbu onkologických onemocnění trávicího traktu. Jednou z oblastí, ve které hraje digestivní endoskopie velice důležitou roli, je vliv na výskyt kolorektálního karcinomu (KRK). Za poslední desítky let jsme byli svědky setrvalého nárůstu incidence a mortality u tohoto typu nádoru. Toto se začalo významně měnit s nástupem screeningových programů. Díky nim je možno zachytit premaligní léze a časné malignity, což umožňuje nejen méně náročnou léčbu pro pacienty, ale také snižuje zátěž pro zdravotní systém a je ekonomicky příznivější.
Díky pokroku v endoskopických technikách můžeme nyní řešit část onemocnění, která by dříve vyžadovala chirurgický zákrok, endoskopicky bez nutnosti operační revize. To platí například v terapii komplikací akutní pankreatitidy, kde bylo dosaženo významných úspěchů. Stejně je nyní možné endoskopickými metodami léčit časné karcinomy a rozsáhlé neoplastické léze.
Avšak zásadním bodem zůstává včasná detekce těchto lézí. V případě kolorektálního karcinomu závisí úspěch nejen na systematické erudici endoskopistů, ale i na spolupráci veřejnosti v rámci screeningových programů.
Neoplastické léze v gastrointestinálním traktu
Většina malignit v trávicí trubici vzniká postupně z premaligních lézí, což podtrhuje důležitost jejich včasné detekce a správného popisu. Již profesor Mařatka zdůraznil, že je potřebné vypracování a využívání jednotné terminologie, aby bylo možné pacienty správně léčit i výsledky léčby zpětně hodnotit.
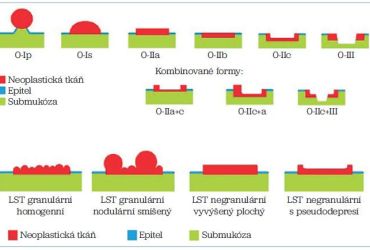 Ke klasifikaci povrchových neoplazií využíváme nyní Pařížskou klasifikaci. Tato klasifikace byla schválena na mezinárodním kongresu v Paříži v roce 2003 a její základ vychází z japonské endoskopické klasifikace povrchových nádorových lézí. Klasifikace se týká časných povrchových lézí postihujících sliznici nebo s invazí do submukózy, které jsou dle makroskopického vzhledu děleny na podtypy (obr. 1):
Ke klasifikaci povrchových neoplazií využíváme nyní Pařížskou klasifikaci. Tato klasifikace byla schválena na mezinárodním kongresu v Paříži v roce 2003 a její základ vychází z japonské endoskopické klasifikace povrchových nádorových lézí. Klasifikace se týká časných povrchových lézí postihujících sliznici nebo s invazí do submukózy, které jsou dle makroskopického vzhledu děleny na podtypy (obr. 1):
Povrchové léze – typ 0
Polypoidní léze (typ 0‑I)
- stopkaté (typ 0‑Ip)
- přisedlé (sesilní, typ 0‑Is)
Ploché léze (typ 0‑II)
- lehce vyvýšené (typ 0‑IIa)
- v úrovni sliznice (typ 0‑IIb)
- lehce vkleslé (typ 0‑IIc)
Vyhloubené léze (typ 0‑III)
Léze typu 0‑IIa se mohou šířit horizontálně (kobercovitě) po sliznici a dosahovat velkých velikostí, mnohdy až několika centimetrů, výjimečně mohou postihnout i takřka celou cirkumferenci. Tento typ lézí označujeme jako laterally spreading tumor (LST). Tyto se dále dělí na typ granulární (podtyp homogenní – LST‑GH – a nodulární smíšený – LST‑GM) a negranulární (podtyp vyvýšený – LST‑NG – a s pseudodepresí – LST‑NG‑PD). Granulární nodulární smíšený typ a negranulární s pseudodepresí jsou zatíženy nejvyšším rizikem rozvoje invazivní malignity.
Kromě toho existují také kombinované léze, například 0‑IIa+IIc (vyvýšená plochá léze s centrální vkleslinou), takto se dají označovat i některé LST léze.
V diagnostice a klasifikaci neoplastických lézí hraje důležitou roli nejen popis jejich tvaru, ale i povrchové struktury. Zde došlo k výraznému rozvoji po zavedení zvětšovacích a high‑resolution endoskopů s přispěním chromoendoskopie. Klasická chromoendoskopie využívá aplikaci barviva (indigokarmín, methylenová modř, Lugolův roztok atd.) na sliznici ke zvýraznění povrchové kresby sliznice, virtuální chromoendoskopie k tomuto účelu využívá speciální barevné filtry ve světelném zdroji či softwarové zpracování obrazu.
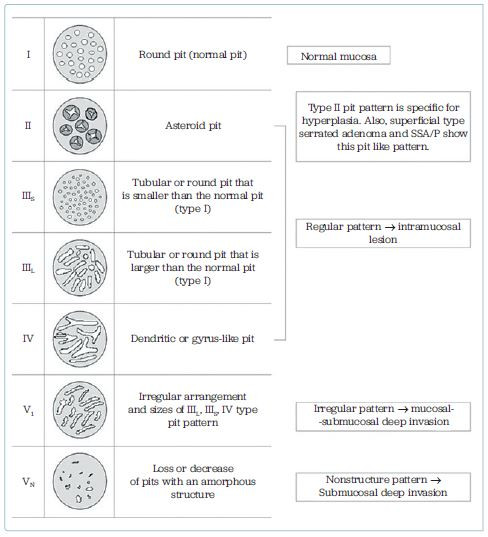 K predikci závažnosti léze dle povrchové struktury se nejčastěji používá systém klasifikace „pit pattern” navržený Kudem, popřípadě klasifikace NICE, resp. JNET. Kudova „pit pattern” klasifikace využívá kombinaci chromoendoskopie (methylenová modř nebo indigokarmín) a zvětšovací endoskopie k popisu uspořádání ústí krypt v závislosti na biologickém chování léze. Alternativně je možno použít i virtuální chromodiagnostiku. Klasifikace má pět stupňů, kde první dva stupně, které mají pravidelně rozložené krypty, představují normální sliznici a hyperplastický polyp. Další tři stupně jsou neoplastické léze a jsou charakterizovány různou nepravidelností v povrchové architektuře (obr. 2).
K predikci závažnosti léze dle povrchové struktury se nejčastěji používá systém klasifikace „pit pattern” navržený Kudem, popřípadě klasifikace NICE, resp. JNET. Kudova „pit pattern” klasifikace využívá kombinaci chromoendoskopie (methylenová modř nebo indigokarmín) a zvětšovací endoskopie k popisu uspořádání ústí krypt v závislosti na biologickém chování léze. Alternativně je možno použít i virtuální chromodiagnostiku. Klasifikace má pět stupňů, kde první dva stupně, které mají pravidelně rozložené krypty, představují normální sliznici a hyperplastický polyp. Další tři stupně jsou neoplastické léze a jsou charakterizovány různou nepravidelností v povrchové architektuře (obr. 2).
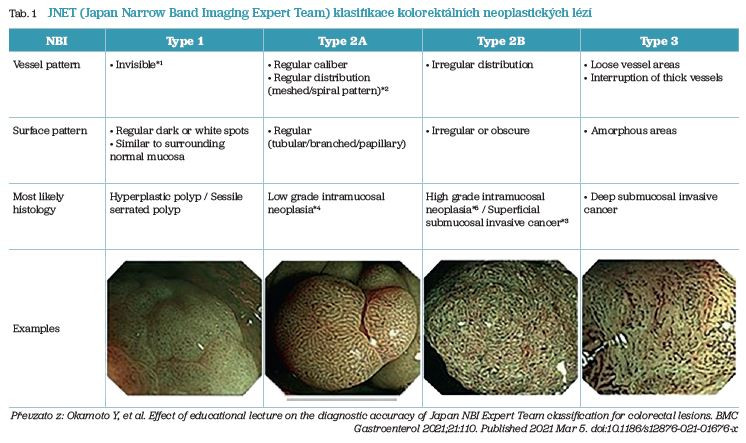 Novější možností je využití NICE (Narrow‑Band Imaging International Colorectal Endoscopic) kritérií k diagnostice dysplazie. Tento systém využívá úzkopásmové zobrazování (Narrow Band Imaging – NBI) k posouzení nejen struktury ústí krypt, ale i vaskulární kresby sliznice. Rozlišuje tři kategorie: 1 – hyperplastická léze či serátní adenom, 2 – adenom, 3 – susp. invazivní léze. V roce 2014 byla publikována JNET (Japan Narrow Band Imaging Expert Team) klasifikace, která typ 2 ještě rozděluje na podtyp 2A odpovídající low‑grade adenomu a podtyp 2B reprezentující high‑grade adenom či časný karcinom (tab. 1).
Novější možností je využití NICE (Narrow‑Band Imaging International Colorectal Endoscopic) kritérií k diagnostice dysplazie. Tento systém využívá úzkopásmové zobrazování (Narrow Band Imaging – NBI) k posouzení nejen struktury ústí krypt, ale i vaskulární kresby sliznice. Rozlišuje tři kategorie: 1 – hyperplastická léze či serátní adenom, 2 – adenom, 3 – susp. invazivní léze. V roce 2014 byla publikována JNET (Japan Narrow Band Imaging Expert Team) klasifikace, která typ 2 ještě rozděluje na podtyp 2A odpovídající low‑grade adenomu a podtyp 2B reprezentující high‑grade adenom či časný karcinom (tab. 1).
Senzitivita při odlišení neoplazie od non‑neoplastické léze se uvádí 98,1–99,8 %, specificita potom je 84,7–98,2 %. Specificita v odlišení hlubokého submukózního karcinomu od jiné neoplazie je 99,8–100,0 %. Uvedené klasifikace dopomáhají endoskopistům identifikovat a popsat prakticky všechny neoplazie a určit, zda je nutno provést en bloc resekci, či nikoli, a tím se vyhnout zbytečné operaci.
Léze v tračníku vhodné k endoskopické resekční léčbě je doporučeno nebioptovat pro riziko rozvoje fibrotických změn ve spodině pod lézí, které by mohly značně komplikovat až znemožnit provedení endoskopické resekce. Naopak malignizované léze s hlubokou invazí, které není možno kurativně odstranit endoskopicky (tedy NICE/JNET 3, popř. Kudo Vn), je naopak vhodné bioptovat, ev. i označit tetováží pro snadnější orientaci při operaci, jsou totiž indikovány přímo k chirurgické resekci.5 V případě lézí v horním gastrointestinálním traktu (GIT) je tomu jinak, zde je riziko rozvoje fibrózy pod lézí nižší, a biopsie jsou tedy obecně doporučovány.
Kromě toho existují zvláštní případy preneoplastických a neoplastických lézí, které vyžadují specifický přístup. Například u Barrettova jícnu se zaměřujeme na důsledné endoskopické sledování a při detekci nodularit pak přistupujeme k jejich včasné resekci, aby se předešlo progresi k malignitě. Zbývající plochý segment Barrettovy sliznice poté může být v případě dysplazie ošetřen některou z ablačních metod, nejčastěji radiofrekvenční ablací (RFA). Benigní novotvary, např. lipomy, mohou být také endoskopicky odstraněny, zejména při velikosti nad 2 cm, kdy jsou již spojeny s rizikem intususcepce, popř. mohou způsobovat pasážové potíže.
Správné rozpoznání a klasifikace neoplastických lézí v GIT jsou klíčové pro úspěšnou prevenci a léčbu maligních onemocnění, a proto je endoskopie v tomto ohledu nedocenitelným nástrojem.
Přehled resekčních technik
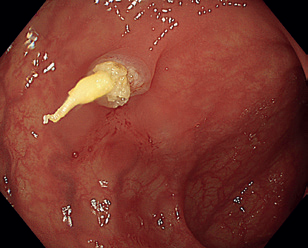
 Endoskopická polypektomie (EPE) představuje základní a nejčastěji využívanou terapeutickou proceduru v oblasti gastrointestinální endoskopie. Princip EPE spočívá v naložení polypektomické kličky na stopku stopkatého polypu (0‑Ip), která je tvořena zdravou sliznicí a submukózou, následně je tato stopka přerušena kombinací mechanické síly při uzavření smyčky a elektrického koagulačního proudu (technika známá jako „hot snare“) (obr. 3–5). U rizikových polypů (šíře stopky nad 10 mm či velikost polypu nad 20 mm) se pro minimalizaci rizika krvácení doporučuje před resekcí stopku infiltrovat roztokem adrenalinu, popř. na stopku naložit endoklipy nebo použít odnímatelnou smyčku, známou též jako „endoloop“, která po resekci polypu zůstává na stopce (obr. 6). EPE se často využívá i pro resekci malých plochých nebo přisedlých lézí (0‑IIa, 0‑Is) s průměrem ≤ 10 mm (obr. 7), a to obvykle pouze v mechanickém režimu bez využití elektrické koagulace (technika známá jako „cold snare“). Tato metoda snižuje riziko pozdějšího krvácení a vzniku koagulačního syndromu. „Resekce“ diminutivních lézí pomocí bioptických kleští, běžně používaná v minulosti, byla do značné míry opuštěna pro riziko inkompletní resekce a nahrazena právě „cold snare“ polypektomií. Klešťovou resekci je nadále možno použít jen u lézí do velikosti 3 mm. Použití elektrokoagulačních kleští („hot forceps”) se obecně nedoporučuje.
Endoskopická polypektomie (EPE) představuje základní a nejčastěji využívanou terapeutickou proceduru v oblasti gastrointestinální endoskopie. Princip EPE spočívá v naložení polypektomické kličky na stopku stopkatého polypu (0‑Ip), která je tvořena zdravou sliznicí a submukózou, následně je tato stopka přerušena kombinací mechanické síly při uzavření smyčky a elektrického koagulačního proudu (technika známá jako „hot snare“) (obr. 3–5). U rizikových polypů (šíře stopky nad 10 mm či velikost polypu nad 20 mm) se pro minimalizaci rizika krvácení doporučuje před resekcí stopku infiltrovat roztokem adrenalinu, popř. na stopku naložit endoklipy nebo použít odnímatelnou smyčku, známou též jako „endoloop“, která po resekci polypu zůstává na stopce (obr. 6). EPE se často využívá i pro resekci malých plochých nebo přisedlých lézí (0‑IIa, 0‑Is) s průměrem ≤ 10 mm (obr. 7), a to obvykle pouze v mechanickém režimu bez využití elektrické koagulace (technika známá jako „cold snare“). Tato metoda snižuje riziko pozdějšího krvácení a vzniku koagulačního syndromu. „Resekce“ diminutivních lézí pomocí bioptických kleští, běžně používaná v minulosti, byla do značné míry opuštěna pro riziko inkompletní resekce a nahrazena právě „cold snare“ polypektomií. Klešťovou resekci je nadále možno použít jen u lézí do velikosti 3 mm. Použití elektrokoagulačních kleští („hot forceps”) se obecně nedoporučuje.
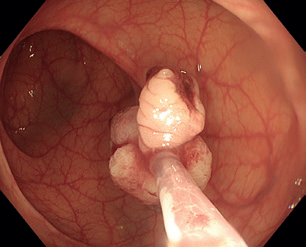
 Endoskopická slizniční resekce (EMR) je specializovanou technikou pro odstranění povrchových gastrointestinálních lézí, vyvinutou v 50. letech pro sigmoideoskopii a později rozšířenou na kolonoskopii, a nakonec na celý trávicí trakt. Zejména u plochých lézí je výhodné označení okrajů koagulačními body k zajištění odstranění celé léze. Využívá se zejména pro léze větší než 10 mm, které nejsou vhodné pro klasickou polypektomii. Principem EMR je vytvoření pseudopolypu z nepolypoidní léze, což umožňuje lézi zachytit a odstranit pomocí polypektomické kličky.
Endoskopická slizniční resekce (EMR) je specializovanou technikou pro odstranění povrchových gastrointestinálních lézí, vyvinutou v 50. letech pro sigmoideoskopii a později rozšířenou na kolonoskopii, a nakonec na celý trávicí trakt. Zejména u plochých lézí je výhodné označení okrajů koagulačními body k zajištění odstranění celé léze. Využívá se zejména pro léze větší než 10 mm, které nejsou vhodné pro klasickou polypektomii. Principem EMR je vytvoření pseudopolypu z nepolypoidní léze, což umožňuje lézi zachytit a odstranit pomocí polypektomické kličky.
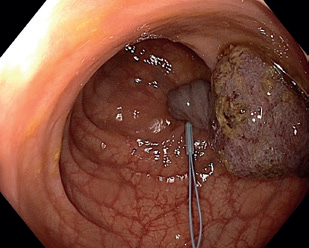
 EMR zahrnuje několik technik. Nejběžnější je technika „lift and cut“, při které se provádí submukózní injekce různých roztoků vedoucí ke zvednutí léze s následným uchopením a odstraněním kličkou (obr. 8–11). Submukózní injekce může obsahovat fyziologický roztok, glukózu a glycerol, zředěný adrenalin nebo gelatinózní látky. Pro lepší orientaci v submukóze se do roztoku často přidává modré barvivo, jako je methylenová modř nebo indigokarmín. Zvednutí léze dané rozšířením submukózy se označuje jako „lifting.“ V případě fibrózy nebo hluboké nádorové invaze dochází k „liftingu” jen částečně nebo vůbec, odstranění léze je poté obtížné až nemožné.
EMR zahrnuje několik technik. Nejběžnější je technika „lift and cut“, při které se provádí submukózní injekce různých roztoků vedoucí ke zvednutí léze s následným uchopením a odstraněním kličkou (obr. 8–11). Submukózní injekce může obsahovat fyziologický roztok, glukózu a glycerol, zředěný adrenalin nebo gelatinózní látky. Pro lepší orientaci v submukóze se do roztoku často přidává modré barvivo, jako je methylenová modř nebo indigokarmín. Zvednutí léze dané rozšířením submukózy se označuje jako „lifting.“ V případě fibrózy nebo hluboké nádorové invaze dochází k „liftingu” jen částečně nebo vůbec, odstranění léze je poté obtížné až nemožné.
 Další EMR technikou je metoda „suck and cut“ (EMR‑C) založená na použití průhledného nástavce se speciální kličkou, která je uzavřena po nasátí léze do nástavce. Podobnou technikou je vytvoření pseudopolypu pomocí ligátoru a následná resekce kličkou (EMR‑L, „ligate and cut“). Tyto metody mají své použití zejména v jícnu, například k resekci nodularit v Barrettově jícnu či časného karcinomu.
Další EMR technikou je metoda „suck and cut“ (EMR‑C) založená na použití průhledného nástavce se speciální kličkou, která je uzavřena po nasátí léze do nástavce. Podobnou technikou je vytvoření pseudopolypu pomocí ligátoru a následná resekce kličkou (EMR‑L, „ligate and cut“). Tyto metody mají své použití zejména v jícnu, například k resekci nodularit v Barrettově jícnu či časného karcinomu.
 Relativně novou a perspektivní možností je EMR pod vodou („underwater”), což zahrnuje naplnění střevního lumen vodou a následnou resekci nařasené léze bez nutnosti submukózní injekce.
Relativně novou a perspektivní možností je EMR pod vodou („underwater”), což zahrnuje naplnění střevního lumen vodou a následnou resekci nařasené léze bez nutnosti submukózní injekce.
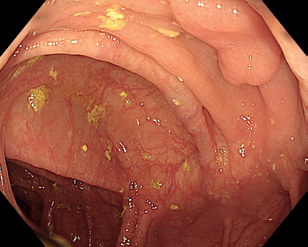 V klinické praxi se EMR používá pro resekci v jednom kuse („en bloc”) lézí menších než 20–25 mm, které lze bezpečně zachytit kličkou, a dále pro resekci rozsáhlých nízkorizikových lézí (LST‑GH) po částech („piecemeal”). Spodinu po resekci je možné preventivně ošetřit pomocí endoklipů, což snižuje riziko pozdního krvácení u rizikových lézí (např. lokalizovaných v pravé části tlustého střeva, u lézí větších než 20 mm nebo u pacientů užívajících antitrombotika). Někteří autoři doporučují ošetření resekčních okrajů u piecemeal resekcí pomocí koagulace špičkou kličky nebo koagulací argonovou plazmou (APC) s cílem snížit výskyt recidivy, nicméně výsledky nejsou dosud jednoznačné.
V klinické praxi se EMR používá pro resekci v jednom kuse („en bloc”) lézí menších než 20–25 mm, které lze bezpečně zachytit kličkou, a dále pro resekci rozsáhlých nízkorizikových lézí (LST‑GH) po částech („piecemeal”). Spodinu po resekci je možné preventivně ošetřit pomocí endoklipů, což snižuje riziko pozdního krvácení u rizikových lézí (např. lokalizovaných v pravé části tlustého střeva, u lézí větších než 20 mm nebo u pacientů užívajících antitrombotika). Někteří autoři doporučují ošetření resekčních okrajů u piecemeal resekcí pomocí koagulace špičkou kličky nebo koagulací argonovou plazmou (APC) s cílem snížit výskyt recidivy, nicméně výsledky nejsou dosud jednoznačné.
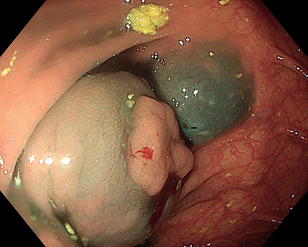 Přestože má EMR jisté limity (např. velikost léze při pokusu o en bloc resekci), jedná se o účinný a bezpečný postup pro většinu časných neoplastických lézí. Výhodou EMR je kratší čas výkonu a nízká míra komplikací (zejm. opožděné krvácení a perforace). Komplikovanější případy by měly být referovány do vysokokapacitních center, kde jsou zatíženy menším rizikem recidivy i komplikací.
Přestože má EMR jisté limity (např. velikost léze při pokusu o en bloc resekci), jedná se o účinný a bezpečný postup pro většinu časných neoplastických lézí. Výhodou EMR je kratší čas výkonu a nízká míra komplikací (zejm. opožděné krvácení a perforace). Komplikovanější případy by měly být referovány do vysokokapacitních center, kde jsou zatíženy menším rizikem recidivy i komplikací.
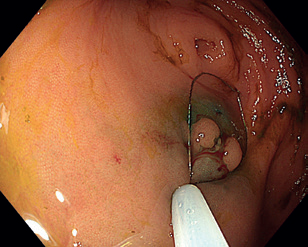
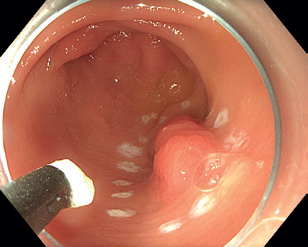
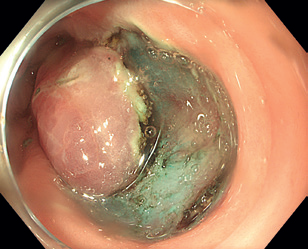
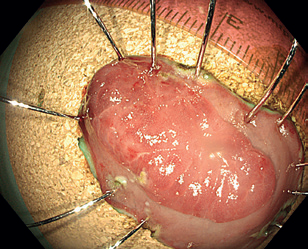
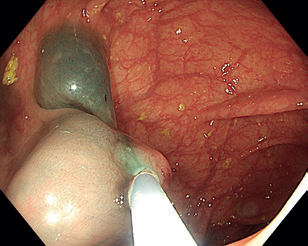 Endoskopická submukózní disekce (ESD) představuje další pokrok v resekcích neoplastických lézí s většími rozměry, které není možné odstranit endoskopickou slizniční resekcí en bloc. ESD, která byla vyvinuta v Japonsku pro léčbu časného karcinomu žaludku, umožňuje en bloc resekci i u větších lézí. Tato metoda spočívá v submukózní injekci následované cirkulární incizí sliznice okolo léze a postupnou disekcí v submukózní vrstvě pod lézí, což umožňuje získat en bloc vzorek bez omezení velikosti léze (obr. 12–14). Při výkonu se používá endoskop s nasazeným nástavcem („cap”) pro lepší přehled v terénu, samotná disekce se provádí pomocí různých typů specializovaných nožů, některé z nich mají i možnost přímé submukózní injekce během výkonu bez nutnosti měnit nástroj.
Endoskopická submukózní disekce (ESD) představuje další pokrok v resekcích neoplastických lézí s většími rozměry, které není možné odstranit endoskopickou slizniční resekcí en bloc. ESD, která byla vyvinuta v Japonsku pro léčbu časného karcinomu žaludku, umožňuje en bloc resekci i u větších lézí. Tato metoda spočívá v submukózní injekci následované cirkulární incizí sliznice okolo léze a postupnou disekcí v submukózní vrstvě pod lézí, což umožňuje získat en bloc vzorek bez omezení velikosti léze (obr. 12–14). Při výkonu se používá endoskop s nasazeným nástavcem („cap”) pro lepší přehled v terénu, samotná disekce se provádí pomocí různých typů specializovaných nožů, některé z nich mají i možnost přímé submukózní injekce během výkonu bez nutnosti měnit nástroj.
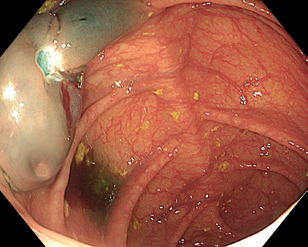 I když ESD nabízí výhody v podobě en bloc resekce a spolehlivé histologické diagnózy, je technicky i časově výrazně náročnější. Procedurální složitost závisí na různých faktorech, včetně zkušeností endoskopisty a přístupu k lézi.
I když ESD nabízí výhody v podobě en bloc resekce a spolehlivé histologické diagnózy, je technicky i časově výrazně náročnější. Procedurální složitost závisí na různých faktorech, včetně zkušeností endoskopisty a přístupu k lézi.
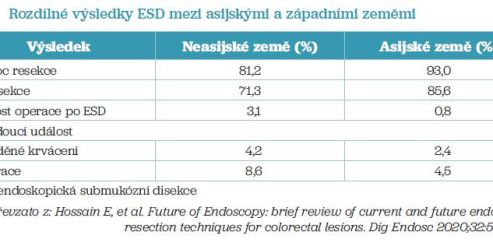 Japonská doporučení zmiňují ESD jako standardní techniku pro velké neoplastické léze, v Evropě se pro technickou obtížnost a delší dobu nutnou ke zvládnutí metody prosadila až později, nicméně je již také dobře zavedena. Tato metoda je spojena s vyšší mírou komplikací ve srovnání s EMR, ovšem v asijských zemích, zejména v Japonsku a v Jižní Koreji, jsou výsledky pro bohaté zkušenosti výrazně lepší (tab. 2).
Japonská doporučení zmiňují ESD jako standardní techniku pro velké neoplastické léze, v Evropě se pro technickou obtížnost a delší dobu nutnou ke zvládnutí metody prosadila až později, nicméně je již také dobře zavedena. Tato metoda je spojena s vyšší mírou komplikací ve srovnání s EMR, ovšem v asijských zemích, zejména v Japonsku a v Jižní Koreji, jsou výsledky pro bohaté zkušenosti výrazně lepší (tab. 2).
 Endoskopická submukózní disekce má celou řadu modifikací, za zmínku stojí zejména metoda „pocket creation”, kde se z malé incize postupně disekuje pod lézí submukózní tunel – „kapsa” – a po disekci celé léze je následně dokončena slizniční incize. Tato metoda je vhodná například pro nestabilní polohy endoskopu. Vznikly i další modifikace s cílem techniku zjednodušit, například „precut EMR” (EMR‑P) a metoda hybridní ESD („simplified ESD”, S‑ESD). Při EMR‑P je provedena cirkulární incize jako při ESD, poté je do incize vložena klička a léze je resekována. Při S‑ESD je po cirkulární incizi provedena částečná disekce cirkulárně směrem k centru léze, která je následně resekována kličkou.
Endoskopická submukózní disekce má celou řadu modifikací, za zmínku stojí zejména metoda „pocket creation”, kde se z malé incize postupně disekuje pod lézí submukózní tunel – „kapsa” – a po disekci celé léze je následně dokončena slizniční incize. Tato metoda je vhodná například pro nestabilní polohy endoskopu. Vznikly i další modifikace s cílem techniku zjednodušit, například „precut EMR” (EMR‑P) a metoda hybridní ESD („simplified ESD”, S‑ESD). Při EMR‑P je provedena cirkulární incize jako při ESD, poté je do incize vložena klička a léze je resekována. Při S‑ESD je po cirkulární incizi provedena částečná disekce cirkulárně směrem k centru léze, která je následně resekována kličkou.
 Endoskopická transmurální resekce (full‑thickness resection, FTR) představuje jistou formu evropské „odpovědi” na japonskou metodu ESD. Ostatní metody (zejm. EMR a ESD) jsou limitovány na povrchové vrstvy střevní stěny, v některých případech toto ale není dostatečné. Příkladem může být výrazná fibróza pod lézí znemožňující resekci, popřípadě léze vycházející z hlubších vrstev stěny. FTR umožňuje provést resekci celé šíře střevní stěny, a to bez vytvoření volné perforace. Původní nástroje byly velmi objemné, a tedy značně komplikovaly manévrovací schopnost endoskopu, toto se změnilo s představením OTSC klipů (over‑the‑scope‑clip). S jejich použitím bylo vyvinuto zařízení na FTR (FTRD – FTR device). Jedná se o jednokrokový resekční přístroj kombinující modifikovaný OTSC klip nasazený na průhledný nástavec s předinstalovanou kličkou.
Endoskopická transmurální resekce (full‑thickness resection, FTR) představuje jistou formu evropské „odpovědi” na japonskou metodu ESD. Ostatní metody (zejm. EMR a ESD) jsou limitovány na povrchové vrstvy střevní stěny, v některých případech toto ale není dostatečné. Příkladem může být výrazná fibróza pod lézí znemožňující resekci, popřípadě léze vycházející z hlubších vrstev stěny. FTR umožňuje provést resekci celé šíře střevní stěny, a to bez vytvoření volné perforace. Původní nástroje byly velmi objemné, a tedy značně komplikovaly manévrovací schopnost endoskopu, toto se změnilo s představením OTSC klipů (over‑the‑scope‑clip). S jejich použitím bylo vyvinuto zařízení na FTR (FTRD – FTR device). Jedná se o jednokrokový resekční přístroj kombinující modifikovaný OTSC klip nasazený na průhledný nástavec s předinstalovanou kličkou.
Samotná FTR začíná označením léze koagulačními body, následně se nasadí FTRD a přístroj se znovu zavede do místa léze. Ta je vtažena do nástavce s celou šířkou stěny a poté je naložen klip, který takto komprimuje duplikaturu střevní stěny vtaženou do nástavce. Po uvolnění klipu se stáhne klička a léze se odstraní za použití elektrického řezacího proudu. Takto vytvořená perforace je tedy uzavřena ještě předtím, než vznikne.
FTR se používá nejen u lézí s výraznou fibrózou, ale může být také vhodná u lézí v rizikových anatomických lokalitách, jako je v blízkosti divertiklu nebo v apendikulárním ústí. Další možné použití je v horním GIT pro resekci submukózních nádorů, jako jsou neuroendokrinní tumory (NET) a gastrointestinální stromální tumory (GIST).
Jedním z hlavních omezení této techniky je velikost léze, která by neměla přesáhnout 25–30 mm. Větší léze jsou zatíženy rizikem inkompletní resekce, zvláště když flexibilita endoskopu a celková viditelnost jsou značně omezeny při nasazeném nástavci.
 Endoskopická resekce v submukózním tunelu (submucosal tunneling endoscopic resection, STER) je metoda vhodná k resekci lézí submukózně uložených a pocházejících z muscularis propria, vychází z techniky „pocket creation” ESD. Podobně jako při této metodě se provede krátká slizniční incize, následně se preparací v submukóze vytvoří „tunel” až k lézi, která se odstraní bez poškození slizničního krytu nad lézí. Vstup do tunelu je poté uzavřen klipy. Technika se podobá metodě POEM (perorální endoskopická myotomie) určené k léčbě achalázie jícnu. V našich podmínkách se jedná o metodu mladou a poměrně málo používanou.
Endoskopická resekce v submukózním tunelu (submucosal tunneling endoscopic resection, STER) je metoda vhodná k resekci lézí submukózně uložených a pocházejících z muscularis propria, vychází z techniky „pocket creation” ESD. Podobně jako při této metodě se provede krátká slizniční incize, následně se preparací v submukóze vytvoří „tunel” až k lézi, která se odstraní bez poškození slizničního krytu nad lézí. Vstup do tunelu je poté uzavřen klipy. Technika se podobá metodě POEM (perorální endoskopická myotomie) určené k léčbě achalázie jícnu. V našich podmínkách se jedná o metodu mladou a poměrně málo používanou.
Komplikace a jejich řešení
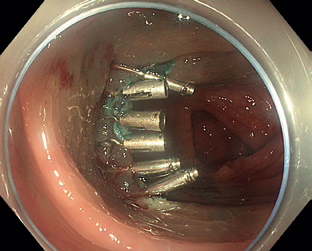 Endoskopická resekce, bez ohledu na konkrétní techniku použitou k odstranění léze, může být provázena různými komplikacemi, mezi něž patří krvácení, perforace a koagulační syndrom. Krvácení během procedury se vyskytuje poměrně často, pokud je ale okamžitě a úspěšně zastaveno, za komplikaci se nepovažuje. K zástavě krvácení se nejčastěji používají klipy (obr. 15) či termické metody. Opožděné krvácení, tedy krvácení vzniklé až po ukončení procedury, může být významnou komplikací a závisí na různých faktorech, včetně velikosti a umístění odstraněné léze; typickou rizikovou lokalitou je pravý tračník. Při zvýšeném riziku krvácení, např. při antitrombotické medikaci, je výhodné spodinu po resekci ošetřit, menší defekty lze kompletně uzavřít klipy, u větších je možné preventivně ošetřit cévy na spodině klipy nebo koagulací, popřípadě aplikovat hemostatické gely.
Endoskopická resekce, bez ohledu na konkrétní techniku použitou k odstranění léze, může být provázena různými komplikacemi, mezi něž patří krvácení, perforace a koagulační syndrom. Krvácení během procedury se vyskytuje poměrně často, pokud je ale okamžitě a úspěšně zastaveno, za komplikaci se nepovažuje. K zástavě krvácení se nejčastěji používají klipy (obr. 15) či termické metody. Opožděné krvácení, tedy krvácení vzniklé až po ukončení procedury, může být významnou komplikací a závisí na různých faktorech, včetně velikosti a umístění odstraněné léze; typickou rizikovou lokalitou je pravý tračník. Při zvýšeném riziku krvácení, např. při antitrombotické medikaci, je výhodné spodinu po resekci ošetřit, menší defekty lze kompletně uzavřít klipy, u větších je možné preventivně ošetřit cévy na spodině klipy nebo koagulací, popřípadě aplikovat hemostatické gely.
Perforace střevní stěny je pravděpodobně nejobávanější komplikací, ve většině případů ale bývá detekována již během výkonu, a může tedy být přímo endoskopicky vyřešena, nejčastěji OTSC klipem, v případě drobných defektů lze zvážit i standardní hemoklipy. Pacienti po perforaci by měli být sledováni za hospitalizace a zajištěni antibiotickou terapií. V komplikovanějších případech může být nutná chirurgická intervence, zejména pokud perforace způsobí rozsáhlou peritonitidu. Peritoneální dráždění může být zapříčiněno i tzv. koagulačním syndromem, který způsobí fokální iritaci projevující se bolestmi bez vzniku perforace, tato ale může v některých případech vzniknout i opožděně. Další specifickou komplikací je akutní apendicitida, která může vzniknout u pacientů s lézemi v blízkosti apendikulárního otvoru, zejména po FTR, při kterém se apendikulární ústí uzavře. Tato komplikace se vyskytuje až u 15 % případů v této lokalizaci.
Kromě těchto akutních komplikací může endoskopická resekce také vést k výskytu lokální reziduální neoplazie (LRN), zejména u rozsáhlých lézí odstraněných piecemeal metodou, kde může dosáhnout až 20 %. Jejich léčba je často komplikována jizevnatými změnami v okolí a fibrózou ve spodině pod lézí. Aktivní kontrola resekčních okrajů může snížit riziko vzniku LRN, někteří autoři doporučují i ošetření resekčních okrajů koagulací či některou z ablačních metod.
Celkově je důležité provádět endoskopické resekce pečlivě a sledovat pacienty po zákroku, aby se minimalizovalo riziko komplikací. Obecně platí pravidlo, že endoskopista by se měl pouštět jen do těch výkonů, jejichž komplikace je schopen vyřešit.
Za komplikaci endoskopické léčby neoplastické léze lze považovat i selhání resekce z hlediska její radikality. Z tohoto důvodu je nezbytné následné histopatologické vyšetření resekátů, které je nutné nejprve extrahovat s co nejmenším mechanickým poškozením a následně našpendlit spodní stranou na korkovou podložku. Histopatologický popis by měl zahrnovat veškeré zásadní údaje, jako je stupeň diferenciace, lymfatická a vaskulární invaze a tumor budding. Chybět nesmí hodnocení horizontálních a vertikálních okrajů (čili hodnocení R0 resekce) a měření hloubky ev. submukózní invaze, což je možné pouze u kvalitního en bloc resekátu. Dle výsledku se hodnotí radikalita resekce a v některých případech je nutné pacienta referovat k chirurgickému řešení.
Závěr
Neoplastické léze v trávicí trubici jsou častým problémem postihujícím širokou část populace. Jejich diagnostika a ve značné části případů i léčba spadají do oblasti digestivní endoskopie. Pro správný management těchto lézí je nezbytná nejen jejich detekce a správná klasifikace, ale i znalost a technické zvládnutí resekčních technik. Komplikované léze by měly být referovány do specializovaných center, které zaručí nejen jejich odborné odstranění, ale i následný postup ve spolupráci s patologem, popřípadě chirurgem. Toto byl jeden z důvodů založení sítě center vysoce specializované péče pro digestivní endoskopie, kterých je v České republice doposud šestnáct.
MUDr. Vít Navrátil, MUDr. Karolína Nováková
II. interní klinika – gastroenterologická a geriatrická, FN Olomouc a LF UP, Olomouc
Korespondenční adresa:
vit.navratil@fnol.cz
Literatura u autora