Jak se změnila léčba maligního melanomu v poslední dekádě
Souhrn
Maligní melanom patří mezi časté nádory, časná stadia jsou plně vyléčitelná chirurgicky, pokročilé a metastatické onemocnění je však velmi agresivní a má nepříznivou prognózu. Chemoterapie je u tohoto chemorezistentního tumoru téměř bez efektu, léčebné výsledky zlepšilo až zavedení cílené léčby inhibitory BRAF a MEK a imunoterapie blokádou PD‑1nebo PD‑L1. Nově je možné i jejich podávání v adjuvanci. Role radioterapie je spíše paliativní, může však být použita i v adjuvanci lokalizovaného relapsu melanomu nebo při disekci postižených uzlin. Obrovský pokrok byl učiněn díky provádění genetického vyšetření nádoru, především mutace BRAF V600e.
Klíčová slova: maligní melanom • genetické vyšetření • inhibitory BRAF a MEK • anti‑PD‑1 a anti‑PD‑L1 imunoterapie • paliativní chemoterapie • radioterapie
Summary
Malignant melanoma belongs to frequent tumors, early stages are surgicaly fully curable, however, advanced and metastatic disease is extremely agressive and has an infavourable prognosis. Chemotherapy has almost no effect in this chemoresistant tumor, so far implementation BRAF + MEK inhibitors targeted treatment and PD‑1 or PD‑L1 blocking immunotherapy led to therapeutical results improvement. It is newly possible to use these drugs in adjuvant setting, too. The role of radiation therapy is mainly palliative but it could be also used as adjuvant treatment of localised melanoma relapse or after involved lymph node dissection. A huge progress can be seen by performing tumor genetic testing, first of all BRAF V600e mutation.
Key words: malignant melanoma • genetic testing • BRAF and MEK inhibitors • anti‑PD‑1 and anti‑PD‑L1 immunotherapy • palliative chemotherapy • radiation therapy
Úvod
Maligní melanom je nejenom poměrně častým onemocněním postihujícím převážně mužskou bělošskou populaci, má navíc ze všech kožních nádorů největší potenciál recidivovat a metastazovat. Tyto schopnosti jsou přímo úměrné pokročilosti nádoru, která je udávána tloušťkou tumoru (v mm dle Breslowa, hloubkou invaze dle Clarka) a přítomností satelitních ložisek v okolí primární léze, postižením spádových uzlin nebo metastáz intranzitních mezi vlastním tumorem a jeho svodnou oblastí. Pětileté přežití pacientů s tloušťkou tumoru do 1 mm tak přesahuje 90 %, u nádorů silnějších klesá na polovinu, ve stadiu III ke 20 % a ve stadiu IV je nižší než 4 %.3 Pacienti s nádory Breslow ≥ 4 mm mají riziko relapsu 50 %, při postižení uzlin pak dokonce 50–85 %.
Faktory spojené s vyšší mírou rizika vzniku tohoto neuroektodermálního zhoubného onemocnění jsou především dlouhodobý nebo opakovaný pobyt na slunci (za nevhodný je považován i pobyt v soláriích, dominantní vliv má záření UVB 260–320 nm a UVA 320–400 nm) podporující chronické solární erytematózní změny nejčastěji u světlovlasých či rusovlasých a modrookých lidí (fototyp I) nebo kožní dysplastické změny. Známa je rovněž souvislost s řadou změn genetických, např. při terminální mutaci nebo polymorfismu genů BRCA1 a BRCA2, CDK4, BAP1 a dalších. U dalších asi 10 % nemocných s familiárním výskytem lze identifikovat geny regulující cyklin‑dependentní kinázy CDKN2A či CDK4. Negativně působí rovněž imunosuprese, přičemž mezi imunokompromitované osoby patří nejenom nemocní s AIDS, ale i po transplantacích všeho druhu – orgánových i kostní dřeně u malignit hematologických – užívající často dlouhodobě imunosupresiva.
Primární melanoblastom (MBL) může přitom postihnout prakticky jakoukoliv část těla, vedle končetinových nebo na trupu se relativně často může objevit na sliznicích ústní dutiny, konečníku, vulvy/pochvy i v oblasti uvey.
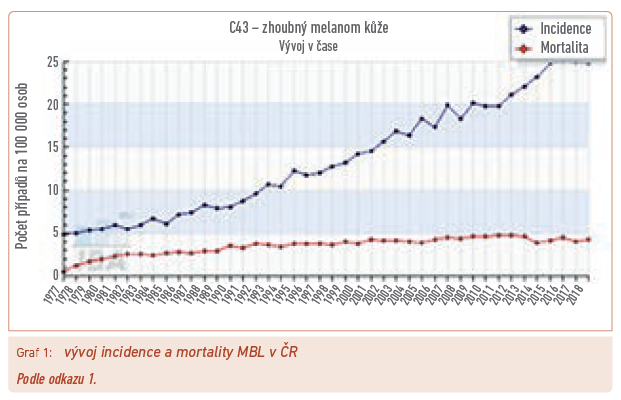
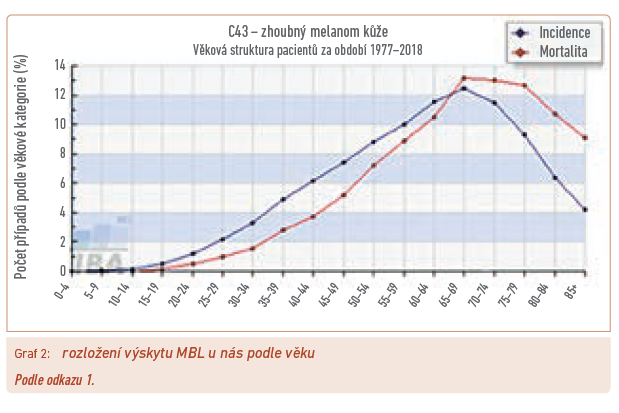
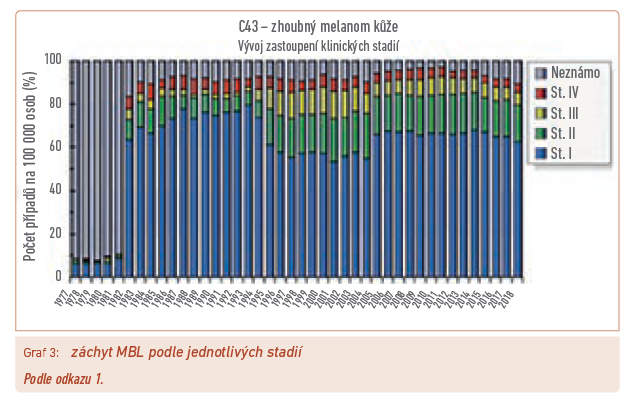
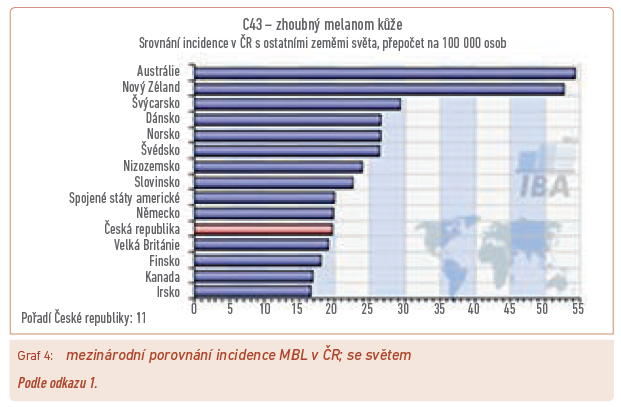
V posledních letech má výskyt MBL neustále stoupající trend, takže stabilizovanou úmrtnost lze považovat za diagnosticko‑terapeutický úspěch (graf 1). Podobně jako u jiných nádorových onemocnění lze i zde vrchol incidence pozorovat ve věku kolem 70 let (graf 2). Přes zlepšené možnosti diagnostiky však zůstává zastoupení jednotlivých stadií prakticky neměnné, řada nemocných je tedy zachycována až v generalizovaném stavu (graf 3). Při srovnání celosvětovém zaujímá aktuálně Česká republika ve výskytu melanomu 11. pozici a řadí se tak mezi vyspělé bělošské populace Evropy a Severní Ameriky (graf 4), přičemž pozici Austrálie a Nového Zélandu ovlivňuje právě přistěhovalectví z těchto geografických oblastí.
Až moderní systémová léčba po roce 2011 zaznamenala obrovský přínos pro nemocné s pokročilým a metastatickým melanomem. Zatímco před tímto obdobím nepřesahovalo jejich přežití devět měsíců, může dnes pětileté přežití přesahovat i 50 %.
Charakteristika onemocnění
Lokálně pokročilý melanom může poměrně záhy diseminovat do uzlin i všech tělesných orgánů včetně jater, plic, skeletu a mozku a u 5 % primárně generalizovaných může být příčinou rychlého úmrtí. Příčinou je postupná transformace melanocytu na malignitu růstem a množením névocytů, v dalších fázích s tvorbou hnízd s různým stupněm dysplazie, vznikem buněčných atypií (vede k plošnému šíření) a poté s vertikální invazí do hloubky.6
Samotný melanom je onemocněním s nejvyšší mutační náloží, což jej v dnešní době předurčuje k léčbě imunoterapií. Problémem je však extrémní heterogenita tumoru, kdy každá jeho část se chová naprosto odlišně. To znamená, že velmi důležité informace nám kromě histopatologie může poskytnout i genetika.
Diagnostiku onemocnění je vhodné zahájit zjištěním anamnézy, která zahrnuje i hereditární rizika, vždyť i vlastní fototyp postiženého je dán geneticky. Díky dostupnosti většiny lézí aspexi je absolutním základem vyšetření kožním specialistou pomocí dermatoskopu. Při podezření na melanomovou lézi by měla následovat její radikální excize, biopsie není vhodná.
S ohledem na schopnost nádoru poměrně časně diseminovat je však zejména u pokročilejších lézí nutno doplnit další vyšetření, která pomohou určit stadium onemocnění. Nemocní by měli mít doplněno alespoň rentgenové (RTG) vyšetření plic a sonografické (SONO) vyšetření spádových uzlin a epigastria. Jelikož je dnešní léčba pokročilého a metastatického melanomu nákladná, jsou upřednostňována komplexnější a přesnější vyšetření – spíše výpočetní tomografie (CT) hrudníku a břicha nebo nejlépe vyšetření celotělovým PET/CT (pozitronová emisní tomografie/výpočetní tomografie) (obr. 1) umožňující posoudit i nález ve skeletu a mozku, který by měl být před zahájením terapie rovněž vyšetřen, aby byla možná úhrada léčby ze zdravotního pojištění. Navíc je CT nález přesnější a přehlednější, než jaký umožní běžné SONO vyšetření (obr. 2).
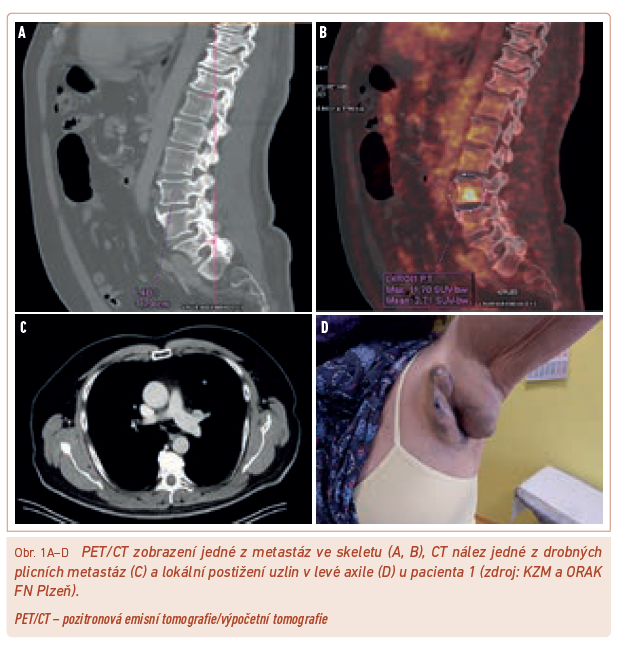
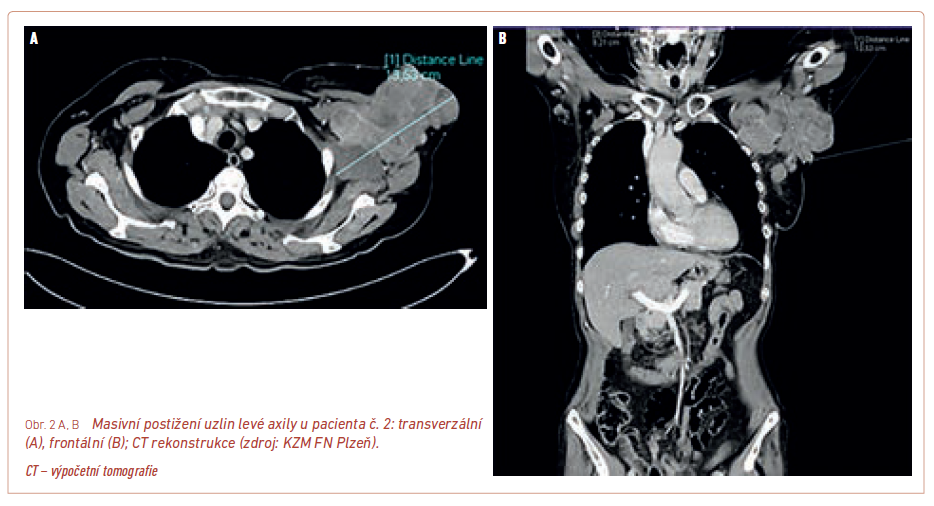
Terapie maligního melanomu
Chirurgická léčba
Kurativní efekt má kompletní odstranění primárního tumoru. Excize diagnostická nemusí být příliš široká, dostačující je lem v šíři 3 mm, pro terapeutickou jistotu je však doporučeno dosáhnout u nádoru stadia 0–I lemu 1 cm, u vyšších lemu 2 cm (v minulosti dokonce 3–5 cm, jeho aktuální zúžení však nevede ke zvýšení počtu relapsů onemocnění). Velký význam má spíše hloubka excize k určení tloušťky infiltrace dle Breslowa a současně zaručující zdravé okraje i v tomto rozměru. Redukcí prošel i výkon v oblasti spádových uzlin, kde dnes převažuje mapování a následné odstranění sentinelové uzliny, jež z velké části nahradilo disekci uzlin. To však může vést k lokoregionálním recidivám s nutností rozšířeného resekčního výkonu nebo zařazení radioterapie následně. Trend k limitaci operačních výkonů u této diagnózy tedy nemusí být možná optimální, přestože řada studií a jejich metaanalýzy dokládají prakticky nezměněné přežití nemocných.7
Systémová léčba
V minulosti používaná cytostatika – např. dakarbazin, 5‑fluorouracil, vinka alkaloidy, ale i další látky – megestrol acetát, levamizol, retinoidy, interleukin 2 (IL‑2) či interferon gama (IFNγ) a jejich kombinace byly spojeny se zcela mizivým a krátkodobým efektem, o jejich využití se tedy nelze opírat. Doporučení Národní onkologické sítě (National Comprehensive Cancer Network, NCCN) zahrnují i monoterapii temozolomidem, ev. paklitaxelem či nab‑paklitaxelem a kombinaci paklitaxel/karboplatina, přesto však platí, že možnosti chemoterapie jsou velmi omezené.
Prognóza metastatických MBL byla naprosto tristní. Jediné s výsledky spojené s ojedinělým i dlouhodobým přežitím přineslo podávání vysokodávkovaného interferonu alfa (IFNα). Je však provázeno extrémní toxicitou v podobě myelosuprese, hepatotoxicity a neurotoxicity, takže muselo probíhat nejlépe na lůžkách intenzivní péče. K obratu došlo zhruba před 10 lety, kdy začala být využívána cílená léčba a imunoterapie nové generace. Tyto postupy následně léčbu onemocnění zcela převzaly, což vedlo k absolutní změně prognózy u velké části postižených díky dosažení dlouhodobých stabilizací a kompletních regresí až ve 20 % případů. Kombinací léčiv lze tyto výsledky ještě zlepšit. Aktuální léčebná doporučení u nás ukazuje tabulka 1.

Napomohlo tomu zavedení genetického vyšetření tumoru – stanovení aktivační mutace V600 genu BRAF naplňuje požadavky prediktivního biomarkeru pro indikaci specificky cílené léčby, význam vyšetření PD‑L1 (ligand membránového proteinu programované buněčné smrti) u imunoterapie je zřetelně nižší, zůstává sice nadále ve studiích zachován, ale postavení jednoznačného prediktoru nemá.
V dnešní době je u pacientů s mutací BRAF a potřebou dosažení rychlejší protinádorové odpovědi preferována především kombinace dabrafenibu (inhibitor BRAF) s trametinibem (inhibitor MEK), ev. kombinace vemurafenib/cobimetinib (kombinace encorafenib/binimetinib není u nás dostupná). U nepředléčených pacientů je spojena s větším počtem léčebných odpovědí a s delší dobou do progrese onemocnění (progression free survival, PFS) a s delší dobou přežití (overall survival, OS) proti monoterapii inhibitorem BRAF dabrafenibem či vemurafenibem samostatným. Ta přichází v úvahu v případech, kdy není možná kombinovaná léčba nebo vhodná imunoterapie, ne však podáváním samotných inhibitorů MEK vlivem nižší účinnosti ve srovnání s inhibitory BRAF.
Druhou možností je právě imunoterapie. V jejím rámci byl dlouho standardním postupem ipilimumab (anti‑CTLA‑4), lepšími výsledky i přijatelnější toxicitou však bylo jeho podávání nahrazeno v posledních letech check‑point inhibitory nivolumabem, ev. pembrolizumabem. Jak již bylo uvedeno, nejlépe vychází kombinace nivolumabu s ipilimumabem, avšak za cenu nárůstu toxicity proti monoterapii. Pozice ipilimumabu je tak nyní spíše ve druhé linii. Lze očekávat, že budou schválena další léčiva skupiny blokátorů PD‑1 a PD‑L1 a klinickým zkoušením projdou další jejich kombinace.
Až do současnosti nebyla žádná systémová léčba – zkoušeny byly např. roční režimy IFN – schopna poskytnout jakýkoliv benefit ve smyslu prodloužení přežití. Až právě imunoterapie a cílená léčba doložily minimálně ve III. stadiu (lépe již od stadia – IIC) svůj pozitivní vliv, navíc některá z těchto léčiv zcela nedávno získala úhradu ze zdravotního pojištění, a lze je tedy v těchto indikovaných případech podat. To se jeví s ohledem na imunodeficientní podstatu vzniku a vývoje onemocnění jako logická a zřejmě jediná možnost.
Radioterapie
Léčba zářením u melanomu rozhodně nepatří mezi hlavní léčebné metody, její zařazení může být adjuvantní s cílem likvidace mikroskopického reziduálního onemocnění v případě suboptimální (R1) resekce nebo uzlinového postižení (v případě pooperačního zajištění uzlinové oblasti po exstirpaci metastatických uzlin by měla být spojena s nižším rizikem recidivy díky lepší lokální kontrole, avšak jediná prospektivní studie nedoložila přínos z hlediska PFS ani OS a stejně dopadly také studie s ozářením mozku po neurochirurgickém nebo stereotaktickém ošetření metastáz), jinak je obvykle aplikována jako paliativní s cílem ovlivnění symptomů spojených s nádorem – krvácení, bolestmi – nebo s jeho masivní progresí. Díky možnosti využití moderních technik plánování a verifikace nastavení pacienta je však stále častěji využíváno stereotaktické ozáření nebo radiochirurgie, jejichž význam může být v případě oligometastatického postižení i radikální. Zejména v kombinaci s imunoterapií může ozáření některého z ložisek či primárního tumoru navodit abskopálním efektem výrazně lepší odpověď na metodu terapie systémové i v ostatních lokalizacích postižení. Potvrzení a možnému vysvětlení tohoto principu je v současnosti věnován velký počet probíhajících studií.2
O značné nejistotě použití RT svědčí i velký rozptyl v doporučovaných režimech léčby. Ve zřídka používané primární léčbě zářením u inoperabilních nádorů bez známek generalizace lze použít režim 64–70 Gy v 32–35 frakcích aplikovaných za téměř sedm týdnů, 50–57,5 Gy ve 20–23 frakcích aplikovaných ve 4–5 týdnech, 35 Gy v 5 frakcích za týden i 32 Gy ve 4 frakcích po týdnu.
V mnohem častějším paliativním zařazení (např. obr. 3) pak lze použít např. 50 Gy ve 20 frakcích, 40 Gy v 8 frakcích nebo 32 Gy ve 4 frakcích během 4 týdnů i hypofrakcionace zkrácené, např. 30 Gy v 5 nebo 10 frakcích/2 týdny, 20 Gy v 5 frakcích/1 týden, 24–27 Gy ve 3 frakcích za 1–1,5 týdne nebo 8 Gy aplikovaných jednorázově.
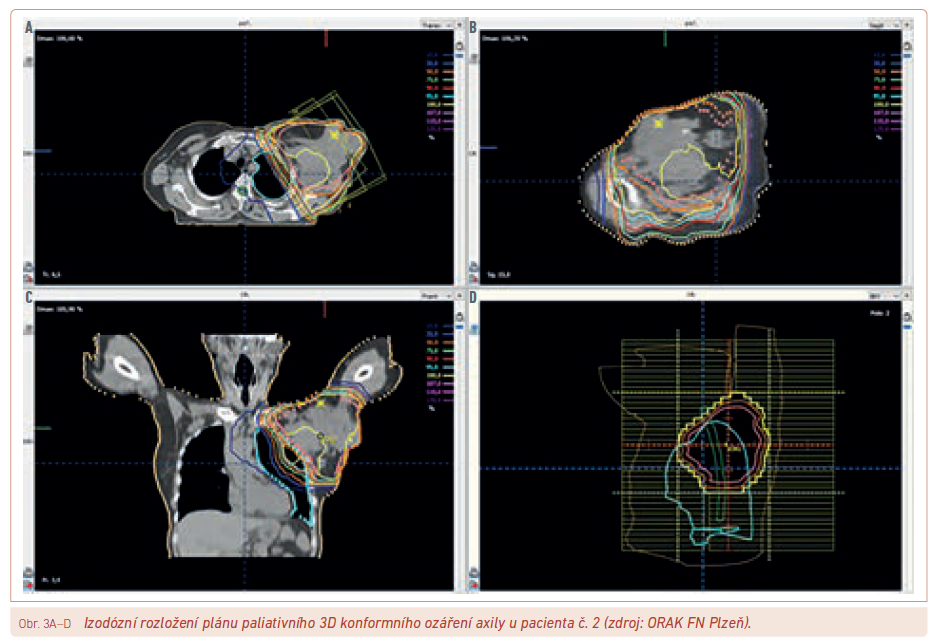
Na oblast uzlinovou lze volit mezi režimy 50–66 Gy v 25–33 frakcích standardním režimem po 2 Gy/den, ale i 48 Gy v 20 frakcích/4 týdny nebo 30 Gy v 5 frakcích ob den.
U nemocných s generalizací do mozku je ke zvážení resekce nebo radioterapie, spíše jen jedna z modalit s ponecháním druhé pro případ recidivy. Při mnohočetném postižení mozku je k dispozici režim 30 Gy/10 frakcí/2 týdny, 37,5 Gy/15 frakcí/3 týdny nebo 20 Gy/5 frakcí za týden. U léze solitární a využití stereotaxe je dávka volena podle velikosti léze, klesá od 24 Gy u změn o velikosti do 2 cm přes 18 Gy u změn o velikosti 2–3 cm k 15 Gy u ložisek velkých 3–4 cm), v ev. adjuvanci pak podle velikosti poresekční dutiny (20 Gy při objemu kolem 4 cm3, 18 Gy u větších, 15 Gy při 14–20 cm3 až k 12 Gy u dutin s objemem nad 30 cm3).
Diskuse
Zatím není zcela jasný přesný mechanismus kancerogeneze UV záření na vznik genotoxického poškození, mitogenního účinku, produkci parakrinních faktorů a ztrátu imunologického dohledu, důležitý je však význam změn mikroprostředí. Zvýšená exprese některých cadherinů a betaintegrinů usnadňuje schopnost invaze nádorových buněk, procesu malignizace se však účastní i další růstové faktory (PDGF, bFGF, HGF) a cytokiny, např. IL‑8.
Pro MBL není zaveden žádný účinný screening. Je na každém z nás věnovat pozornost kožním změnám, především pigmentovaným névům a jejich změnám v čase ve smyslu zvětšování nebo krvácení. Vhodné je také využití řady preventivních akcí, v jejichž rámci si lze nechat tyto změny ověřit dermatoskopicky. Navíc díky stále častějšímu genetickému testování stoupá záchyt osob predisponovaných i ke vzniku tohoto onemocnění, které jsou odesílány cíleně k dispenzarizaci kožním lékařem.
Rovněž poléčebné sledování se liší podle stadia onemocnění – zatímco u malých a lokalizovaných forem není pravidelná kontrolní vyšetření prakticky třeba provádět, u pokročilejších nádorů vyšetření zahrnuje především sonografii jizvy a svodných uzlin – především u nemocných s chybějícím uzlinovým výkonem či pozitivní sentinelovou uzlinou a nedoplněnou kompletní disekcí – cca každé čtyři měsíce první dva roky a pak po šesti měsících v dalších třech letech, jinak po 6–12 měsících. Opakované vyšetření magnetickou rezonancí (MR) mozku je vhodné jen u nemocných léčených pro jeho metastatické postižení. Pokud je pacient asymptomatický dlouhodobě (3–5 let), není po uplynutí této doby další pravidelné grafické vyšetřování nutné a dostačující je vyšetření klinické.
Moderní cílená léčba a imunoterapie nejsou bez toxicity, některý z jejich projevů lze pozorovat téměř u všech pacientů. Spektrum těchto projevů je zcela odlišné od klasické chemoterapie a hematologickou či gastrointestinální toxicitu nahrazují často velmi závažné zánětlivé problémy typu hepatitidy, pankreatitidy, pneumonitidy, hypotyreózy nebo hypertyreózy apod. Z téhož důvodu není imunoterapie doporučována u osob léčených kortikoidy či jinou imunosupresivní léčbou, u pacientů s autoimunitním onemocněním, včetně onemocnění plic nebo štítnice, a dořešena zatím není účinnost imunoterapie v případě nutnosti podávání antibiotik.
Vzhledem k nákladům na léčbu pokročilých a metastatických MBL je třeba zvažovat také efektivitu terapie. První otázkou je zjištění přístupu k okamžitému určení stavu BRAF. Porovnávat lze totiž léčebný postup založený na imunoterapii (nivolumab ± ipilimumab, pembrolizumab) proti cílené léčbě blokující BRAF a MEK v případě mutace prvního z genů. Jak dokládá zcela aktuální porovnání, nejvhodnější je zahájení léčby imunoterapií s ponecháním aplikace inhibitorů BRAF a MEK ve druhé linii po doplnění vyšetření a potvrzení mutace BRAF.4
Závěr
Maligní melanom je v případě časného záchytu díky radikálnímu odstranění onemocněním plně vyléčitelným, chirurgická léčba tedy zůstává základním postupem. Nálezy lokálně pokročilé však již mají tendenci záhy recidivovat a bohužel také často masivně metastazovat. Přežití takto postižených nemocných bylo dlouho velmi omezené, protože jde o nádor značně chemo‑ i radiorezistentní. Proto je velmi pozitivní, že nedávno byla schválena úhrada adjuvantní léčby, když v minulosti používaná imunoterapie první generace v podobě cytokinů nesplnila očekávání. Nejvýznamnější změnu přineslo až zavedení léčby cílené a moderní imunoterapie, které velmi příznivě ovlivnily prognózu a umožňují dlouhodobé přežití, jež lze v některých případech hodnotit jako vyléčení. Nejlepších výsledků lze dosáhnout kombinací léčiv.
Role radioterapie je lokálně poměrně důležitá a snižuje riziko recidivy, problematická může být volba optimálního frakcionovaného režimu. Použití radioterapie v adjuvanci však nemusí vést k prodloužení přežití. Klasická, byť dříve běžně používaná cytostatika nejsou spojena s prakticky žádnou odpovědí, a tato léčba je tedy používána velmi omezeně. Systémovou terapii dnes zastupuje prakticky jen cílená léčba inhibitory BRAF s inhibitory nebo bez inhibitorů MEK a imunoterapie check‑point inhibitory, ev. ipilimumabem. Zcela dořešena však zatím není optimální sekvence těchto dvou postupů u pacientů s BRAF V600 mutovanými nádory, kde existuje diskrepance mezi léčebným doporučením a schválenou úhradou těchto léčiv v jednotlivých liniích. Zatímco pro boj s COVID‑19 je sluneční záření pro tvorbu vitaminu D nezbytné, k minimalizaci rizika vzniku maligního melanomu je doporučováno se neslunit.
O léčbě by – stejně jako v jiných případech – měl rozhodovat multidisciplinární tým.
Literatura
- www.svod.cz
- Hiniker SM, Reddy SA, Maecker HT, et al. A prospectice clinical trial combining radiation therapy with systemic immunotherapy in metastatic melanoma. Int J Radiat Oncol Biol Phys 2016;96:578–588.
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015; CA Cancer J Clin 2015;65:5–29.
- Wu B, Shi L. Frontline BRAF Testing‑guided treatment for advanced melanoma in the era of immunotherapies: a cost‑utility analysis based on long‑term survival data. JAMA Dermatol 2020, e202398.
- Modrá kniha ČOS, Vyd. MOÚ Brno 2020.
- Jurga ĹM a kol. Klinická a radiačná onkológia. Martin, Osveta, 2010.
- Haigh PI, DiFronzo LA, McCready DR, et al. Optimal surgical margins for primary cutaneous melanoma: systemic review and meta‑analysis. Can J Surg 2003;46:419–426.