Léčba srdečního selhání očima nových guidelines ESC

Na kongresu Evropské kardiologické společnosti (ESC) v Amsterdamu bylo na konci srpna představeno hned několik nových guidelines. Netrpělivě se čekalo také na tzv. cílenou aktualizaci doporučených postupů pro srdeční selhání, která reagovala na výsledky nových rozsáhlých studií měnících léčbu, a tím i prognózu pacientů se srdečním selháním. Podle některých odborníků jde o revoluční změnu paradigmatu léčby.
Léčba srdečního selhání (SS) patří mezi nejrychleji se rozvíjející oblasti kardiologie, což se začíná postupně propisovat do zlepšování prognózy pacientů s tímto závažným a progredujícím onemocněním, které je zpravidla doprovázeno dalšími komorbiditami. Předsedkyně pracovní skupiny nových guidelines (McDonagh T et al. 2023 Focused update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. European Heart Journal 2023) prof. Theresa McDonaghová z King’s College Hospital v Londýně, Velká Británie, uvedla: „Tato cílená aktualizace zahrnuje nejnovější léčebné postupy založené na důkazech s cílem zlepšit výsledky pacientů se srdečním selháním.“
Novinky v kostce
Od roku 2021, kdy byly publikovány předchozí doporučené postupy, bylo totiž publikováno více než deset randomizovaných kontrolovaných studií, jejichž výsledky měly přímý dopad na terapii pacientů se SS. Co se týče managementu chronického SS, v dokumentu z roku 2021 nebyla uvedena žádná doporučení týkající se používání inhibitorů sodíko‑glukózového kotransportéru 2 (SGLT‑2) u pacientů se srdečním selháním s mírně sníženou ejekční frakcí (HFmrEF) a srdečním selháním se zachovanou ejekční frakcí (HFpEF), protože u těchto skupin nebyly k dispozici žádné studie. Od té doby ale byly provedeny studie EMPEROR‑Preserved s empagliflozinem a DELIVER s dapagliflozinem. Cílená aktualizace z letošního roku již doporučuje dapagliflozin nebo empagliflozin u pacientů s HFmrEF a HFpEF ke snížení rizika hospitalizace pro srdeční selhání nebo kardiovaskulárního úmrtí, a to v nejvyšší třídě doporučení 1A.
Pokyny z roku 2021 dále zdůrazňují význam hodnocení před propuštěním a časně po propuštění u pacientů přijatých do nemocnice pro epizodu akutního SS. V návaznosti na to studie STRONG‑HF prokázala bezpečnost a účinnost zahájení perorální medikamentózní léčby a dosažení optimálních dávek před propuštěním z nemocnice a při časných kontrolních návštěvách po propuštění. Na základě těchto výsledků doporučuje aktualizace doporučených postupů intenzivní strategii zahájení a rychlé uptitrace léčby založené na důkazech ještě před propuštěním a během častých a pečlivých kontrolních návštěv v prvních šesti týdnech po hospitalizaci pro SS s cílem snížit počet rehospitalizací a úmrtí. Doporučení zdůrazňují, že během kontrolních návštěv by měla být věnována zvláštní pozornost symptomatologii a známkám oběhového přetížení, krevnímu tlaku, srdeční frekvenci, plazmatickým koncentracím NT‑proBNP, koncentracím draslíku a odhadované glomerulární filtraci (eGFR). Tyto faktory souvisejí s prognózou a mohou signalizovat potřebu dalších změn v léčbě.
Aktualizace doporučení se rovněž zaměřuje na komorbidity a poskytuje dvě nová doporučení pro prevenci SS u pacientů s chronickým onemocněním ledvin a diabetem 2. typu – na základě výsledků studií DAPA‑CKD a EMPA‑KIDNEY a metaanalýzy čtyř studií doporučují guidelines pacientům s chronickým onemocněním ledvin a diabetem 2. typu inhibitory SGLT‑2 ke snížení rizika hospitalizace pro SS nebo kardiovaskulárního úmrtí. Druhé doporučení vychází ze studií FIDELIO‑DKD a FIGARO‑DKD a ze souhrnné analýzy těchto dvou studií. Pacientům s diabetem 2. typu a chronickým onemocněním ledvin je doporučen finerenon ke snížení rizika hospitalizace pro SS. Druhou komorbiditou, kterou se cílená aktualizace zabývá, je nedostatek železa. Výsledky nových studií včetně studie IRONMAN a metaanalýz taktéž vedly k novým doporučením – u pacientů s nedostatkem železa se srdečním selháním se sníženou ejekční frakcí (HFrEF) nebo HFmrEF se nyní doporučuje intravenózní suplementace železem ke zlepšení symptomů a kvality života.
Význam optimalizace léčby SS již za hospitalizace je zásadní
Hned několik odborných sympozií se v Amsterdamu věnovalo významu časně zahájené a dostatečně intenzifikované léčby SS, a to ještě během fáze hospitalizace pro SS. Nová doporučení ostatně implementační strategii sama navrhují a akcentují její dodržování. Dr. Antonio Bayes Genis z University Hospital Germans Trias and Pujol de Badalona, Španělsko, připomněl, že SS je jednou z vedoucích příčin hospitalizací a je jednoznačně hlavní příčinou hospitalizací u osob starších 65 let. K rehospitalizaci dochází bohužel ve 30 procentech případů do 90 dnů a více než třetina pacientů je opakovaně hospitalizována v prvním půlroce od propuštění z nemocnice. „Každá rehospitalizace exponenciálně zvyšuje riziko následných rehospitalizací, riziko akutních ošetření a mortality,“ varoval dr. Genis. Mortalita během hospitalizace u pacientů se SS činí až 10 procent a 25–30 procent pacientů hospitalizovaných pro SS zemře během jednoho roku. Dr. Genis uvedl, že jde o horší prognózu, než jakou mají pacienti s kolorektálním karcinomem. Doplnil, že v souladu s novými doporučeními ESC z roku 2023 by léčba glifloziny měla být zahájena už za hospitalizace a bez ohledu na úroveň ejekční frakce levé komory. Tato strategie pacientům přinese zlepšení kvality života a významné snížení rizika dalších hospitalizací a úmrtí. „Paradigmatem nového přístupu k léčbě srdečního selhání je bezpochyby časná diagnostika a časné zahájení terapie léčbou založenou na důkazech. Tedy zbytečně na nic nečekat. V tomto ohledu jsou nová doporučení začátkem revoluce,“ podtrhnul dr. Genis. A dodal důležitou věc, totiž že hospitalizace pacienta poskytuje klíčovou příležitost k optimalizaci farmakoterapie založené na důkazech (GDMT) u pacientů se SS. Hospitalizační léčba má několik fází. V první dochází k managementu klinické kongesce léčbou i.v., kterou následuje perorální farmakoterapie před propuštěním, jež pacienta hemodynamicky, a tím i klinicky stabilizuje. Rehospitalizacím pro srdeční selhání je třeba předcházet časnou detekcí a efektivní léčbou reziduální nebo rekurentní kongesce, dále je nutné zlepšit krátkodobé a dlouhodobé výsledky pacientů nasazením GDMT ještě před propuštěním z nemocnice a naplánovat dostatečně frekventní kontroly po propuštění (Metra et al., EHJ Fail 2023). Dr. Genis připomněl, že optimalizace GDMT před propuštěním takovou zpravidla zůstane, pokud je ale léčba nasazena suboptimálně, má tendenci zůstat suboptimální. A pokud dojde k propuštění pacienta bez GDMT, je více než 75% riziko, že tato léčba nebude v následujícím roce nasazena (Rao et al., J Am Coll Cardiol 2021). Co neblahého to znamená pro klinické výsledky pacientů, ukazuje graf. „Nové guidelines nám předkládají doporučenou implementační strategii GDMT, která má být dodržována. Je to strategie intenzivní iniciace léčby a rychlé uptitrace, a to již během hospitalizace a pak dále během častých a pečlivých kontrol v prvních šesti týdnech po propuštění. To proto, aby se snížilo riziko rehospitalizací a mortality,“ shrnul dr. Genis.
Časné podání inhibitorů SGLT‑2 v rámci GDMT je doporučeno, protože jde o léčbu tolerovanou i pacienty s hypotenzí, léčbu s příznivými účinky na renální funkce a léčbu s časnými účinky na klinické výsledky a kvalitu života bez ohledu na výši ejekční frakce nebo základní léčbu SS. Nasazením gliflozinů je také zvýšena pravděpodobnost tolerance další GDMT a sníženo riziko nutnosti eskalovat diuretickou léčbu. „Příznivý efekt gliflozinů přetrvává během hospitalizace, proto by tato léčba měla být buď za hospitalizace zahájena, nebo by neměla být během ní přerušována,“ apeloval dr. Genis a uvedl, že v tomto kontextu rád hovoří o výsledcích studie STRONG‑HF (Mebazaa et al., 2022), která také ovlivnila podobu nových doporučení. Ukázala, že zavedení intenzivní GDMT ještě před propuštěním, její následná titrace k optimálním (tj. maximálním tolerovaným) dávkám během 180 dnů sledování vedla ve srovnání se standardně léčenou skupinou k většímu snížení koncentrací NT‑proBNP, což se promítlo do lepších výsledků pacientů (nižší mortality a nižšího počtu rehospitalizací pro SS).
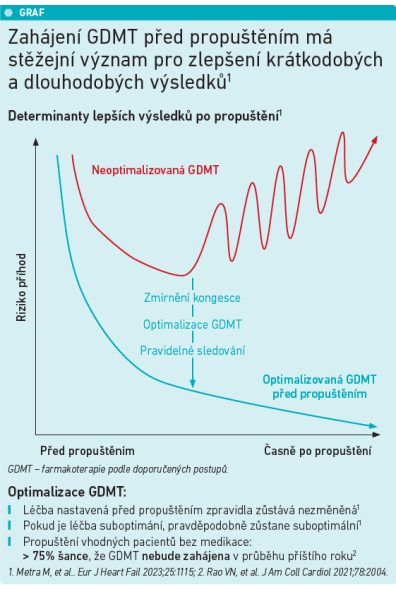 Jak ale vypadá skutečná klinická praxe? Dr. Genis konstatoval, že implementace GDMT do klinické praxe zůstává zatím nedostatečná, a to jak u hospitalizovaných, tak propuštěných pacientů se SS. Ukazují to četné registry z reálné klinické praxe včetně americké prospektivní implementační studie IMPLEMENT‑HF u pacientů s HFrEF (Bhatt et al., J Am Coll Cardiol 2023). Registr s názvem Get With The Guidelines‑Heart Failure Registry (Pierce et al., JAMA Cardiol 2023) například odhaluje, že jen čtyři procenta amerických nemocnic propustilo 50 a více procent pacientů s nasazenými glifloziny. Pro klinickou inercii existuje řada důvodů, podstatné ale je, že hraje ústřední roli v nedostatečné preskripci GDMT u pacientů se SS. „Inercie by měla být překonána důslednou implementací stávajících guidelines,“ je přesvědčen dr. Genis. Překážky nasazení GDMT mohou být jak na straně lékaře (léčbu nepředepisuje, netitruje k cílovým dávkám, má strach z rizik pro pacienta), tak na straně pacienta (starší a křehký nemocný, s četnými komorbiditami, non‑adherentní, nedostatečně edukovaný) a zdravotního systému (fragmentovaný systém péče bez mezioborové spolupráce, nedostatečný systém kontrol pacienta, absence nebo eroze vztahu lékař–pacient, absence léčebných protokolů pro klinickou praxi). „Ukazuje se, že oddálení iniciace GDMT je častější u vysoce rizikových pacientů s četnými komorbiditami, jako jsou například onemocnění ledvin nebo diabetes. Tito nemocní by přitom z optimální terapie srdečního selhání profitovali víc než ostatní,“ podotkl dr. Genis a uzavřel, že hospitalizaci je skutečně třeba chápat jako klíčovou příležitost k prolomení klinické inercie a implementaci GDMT, což povede ke zlepšení krátkodobých i dlouhodobých výsledků pacientů.
Jak ale vypadá skutečná klinická praxe? Dr. Genis konstatoval, že implementace GDMT do klinické praxe zůstává zatím nedostatečná, a to jak u hospitalizovaných, tak propuštěných pacientů se SS. Ukazují to četné registry z reálné klinické praxe včetně americké prospektivní implementační studie IMPLEMENT‑HF u pacientů s HFrEF (Bhatt et al., J Am Coll Cardiol 2023). Registr s názvem Get With The Guidelines‑Heart Failure Registry (Pierce et al., JAMA Cardiol 2023) například odhaluje, že jen čtyři procenta amerických nemocnic propustilo 50 a více procent pacientů s nasazenými glifloziny. Pro klinickou inercii existuje řada důvodů, podstatné ale je, že hraje ústřední roli v nedostatečné preskripci GDMT u pacientů se SS. „Inercie by měla být překonána důslednou implementací stávajících guidelines,“ je přesvědčen dr. Genis. Překážky nasazení GDMT mohou být jak na straně lékaře (léčbu nepředepisuje, netitruje k cílovým dávkám, má strach z rizik pro pacienta), tak na straně pacienta (starší a křehký nemocný, s četnými komorbiditami, non‑adherentní, nedostatečně edukovaný) a zdravotního systému (fragmentovaný systém péče bez mezioborové spolupráce, nedostatečný systém kontrol pacienta, absence nebo eroze vztahu lékař–pacient, absence léčebných protokolů pro klinickou praxi). „Ukazuje se, že oddálení iniciace GDMT je častější u vysoce rizikových pacientů s četnými komorbiditami, jako jsou například onemocnění ledvin nebo diabetes. Tito nemocní by přitom z optimální terapie srdečního selhání profitovali víc než ostatní,“ podotkl dr. Genis a uzavřel, že hospitalizaci je skutečně třeba chápat jako klíčovou příležitost k prolomení klinické inercie a implementaci GDMT, což povede ke zlepšení krátkodobých i dlouhodobých výsledků pacientů.
Léčba SS glifloziny za hospitalizace je bezpečná
Prof. John R. Teerlink ze San Francisco Veterans Affairs Medical Centre, San Francisco, USA, se podrobněji zabýval tím, jakou hodnotu přinášejí inhibitory SGLT‑2 pacientům se SS. Konstatoval, že k dispozici jsou studie zkoumající přínos gliflozinů v různých stadiích hospitalizační léčby pacientů s akutním SS – před propuštěním (PIONEER‑HF, IMPACT‑HF, ATHENA‑AHF, EMPULSE, AFFIRM‑AHF) a po propuštění (SOLOIST‑WHF, STRONG‑HF). Také metaanalýzy outcomových studií potvrzují přínos gliflozinů v redukci KV mortality ve srovnání s placebem, a to konzistentně napříč úrovněmi EF. Studie EMPEROR‑Reduced a EMPEROR‑Preserved prokázaly signifikantní redukci relativního rizika kardiovaskulární (KV) mortality a hospitalizace pro SS bez ohledu na EF vs. placebo (u pacientů s HFrEF to bylo o 25 % a u pacientů s HFpEF o 21 %). „Důležité je si povšimnout, že křivky mezi oběma skupinami se začaly rozevírat velmi časně, již během prvních tří měsíců od randomizace. Ve studii EMPEROR‑Reduced bylo statistické signifikance dosaženo již 12. den od randomizace, ve studii EMPEROR‑Preserved pak 18. den. Jasně to poukazuje na význam časné intervence,“ zdůraznil prof. Teerlink. Dále vyzdvihl studii EMPULSE (Tromp et al., Eur J Heart Fail 2021) s empagliflozinem, který byl podáván hospitalizovaným pacientům stabilizovaným po epizodě akutního SS. Celkem 530 pacientů bylo v poměru 1 : 1 randomizováno buď k empagliflozinu, nebo k placebu. Medián doby od přijetí do nemocnice k randomizaci byl tři dny a pacienti byli randomizováni bez ohledu na výši EF. Sledování trvalo 90 dnů. Pacienti randomizovaní k empagliflozinu měli ve srovnání s pacienty užívajícími placebo o 36 procent vyšší pravděpodobnost dosažení klinického benefitu (klinický benefit zahrnoval kompozit mortality, příhod spojených se SS, jako jsou hospitalizace nebo urgentní ošetření či neplánované návštěvy lékaře, dobu do první epizody SS a pěti‑ či vícebodový rozdíl ve skóre KCCQ‑TSS od začátku léčby do 90. dne). Benefit léčby empagliflozinem byl konzistentní napříč prespecifikovanými podskupinami (věk, eGFR, výchozí EF). „Empagliflozin vedl k signifikantní redukci celkové mortality nebo první epizody srdečního selhání ve srovnání s placebem o robustních 35 procent,“ podtrhnul prof. Teerlink a dodal, že NNT (number‑needed‑to treat), tedy počet pacientů, které je třeba léčit, aby bylo zabráněno jedné příhodě SS nebo úmrtí, byl pouhých 15. Pacienti léčení empagliflozinem také během 90 dnů sledování dosáhli signifikantně větší redukce hmotnosti bez ovlivnění renálních funkcí. Empagliflozin ve studii vedl k časné a trvalé dekongesci (měřeno změnami ve skóre klinické kongesce zahrnující dyspnoe, ortopnoe a únavu). Prokázalo se také časné a přetrvávající zlepšení symptomů, fyzických omezení a kvality života ve srovnání s placebem (zlepšení skóre v dotazníku KCCQ‑TSS přibližně o 5 bodů). „Důležité je, že výskyt nežádoucích účinků byl podobný mezi oběma skupinami. Numericky vyšší byl dokonce v placebové skupině, a to včetně závažných nežádoucích účinků. Nemáme tedy vůbec žádné důkazy pro to, že by nasazení empagliflozinu během hospitalizace přinášelo rizika pacientům se srdečním selháním. Nezbývá tedy než zopakovat již řečené, a to, že podání gliflozinů je před propuštěním z nemocnice doporučeno stabilizovaným pacientům hospitalizovaným pro srdeční selhání, a to bez ohledu na výši ejekční frakce nebo výchozí terapii srdečního selhání,“ uzavřel prof. Teerlink.