Rostoucí význam mukolytické léčby u pacientů s CHOPN. Kdy a proč?
V rámci společného XXIV. kongresu Slovenské pneumologické a ftizeologické společnosti a České pneumologické a ftizeologické společnosti, který se konal ve dnech 12.–14. června 2025 na Štrbském plese, uspořádala sympozium společnost Angelini Pharma. Tomuto setkání odborníků předsedal docent MUDr. Štefan Laššán, PhD., MPH, Bratislava, a docent MUDr. Pavol Pobeha, Ph.D., Košice. O problematice hlenu a mukolytické léčby u pacientů s CHOPN pak hovořili profesor Clive Page, King´s College, Londýn, a docent MUDr. Vladimír Koblížek, Ph.D., Hradec Králové.
První řečník, profesor Clive Page, v přednášce Význam hlenu u CHOPN (The importance of mucous in COPD) v úvodu zdůraznil, že chronická obstrukční plicní nemoc (CHOPN) je heterogenní skupina onemocnění charakterizovaná chronickými respiračními symptomy (dušnost, kašel, produkce sputa a/nebo exacerbace) v důsledku abnormalit v dýchacích cestách (bronchitis, bronchiolitis) a/nebo v alveolech (emfyzém), které způsobují perzistentní, často progresivní obstrukci dýchacích cest [1]. Z celosvětového hlediska je zátěž CHOPN obrovská. V současnosti jde o třetí nejčastější příčinu úmrtí, na CHOPN ročně umírají 3 miliony lidí z celkem 384 milionů pacientů trpících CHOPN. „Onemocnění není spojeno jen s kouřením, ale i se znečištěním ovzduší,“ upozornil profesor Page.
Již dlouho je známo, že spouštěčem exacerbace CHOPN jsou bakteriální a virové infekce, pro něž představuje hlen živnou půdu. Hypersekrece hlenu je tedy jedním z nejdůležitějších nezávislých faktorů progrese CHOPN.
Role hlenových zátek ve studii COPDGene
Okluze dýchacích cest hlenovými zátkami vedou k rychlému poklesu plicních funkcí, špatné kvalitě života, vysokému riziku infekcí a pneumonií a vysokému počtu akutních exacerbací, hospitalizací a k vysoké mortalitě. Až 67 procent pacientů s CHOPN má trvale přítomny hlenové zátky v dýchacích cestách po dobu jednoho roku a 73 procent po dobu pěti let. Hypersekrece hlenu vede k výraznému poklesu plicních funkcí (FEV1).
 Multicentrická, observační, prospektivní studie s 4 363 pacienty (COPDGene) prokázala, že v době sledování 5–10 let byla přítomnost hlenových zátek spojena se zvýšenou mortalitou ze všech příčin, přičemž vyšší počet plicních segmentů s hlenovými zátkami se jevil jako negativní prediktivní faktor [2]. Subanalýzou studie COPDGene se zjistilo, že riziko úmrtí ze všech příčin bylo významně zvýšené u pacientů ve stadiu GOLD 1 s ≥ 1 plicním segmentem okludovaným hlenovými zátkami (1,48; 95% CI 1,10–1,86; p < 0,01) ve srovnání s pacienty bez okluze. Pacienti ve stadiu GOLD 1 a ≥ 3 okludovanými plicními segmenty měli významně vyšší riziko úmrtí (1,89; 95% CI 1,43–2,36; p < 0,001). U pacientů s 1–2 okludovanými plicními segmenty a u pacientů ve stadiu GOLD 2–4 nebylo zjištěno zvýšené riziko úmrtí. Analýza „Number Needed to Harm“ ukázala, že k jednomu zaznamenanému úmrtí bylo zapotřebí šesti pacientů s ≥ 3 okludovanými segmenty ve stadiu GOLD 1, ve srovnání s 26 pacienty ve stadiu GOLD 4 [3]. „Je nutné diagnostikovat CHOPN co nejdříve, abychom včas ovlivnili hypersekreci hlenu a zvrátili nepříznivou prognózu pacientů s vyšším počtem okludovaných plicních segmentů,“ doporučil profesor Page.
Multicentrická, observační, prospektivní studie s 4 363 pacienty (COPDGene) prokázala, že v době sledování 5–10 let byla přítomnost hlenových zátek spojena se zvýšenou mortalitou ze všech příčin, přičemž vyšší počet plicních segmentů s hlenovými zátkami se jevil jako negativní prediktivní faktor [2]. Subanalýzou studie COPDGene se zjistilo, že riziko úmrtí ze všech příčin bylo významně zvýšené u pacientů ve stadiu GOLD 1 s ≥ 1 plicním segmentem okludovaným hlenovými zátkami (1,48; 95% CI 1,10–1,86; p < 0,01) ve srovnání s pacienty bez okluze. Pacienti ve stadiu GOLD 1 a ≥ 3 okludovanými plicními segmenty měli významně vyšší riziko úmrtí (1,89; 95% CI 1,43–2,36; p < 0,001). U pacientů s 1–2 okludovanými plicními segmenty a u pacientů ve stadiu GOLD 2–4 nebylo zjištěno zvýšené riziko úmrtí. Analýza „Number Needed to Harm“ ukázala, že k jednomu zaznamenanému úmrtí bylo zapotřebí šesti pacientů s ≥ 3 okludovanými segmenty ve stadiu GOLD 1, ve srovnání s 26 pacienty ve stadiu GOLD 4 [3]. „Je nutné diagnostikovat CHOPN co nejdříve, abychom včas ovlivnili hypersekreci hlenu a zvrátili nepříznivou prognózu pacientů s vyšším počtem okludovaných plicních segmentů,“ doporučil profesor Page.
Důvody pro časnou intervenci
Ve starší studii [4] byla použita data ze studie The Copenhagen City Heart Study u 5 354 žen a 4 081 mužů ve věku 30 až 79 let s posouzením kuřáckých návyků, respiračních symptomů a spirometrie při dvou kontrolách s odstupem pěti let. Chronická hypersekrece hlenu byla významně a konzistentně spojena jak s nadměrným poklesem FEV1, tak se zvýšeným rizikem následné hospitalizace a morbidity v důsledku CHOPN.
Další analýza studie COPDGene [5] poukázala na skutečnost, že k největšímu poklesu FEV1 dochází v časných stadiích CHOPN (GOLD 1–2). V pětiletém sledování byl největší průměrný roční pokles plicních funkcí u stadia GOLD 1 (54 ml/rok) a GOLD 2 (46 ml/rok), ve stadiu GOLD 3 klesla FEV1 o 32 ml/rok. Paradoxem je, že většina studií se zabývá GOLD 4, kde byl pozorován roční pokles takřka minimální – 5 ml.
Ve prospěch časné diagnostiky a intervence svědčí i výsledky multicentrické pilotní studie [6], která prokázala, že k největšímu omezení fyzické aktivity dochází od stadia GOLD 2 (s mírnými exacerbacemi), kdy je tedy nejvyšší čas na intervenci. Ve vyšších stadiích dochází ke středně závažným komplikacím, disabilitě, špatné kvalitě života, v posledních stadiích jsou komplikace a exacerbace vážné, život ohrožující až letální.
Studie s mukoaktivními léky
Existují studie s N‑acetylcysteinem (NAC, studie BRONCUS), s carbocysteinem (PEACE) a s erdosteinem (RESTORE), z nichž jediná RESTORE poskytuje data o trvání exacerbací, době bez exacerbace a tíže CHOPN hodnocené pacienty. Všechny studie uvádějí počet akutních exacerbací a studie s NAC zaznamenala pozitivní výsledky jen u pacientů neužívajících inhalační kortikosteroidy.
 Studie RESTORE (Reducing Exacerbations and Symptoms by Treatment with ORal Erdosteine in COPD) je prospektivní, randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie, do níž byli zařazeni pacienti ve věku 40–80 let s CHOPN stadia GOLD 2–3 [7]. Pacienti dostávali 300 mg erdosteinu dvakrát denně nebo placebo – obojí v kombinaci s obvyklou léčbou CHOPN po dobu 12 měsíců. Primárním cílem byl počet akutních exacerbací v průběhu studie.
Studie RESTORE (Reducing Exacerbations and Symptoms by Treatment with ORal Erdosteine in COPD) je prospektivní, randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie, do níž byli zařazeni pacienti ve věku 40–80 let s CHOPN stadia GOLD 2–3 [7]. Pacienti dostávali 300 mg erdosteinu dvakrát denně nebo placebo – obojí v kombinaci s obvyklou léčbou CHOPN po dobu 12 měsíců. Primárním cílem byl počet akutních exacerbací v průběhu studie.
V předem specifikované populaci 445 pacientů (74 % mužů; průměrný věk 64,8 roku, FEV1 51,8 % náležitých hodnot) snížil erdostein počet exacerbací o 25 procent a počet exacerbací u jednoho pacienta za rok o 19,4 procenta v porovnání s placebem. Erdostein zkrátil dobu trvání exacerbace bez ohledu na závažnost příhody o 24,6 procenta, což je první publikovaný klinický výsledek dosažený při léčbě schválenou dávkou mukoaktivního přípravku. „Doba trvání exacerbace má pro pacienty velký význam. Je rozdíl, je‑li hospitalizován tři, nebo jedenáct dní,“ upozornil profesor Page.
Procento pacientů s nežádoucími účinky bylo podobné ve skupinách s placebem i erdosteinem [7]. „To znamená, že erdostein je bezpečný i při dlouhodobém užívání,“ doplnil profesor Page.
Literární data vypovídají o tom, že 52 procent pacientů má CHOPN stadia GOLD 2 [1,8]. Post hoc analýza studie RESTORE [9] zahrnovala účastníky s CHOPN se spirometricky středně závažným omezením průtoku vzduchu (GOLD 2: FEV1 po bronchodilataci 50–79 % náležitých hodnot; n = 254) a prokázala, že erdostein redukuje u pacientů s CHOPN stadia GOLD 2 počet exacerbací za rok o 47,0 procenta.
Další post hoc analýza studie RESTORE [10] zjistila, že významně méně pacientů (CHOPN stadia GOLD 2 až 3) se středně těžkými až těžkými exacerbacemi bylo léčeno antibiotiky ± perorálními kortikosteroidy, když užívali erdostein (71,4 %) oproti placebu (85,8 %, p < 0,05). Včasná intervence u pacientů s CHOPN by mohla vést k příznivým účinkům na progresi onemocnění a lepším klinickým výsledkům. Pravidelná včasná léčba erdosteinem jako doplňkovou terapií prokázala významný vliv na četnost a trvání exacerbací. „Včasná intervence CHOPN mukolytickou léčbou vede k lepším klinickým výsledkům v dlouhodobém horizontu,“ řekl profesor Page.
Oproti tomu čínská studie [11] s téměř 1 000 pacienty neprokázala signifikantní efekt NAC na počet exacerbací, zlepšení plicních funkcí a symptomů. NAC měl více nežádoucích účinků než placebo. Této studii jsou podle profesora Kardose [12] vytýkány metodické chyby a zkreslení.
Svou prezentaci zakončil profesor Page slovy „Erdostein je mukolytikem volby, které je účinné jak u uživatelů inhalačních kortikosteroidů, tak u těch, kteří je neužívají. Měl by být použit v terapii CHOPN co nejdříve.“
Kdo profituje z léčby zahrnující mukoaktivní přípravky?
Docent Vladimír Koblížek upozornil v úvodu své prezentace na editorial profesora Petera Kardose [12] v časopise Lung z května 2025, v němž autor vyzdvihuje úlohu hlenu u respiračních onemocnění, která byla dlouho přehlížena. Profesor Kardos se zmiňuje také o výsledcích studie RESTORE, která jednoznačně prokázala pozitivní význam mukolytické léčby erdosteinem. Velký prostor věnuje studii, jejímž prvním autorem je Jaromír Zatloukal a která hodnotí data reálné praxe na základě informací z českého registru pacientů s CHOPN. Hlavním výsledkem studie bylo zjištění, že v kohortě s mukoaktivní terapií, navzdory vyšší bazální roční míře exacerbací 1,6 oproti 0,9 (p < 0,001) a horším klinickým charakteristikám v mukoaktivní skupině, byl po úpravě o matoucí faktory zjištěn významný rozdíl ve změně roční míry exacerbací ve prospěch mukoaktivní léčby.
V hlavní roli mucin
Hypersekrece hlenu je základním symptomem mnoha respiračních onemocnění. U většiny z nich (bronchitis, bronchiektazie, flu‑like a další) se zmnoží hlen 5B, který by se dal nazval „fyziologickým“, jenž se snadno vykašlává. U části pacientů s CHOPN dochází k hypersekreci viskózního mucinu 5AC na úkor fyziologického 5B. Hypersekrece mucinu 5AC vede k tvorbě hlenových zátek, jejichž výskyt a význam byl zkoumán u pacientů zařazených do studie COPDGene [13]. Hlenové zátky v dýchacích cestách jsou často identifikovány na CT u pacientů s CHOPN s anamnézou kouření bez symptomů mukózní hypersekrece jako tzv. tiché hlenové zátky. Autoři si položili otázku: Jaké jsou rizikové a ochranné faktory spojené s tichými hlenovými zátkami v dýchacích cestách u pacientů s CHOPN? Jsou tiché hlenové zátky spojeny s funkčními, strukturálními a klinickými ukazateli onemocnění? Z celkového počtu 4 363 účastníků studie COPDGene nebyl u 1 739 pacientů pozorován kašel ani hlen. V této asymptomatické skupině byly u 627 nemocných (36 %) na CT vyšetření identifikovány hlenové zátky v dýchacích cestách. Rizikovými faktory pro výskyt tichých hlenových zátek ve srovnání se symptomatickými hlenovými zátkami byly vyšší věk (OR 1,02), ženské pohlaví (OR 1,40) a černošská rasa (OR 1,93) (všechny hodnoty p < 0,01). U pacientů bez kašle nebo hlenu byly tiché hlenové zátky (oproti absenci hlenových zátek) v adjustovaných modelech spojeny s horším výsledkem testu šestiminutové chůze, horší klidovou saturací arteriální krve kyslíkem, horší předpokládanou hodnotou FEV1, větším emfyzémem, tlustšími stěnami dýchacích cest a vyšším výskytem těžké exacerbace v uplynulém roce. To znamená, že tiché hlenové zátky jsou spojeny s horšími funkčními, strukturálními a klinickými ukazateli onemocnění. „Zde jde o skrytou produkci hlenu, kterou je nutné řešit. Mucin u CHOPN má prozánětlivé účinky, stimuluje produkci cytokinů a zhoršuje zánět v plíci,“ vysvětlil docent Koblížek.
K dispozici jsou tři mukolytické přípravky: NAC, carbocystein a erdostein, které se po průniku do krve dostávají do dobře prokrvených bronchiolů, a to zejména těch s hlenovými zátkami a zánětem. Je nutné zvážit, kterým pacientům přídatná léčba mukolytiky prospěje a který z jmenovaných přípravků zvolit. U erdosteinu mají „přídatný“ efekt prokázané antibakteriální a antiadhezní účinky.
Data z reálné praxe
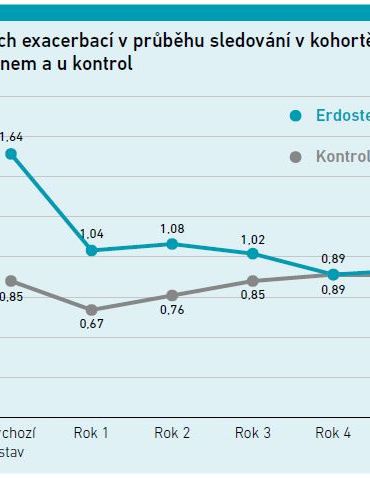
Díky třinácti letům práce České multicentrické výzkumné databáze CHOPN (registr České pneumologické a ftizeologické společnosti ČLS JEP), do které bylo zapojeno 12 center a více než 20 spolupracovníků a která čítá 784 pacientů s CHOPN, mají čeští pneumologové k dispozici validní data z reálné praxe. Proto lze hodnotit efekt mukoaktivní léčby, jak uvádí pětileté sledování uveřejněné letos v časopise Lung [14]. Celkem 452 dospělých pacientů z České multicentrické výzkumné databáze CHOPN s FEV1 ≤ 60 % předpokládané hodnoty po podání bronchodilatancia dostávalo standardní léčbu a bylo sledováno po dobu pěti let. Během prvních 24 měsíců dostávalo 81 pacientů pravidelné mukoaktivní léky na bázi thiolů (77 erdostein, 4 NAC) podle uvážení ošetřujícího lékaře a 371 pacientů nedostávalo žádnou mukoaktivní léčbu (kontrolní skupina). Primárním cílem byl roční počet/míra exacerbací CHOPN za pět let. „Zajímavé bylo, že mukoaktivní léčbu dostávali pacienti s horším stavem na začátku sledování,“ pronesl docent Koblížek (viz graf 1).
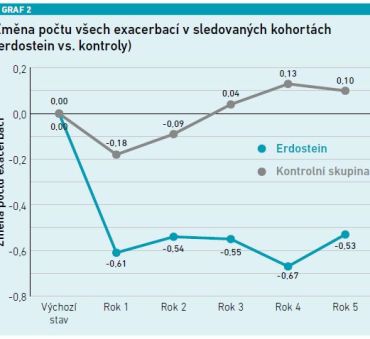
Pacienti, kteří dostávali mukoaktivní léčbu po dobu 24 měsíců, měli ve srovnání s kontrolní skupinou významně větší redukci všech exacerbací oproti výchozímu stavu (−0,61 vs. −0,18, p = 0,026; −0,54 vs. −0,09, p = 0,007; −0,55 vs. 0,04, p = 0,005; −0,67 vs. 0,13, p = 0,002; −0,53 vs. 0,10, p = 0,019 v prvním až pátém roce; viz graf 2). Snížení středně těžkých exacerbací bylo také významně větší u pacientů, kteří dostávali mukoaktivní léčbu, oproti pacientům, kteří ji neužívali. Míra exacerbací byla ve větší míře snížena v podskupinách s kašlem nebo s CHOPN 3.–4. stadia, které dostávaly mukoaktivní léčbu, ale byla nezávislá na použití inhalačních kortikosteroidů.
Dodatečná analýza senzitivity se zohledněním dalších faktorů (FEV1, kašel a počet exacerbací na začátku) potvrdila přínos perorální mukoaktivní léčby.
Komu erdostein podat?
Podle slov docenta Koblížka z léčby erdosteinem profitují pacienti s kašlem a expektorací, s vyšším skóre CAT (podle dotazníku hodnotícího tíži příznaků), sníženou FEV1 a častými exacerbacemi. Je nutné možnost léčby erdosteinem zvažovat i u nestálých forem, například překryvu fenotypů CHOPN s bronchitidou s častými exacerbacemi a bronchiektaziemi. Další skupinou pacientů, kteří mohou mít z terapie erdosteinem přínos, jsou ti, u nichž lze předpokládat přítomnost tichých zátek.
Další působení
Milánští autoři sledovali in vitro, jak erdostein ovlivňuje protizánětlivou aktivitu lidských plicních epiteliálních buňkách A549‑hACE2 infikovaných SARS‑CoV‑2 nebo respiračním syncytiálním virem (RSV) a v buňkách lidského karcinomu tlustého střeva Caco‑2 infikovaných virem chřipky A(H1N1) [15]. Buňky byly ošetřeny různými koncentracemi erdosteinu nebo jeho aktivního metabolitu 3‑(4,5‑dimethylthiazol‑2‑yl)‑2,5‑difenyl‑2H‑tetrazoliumbromidu (MET‑1) před virovou infekcí a po ní. Virová replikace/zátěž v supernatantech buněčné kultury byla měřena pomocí kvantitativní polymerázové řetězové reakce v reálném čase (RT‑qPCR) a digitální kapkové PCR. Genová exprese signálních drah vrozené imunitní odpovědi a oxidační stres byly analyzovány pomocí reverzní transkripční PCR custom‑array.
Výsledky ukázaly, že erdostein a jeho aktivní metabolit v koncentracích odpovídajících schválené terapeutické dávce u lidí nebyly cytotoxické. Analýza transkriptomu ukázala, že erdostein aktivoval vrozené imunitní odpovědi stimulací nadměrné exprese drah interferonu typu I a inflamazomu a moduloval oxidační stres indukcí modulace drah oxidačního stresu a GSH.
Závěrem docent Koblížek shrnul:
- U pacientů s klesající FEV1 a stoupajícím skóre CAT je nutné uvažovat o provedení CT. Důvodem je posouzení kvality plicní tkáně (progrese emfyzému s nutností operační redukce objemu, vyloučení tumoru či hlenových zátek).
Literatura:
- Global Initiative for Chronic Obstructive Lung Disease. GOLD Report 2025. GLOBAL STRATEGY FOR PREVENTION, DIAGNOSIS AND MANAGEMENT OF COPD: 2025 Report. [online]. [cit. 2025‑06‑25]. Dostupné z: https://goldcopd.org/wp‑content/uploads/2024/11/GOLD‑2025‑Report‑v1.0‑15Nov2024_WMV.pdf.
- Diaz AA, Orejas JL, Grumley S, et al. Airway‑Occluding Mucus Plugs and Mortality in Patients With Chronic Obstructive Pulmonary Disease. JAMA. 2023;329(21):1832–1839.
- Rogliani P, Calzetta L. Impact of Airway‑Occluding Mucus Plugs on Mortality in Patients with COPD According to Disease Severity: A Subset Analysis of Data From COPDGene. Int J Chron Obstruct Pulmon Dis. 2025;20:831–840.
- Vestbo J, Prescott E, Lange P. Association of chronic mucus hypersecretion with FEV1 decline and chronic obstructive pulmonary disease morbidity. Copenhagen City Heart Study Group. Am J Respir Crit Care Med. 1996;153(5):1530–1535.
- Bhatt SP, Soler X, Wang X, et al.; COPDGene Investigators. Association between Functional Small Airway Disease and FEV1 Decline in Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med. 2016;194(2):178–184.
- Troosters T, Sciurba F, Battaglia S, et al. Physical inactivity in patients with COPD, a controlled multi‑center pilot‑study. Respir Med. 2010;104(7):1005–1011.
- Dal Negro RW, Wedzicha JA, Iversen M, et al.; RESTORE group; RESTORE study. Effect of erdosteine on the rate and duration of COPD exacerbations: the RESTORE study. Eur Respir J. 2017;50(4):1700711.
- Haughney J, Gruffydd‑Jones K, Roberts J, et al. The distribution of COPD in UK general practice using the new GOLD classification. Eur Respir J. 2014;43(4):993–1002.
- Calverley PMA, Page C, Dal Negro RW, et al. Effect of Erdosteine on COPD Exacerbations in COPD Patients with Moderate Airflow Limitation. Int J Chron Obstruct Pulmon Dis. 2019;14:2733–2744.
- Calverley PMA, Papi A, Page C, et al. The Effect of Maintenance Treatment with Erdosteine on Exacerbation Treatment and Health Status in Patients with COPD: A Post‑Hoc Analysis of the RESTORE Dataset. Int J Chron Obstruct Pulmon Dis. 2022;17:1909–1920.
- Zhou Y, Wu F, Shi Z, et al.; China N‑acetylcysteine in Mild‑to‑moderate COPD Study Group. Effect of high‑dose N‑acetylcysteine on exacerbations and lung function in patients with mild‑to‑moderate COPD: a double‑blind, parallel group, multicentre randomised clinical trial. Nat Commun. 2024;15(1):8468.
- Kardos P. Mucus: An Underestimated Player in Airway Diseases. Lung. 2025;203(1):60.
- Mettler SK, Nath HP, Grumley S, et al. Silent Airway Mucus Plugs in COPD and Clinical Implications. Chest. 2024;166(5):1010–1019.
- Zatloukal J, Page C, Brat K, et al. Effect of Treatment with Mucoactive Drugs on COPD Exacerbations During 5 years of Follow‑up in the Czech Republic: A Real‑World Study. Lung. 2025;203(1):61.
- Santus P, Strizzi S, Danzo F, et al. Antiviral Effect of Erdosteine in Cells Infected with Human Respiratory Viruses. Pathogens. 2025;14(4):388.