U CAR‑T nabíhají dlouhodobá data – a jsou pozitivní
CAR‑T terapie v současnosti představuje možnost léčby u pacientů s pokročilým hematoonkologickým onemocněním v situacích, kdy často již není jiná účinná modalita dostupná. U podstatné části takto léčených nemocných dochází k dlouhotrvající léčebné odpovědi, kdy se přežití počítá na roky. Výsledky pozorované u české populace přitom odpovídají datům z registračních studií z reálné praxe ve světě. O potenciálu této léčby se hovořilo napříč programem 2. hematologického a transfuziologického sjezdu v Olomouci. Cíleně na tuto problematiku se pak zaměřilo sympozium podpořené společností Gilead.
Sympozium otevřel MUDr. František Folber, Ph.D., z Interní hematologické a onkologické kliniky LF MU a FN Brno. Ve svém sdělení se blíže věnoval současnému postavení CAR‑T v léčbě non‑Hodgkinových lymfomů. Nejprve připomněl, že medián přežití pacientů s relabujícím/refrakterním B‑buněčným non‑Hodgkinovým lymfomem dosahuje pouze 6,3 měsíce. Dvouleté přežití činí 20 procent. Jak ukazují data z roku 2011, relaps nebo refrakterita (R/R) se týká asi třetiny pacientů s DLBCL/PMBCL (difuzním nebo primárním mediastinálním velkobuněčným B lymfomem). Pouze asi polovina těchto pacientů je vhodná k autologní transplantaci hematopoetických buněk (ASCT) a jen polovina z nich odpoví na záchrannou terapii a ASCT podstoupí. Transplantace vede k vyléčení zhruba ve 40 procentech případů. Proto jsou u 90 procent pacientů s R/R DLBCL/PMBCL potřebné další terapeutické možnosti.
Jedním z nových přístupů, dnes již zcela reálným, je léčba CAR‑T lymfocyty. Tato terapie spočívá v ex vivo modifikaci vlastních T lymfocytů pacienta, do nichž je genetickými metodami vložen gen pro chimerický antigenní receptor (CAR) a po namnožení jsou podány zpět pacientovi. Na extracelulární části CAR se nachází vazebné místo pro specifický antigen podobné monoklonální protilátce a nitrobuněčná část receptoru slouží k aktivaci T lymfocytu. Tato genetická manipulace dává T lymfocytům požadovanou specificitu, ale také umožňuje ovlivnit jejich aktivační a proliferační potenciál. Po navázání T lymfocytů na nádorovou buňku exprimující daný antigen dochází za přítomnosti kostimulačních faktorů k jejich aktivaci. CAR druhé generace obsahuje navíc jednu kostimulační signální doménu, k aktivaci CAR‑T lymfocytů tak dochází automaticky, bez potřeby dalších kostimulačních signálů. Takto upravené CAR‑T lymfocyty mohou značně zmenšit nádorovou masu, která exprimuje na nádorových buňkách cílový antigen.
V praxi zahrnuje postup CAR‑T terapie odběr T lymfocytů od pacienta pomocí leukaferézy a jejich odeslání farmaceutické společnosti, kde je do nich po jejich separaci vložen pomocí virového vektoru gen pro CAR. Následuje namnožení těchto modifikovaných buněk, jejich úprava do terapeutické formy a zmrazení. Výrobek je poté odeslán do nemocnice, kde jsou upravené T lymfocyty podány pacientovi. Před zahájením CAR‑T terapie je nutný správný výběr vhodných pacientů a po podání CAR‑T lymfocytů jejich následné sledování a další péče.
Přípravkem 2. generace CAR‑T terapie pro léčbu R/R DLBCL/PMBCL je axikabtagen ciloleucel (axi‑cel). Jeho extracelulární segment cílí na antigen CD19 a je přes transmembránový segment napojen na aktivační doménu CD3ζ (známou z T lymfocytů) a kostimulační doménu CD28.
Účinnost a bezpečnost axi‑celu u chemorefrakterních difuzních velkobuněčných B lymfomů byla prokázána ve studii fáze 1/2 ZUMA‑1. Do této multicentrické studie bylo zařazeno sedm pacientů ve fázi 1 a 77 pacientů s DLBCL a 24 s PMBLC/tFL (transformovaným folikulárním lymfomem) ve fázi 2. Pacienti museli být v progresi (PD) nebo se stabilizací onemocnění (SD) po nejméně čtyřech cyklech terapie v 1. linii nebo alespoň dvou cyklech v dalších liniích nebo s relapsem do 12 měsíců od ASCT a jejich předchozí léčba musela obsahovat protilátku anti‑CD20 a antracyklin. Primárním sledovaným parametrem byl podíl celkových odpovědí na léčbu (ORR). Pacienti podstoupili leukaferézu a během výroby léčivého přípravku nebyla povolena přemosťující (bridging) terapie.
Zařazeno bylo 119 pacientů. K selhání výroby došlo pouze v jednom případě. Z důvodu nežádoucích příhod bylo dále z terapie vyřazeno osm pacientů a u dvou došlo k remisi. Axi‑cel byl tedy podán 108 pacientům (91 % indikací). Z nich byl u 77 histologicky identifikován DLBC/high grade B lymfom (HG‑BCL), v 16 případech tFL a v osmi případech PMBCL. Medián doby mezi odběrem a doručením léčivého přípravku byl 17 dní.
Výsledky po mediánu sledování 15 měsíců ukázaly ORR 82 procent, včetně 58 procent kompletních remisí (CR). Setrvalá ORR byla pozorována u 42 procent pacientů, většinou se jednalo o CR (40 %). Roční PFS dosáhlo 44 procent a OS 59 procent. Relapsy byly pozorovány zejména v prvních třech až šesti měsících po podání axi‑celu.
Na základě těchto výsledků byl axi‑cel (Yescarta) schválen k léčbě dospělých pacientů R/R DLBCL a PMBCL po alespoň dvou liniích systémové léčby. Mezi indikace se bohužel nedostal HG‑BCL, přestože studie ZUMA‑1 zahrnovala i pacienty s tímto histologickým typem nádoru.
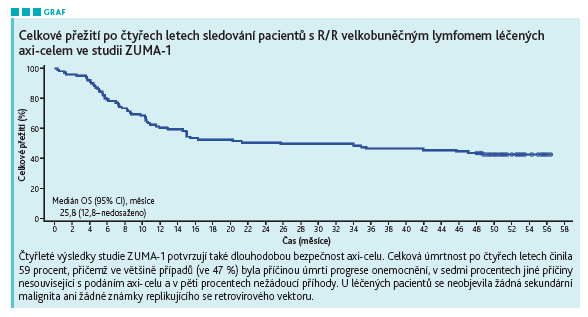
V roce 2020 byly publikovány již čtyřleté výsledky studie ZUMA‑1, kdy podíl žijících pacientů činil 44 procent. Medián OS dosáhl 25,8 měsíce (viz graf).
MUDr. Folber se věnoval také praktickým aspektům CAR‑T terapie. Manipulace s materiálem pro CAR‑T terapii vyžaduje speciální opatření. S produktem získaným leukaferézou je nutné manipulovat v čistých prostorách. Odebraný materiál se připraví k transportu výrobci léčivého přípravku – balí se do speciálního vaku a transportního boxu, v němž se po vložení produktu leukaferézy aktivuje chlazení. Transport probíhá při teplotě 2–8 °C za kontinuálního monitorování a přítomnosti dvou proškolených osob.
Výsledný léčivý přípravek je přijat nemocnicí v přesně stanovenou hodinu. V praxi je průměrná doba výroby trochu delší než ve studii ZUNA‑1. Při převzetí je nutné zkontrolovat integritu vaku a skladovat přípravek při teplotě –150 °C a nižší. Používá se kryogenní nádoba na páry kapalného dusíku s teplotní stabilitou –190 °C. Přípravek se podává po kontrole identifikačních údajů a rozmrazení u lůžka pacienta v krátké infuzi.
CAR‑T v české praxi
Interní hematologická a onkologická klinika LF MU a FN Brno získala certifikát k podávání CAR‑T terapie v říjnu 2019, prvnímu pacientovi byla podána o dva měsíce později. Do srpna 2021 bylo k léčbě axi‑celem na tomto pracovišti indikováno 17 pacientů, z nich bylo osm doporučeno z jiných pracovišť. Věkové rozmezí nemocných bylo 24–71 let, devět pacientů mělo PMBCL a osm DLBCL po přechozí léčbě dvěma až pěti liniemi. Stadium onemocnění bylo u 16 pacientů SD/PD a výkonnostní stav dle ECOG se pohyboval od 0 do 2. Léčbu podstoupilo 15 pacientů. Z nemocnice byli po podání propuštěni 14.–33. den a délka jejich dosavadního sledování je v rozmezí 1 až 21 měsíců. U dvou pacientů byl axi‑cel podán před méně než jedním měsícem a zatím u nich nejsou k dispozici výsledky. Ze 13 ostatních pacientů bylo u devíti (69 %) dosaženo ORR, včetně tří pacientů (46 %) s CR. U zbývajících čtyř byla pozorována SD/PD. Zemřeli dosud čtyři pacienti, dva z důvodu progrese onemocnění, jeden z důvodu toxicity (sepse a multiorgánové selhání) a jeden na COVID‑19. Z nežádoucích příhod se u 12 z 15 pacientů (80 %) objevil CRS, ve všech případech stupně 1–2. Syndrom neurotoxicity byl zjištěn u pěti léčených (33 %), přičemž u tří z nich se jednalo o stupeň 3–4. Z ostatních nežádoucích příhod byla v jednom případě náhodně zjištěna plicní embolie a dosud se nevyskytly žádné pozdní komplikace.
České výsledky jsou srovnatelné s daty ze studií z reálné praxe v USA, kde se OS pohybovalo po šesti měsících mezi 75–78 procenty a po 12 měsících mezi 65–67 procenty, PFS po šesti měsících mezi 50–55 procenty a po 12 měsících kolem 45 procent.
Autologní anti‑CD19 CAR‑T buněčná terapie u lymfomu z plášťových buněk
Druhé prezentace se ujala doc. MUDr. Andrea Janíková, Ph.D., rovněž z Interní hematologické a onkologické kliniky LF MU a FN Brno. Zaměřila se na potenciál CAR‑T terapie u lymfomu z plášťových buněk (mantle cell lymphoma – MCL). Ten tvoří asi tři až deset procent všech NHL. Medián věku pacientů v době diagnózy MCL je 60 let a převažují muži v poměru 2 : 1. MCL je obecně pokládán za (semi)agresivní nevyléčitelné onemocnění. V českém registru Kooperativní lymfomové skupiny představuje MCL 8,3 procenta všech B‑buněčných lymfomů. K září 2020 bylo v tomto registru 1 500 pacientů. Roční incidence se v ČR pohybuje okolo 92 případů. Aktuální 5leté přežití (OS) pacientů s MCL dosahuje 65 procent, 5leté přežití bez progrese (PFS) 44 procent. Medián délky přežití pacientů s MCL zvyšuje podávání rituximabu. Pro srovnání, v letech 1999–2008 činilo 5leté OS 34,9 procenta u pacientů bez rituximabu a 48,5 procenta u pacientů s rituximabem.
Medián věku pacientů při 1. relapsu je 70 let, což významně ovlivňuje terapeutické možnosti i prognózu přežití. Jen u malé části nemocných je možná ASCT. I v léčbě relabujícího/refrakterního (R/R) MCL ve ≥ 3. linii lze dnes použít autologní anti‑CD19 CAR‑T terapii – přípravek Tecartus (KTE‑X19). Od axi‑celu se liší tím, že v průběhu výroby jsou odstraněny cirkulující CD19+ maligní buňky. Odstranění těchto buněk má omezit potenciální aktivaci a vyčerpání anti‑CD19 CAR‑T buněk během ex vivo výrobního procesu.
Tento přípravek byl hodnocen ve studii fáze 2 ZUMA‑2. Do ní byli zařazeni dospělí pacienti s R/R MCL (definovaným jako progrese po posledním terapeutickém režimu nebo nedosažení CR/PR při posledním režimu), kteří absolvovali jednu až pět předchozích linií léčby zahrnující antracykliny nebo bendamustin, protilátku proti CD20 a ibrutunib nebo acalabrutinib.
V rámci studie byl přípravek podán 68 pacientům. Medián doby od leukaferézy do podání KTE‑X19 činil 16 dnů. Primární analýza účinnosti se týká 60 pacientů, kteří k určitému datu dokončili šest měsíců sledování po první kontrole po podání CAR‑T terapie, a analýza účinnosti zahrnuje všech 68 pacientů, kterým byla léčba podána. Průměrný věk těchto 68 pacientů byl 65 let. Jednalo s o silně předléčené pacienty s mediánem tří dříve podávaných linií léčby. Více než polovina pacientů byla dříve léčena bendamusti nem, a přesto u nich byla úspěšně provedena leukaferéza. U 43 procent pacientů došlo dříve k relapsu po ASCT.
Primární sledovaný parametr po mediánu sledování 12,3 měsíce ukázal velmi příznivé výsledky. ORR bylo dosaženo u 93 procent pacientů, včetně 67 procent pacientů s CR. Remise bylo navíc dosaženo velmi rychle, iniciální odpověď byla patrná již po jednom měsíci a CR po třech měsících po podání CAR‑T terapie. Analýza podskupin rozdělených podle řady faktorů nenalezla žádný parametr, který by významně ovlivňoval dosažení ORR při léčbě KTE‑X19. Tyto faktory zahrnovaly věk, předchozí léčbu, morfologické charakteristiky MCL, proliferační index Ki‑67, riziko dle MIPI, stadium choroby, extranodální postižení, zasažení kostní dřeně, koncentraci LDH, přítomnost mutace TP53 či pozitivitu CD19.
Mediánu délky léčebné odpovědi nebylo při primární analýze výsledků dosaženo. Remise přetrvávala u 57 procent všech pacientů a u 78 procent pacientů, kteří dosáhli CR. Z prvních 28 zařazených pacientů, kteří měli medián doby sledování 27 měsíců, přetrvávala remise bez další terapie ve 43 procentech případů. Dosaženo nebylo ani mediánu PFS a OS.
Pokud se týká bezpečnosti, nežádoucí příhody se vyskytly u všech zařazených pacientů. Nežádoucí příhody stupně 4 se týkaly 79 procent léčených. V naprosté většině případů se ale jednalo o neutropenii a trombocytopenii, které jsou dobře terapeuticky zvládnutelné.
Na kongresu ASH v roce 2020 byly prezentovány výsledky studie ZUMA‑2 po mediánu sledování 17,5 měsíce. Remise přetrvávala k novému datu ve 48 procentech případů. Z pacientů, kteří dosáhli CR, bylo v remisi stále 70 procent. Z prvních 28 zařazených pacientů, jejichž medián sledování činil 32,3 měsíce, bylo v pokračující remisi bez další terapie 39 procent nemocných. Ani při této analýze ještě nebylo dosaženo mediánu DOR, OS ani PFS.
KTE‑X19 tak představuje přípravek CAR‑T terapie určený k jednorázovému podání, který ukazuje velmi slibnou účinnost u pacientů s R/R MCL. U 92 procent pacientů je dosaženo odpovědi na léčbu a dvě třetiny léčených dosáhnou kompletní remise. Účinnost naznačuje příznivé výsledky i z dlouhodobého hlediska. Toxicita léčby je řešitelná. Dlouhodobou účinnost a bezpečnost musejí ale ještě potvrdit další výsledky. Zdá se, že u některých pacientů s R/R MCL bude CAR‑T terapie řešením.
Přípravek KTE‑X19 je indikován k léčbě dospělých pacientů s R/R MCL po dvou či více liniích systémové léčby, které zahrnovaly léčbu inhibitorem Brutonovy tyrosinkinázy (BTK). V současné době je již tato léčba v české klinické praxi k dispozici.
MĚLI BYSTE VĚDĚT...
Přípravek Yescarta je schválen v léčbě dospělých pacientů s relabujícím/remitentním DLBCL a PMBCL po nejméně dvou liniích systémové léčby. V české reálné praxi vykazuje výsledky srovnatelné s registrační studií ZUMA‑1 a s daty z reálné praxe z USA. Asi 70–80 procent léčených dosahuje objektivní odpovědi na léčbu (ORR), včetně velkého podílu kompletních remisí (CR). Tato odpověď na léčbu je většinou spojena s dlouhodobou remisí, přičemž k selhání léčby dochází většinou v prvních třech až šesti měsících po podání a po jednom až dvou letech křivka přežití bez progrese (PFS) dosahuje plató. Jak ukazují výsledky čtyřletého sledování pacientů z registrační studie, podíl žijících pacientů činí 44 procent při mediánu celkového přežití (OS) 25,8 měsíce. Přípravek CAR‑T terapie s názvem Tecartus je indikován u nemocných s lymfomem z plášťových buněk (MCL). Od axi‑celu se liší pouze odstraněním cirkulujících maligních CD19+ buněk v průběhu výroby, které má omezit potenciální aktivaci a vyčerpání anti‑CD19 CAR‑T buněk během ex vivo výrobního procesu. KTE‑X19 prokázal velmi slibnou účinnost ve studii ZUMA 2, v níž dosáhlo ORR 92 procent léčených, včetně 67 procent CT. Po jednom roce léčby přetrvávala remise u 57 procent všech pacientů, pokračující odpověď na léčbu potvrzují i výsledky po mediánu sledování téměř 18 měsíců. Toxicita léčby je dobře terapeuticky zvládnutelná. Také tato CAR‑T terapie pro léčbu MCL je již v České republice k dispozici.