Význam včasného odhalení jaterní fibrózy v primární péči

Na management MASLD a včasné odhalení jaterní fibrózy se ve své přednášce, která zazněla 28. 3. na 19. kongresu primární péče, zaměřil MUDr. Václav Hejda, Oddělení gastroenterologie a hepatologie, I. interní klinika LF UK a FN Plzeň.
Morbidita, a především mortalita na jaterní onemocnění stoupá. V USA je onemocnění jater třetí nejčastější příčinou úmrtí u osob ve věku 45–64 let. Jak MUDr. Hejda upozornil, problémem je, že onemocnění probíhá po mnoho let skrytě a v okamžiku, kdy se pacient ocitne na urgentním příjmu nebo v ordinaci gastroenterologa, má často komplikace svědčící o přítomnosti jaterní cirhózy (pokročilé či finální fáze chronického jaterního onemocnění). Třetina těchto pacientů od primární návštěvy lékaře do roka umírá na komplikace jaterní cirhózy. Onemocnění poté již probíhá akcelerovaně, a je proto nezbytné je včas diagnostikovat a léčit.
Hlavní příčinou onemocnění jater v současné době je tzv. MASLD (metabolic dysfunction‑associated steatotic liver disease), donedávna označované jako ztukovatění jater (steatóza jater). Jedná se o metabolickou dysfunkci a dysregulaci a inzulinovou rezistenci vyplývající z nerovnováhy mezi příjmem a výdejem energie. Za vznikem tohoto onemocnění stojí především sedavý způsob života, nevhodné dietní návyky a nedostatečná fyzická aktivita, vliv má i vnější prostředí a genetika. „Bohužel stále řada lékařů z primární i interní péče má problém onemocnění jater především diagnostikovat a adekvátně léčit, kdy klíčová je informovanost pacientů o příčinách a důsledcích onemocnění a možnostech jeho ovlivnění, a pacienty s pokročilejším stadiem onemocnění odeslat do specializované gastroenterologické ambulance,“ uvedl MUDr. Hejda a význam včasného managementu MASLD dokumentoval na následující kazuistice.
Muž, 61 let, vyšetřen v plzeňské ambulanci 3/2021, bydliště na pomezí Plzeňského a Středočeského kraje (omezená komunikace pracovišť). Anamnéza: BMI 29,85, dlouhodobě (v dokumentaci) zvýšené jaterní testy pohybující se do dvojnásobku normy (v ordinaci PL ALT cca 1,5–2,0 µkat/l, AST 0,9–1,6 µkat/l, GGT 5–8 µkat/l). I přes tyto hodnoty byl pacient bez sonografického vyšetření, bez stagingu ev. stupně fibrózy, nebyl ani poučen o principu tohoto onemocnění. Intermitentně užíval na zvýšené jaterní testy ostropestřec nebo esenciální fosfolipidy. Až zpětně mu bylo na plzeňském pracovišti vypočteno skóre FIB‑4 2,5, které do té doby zůstávalo bez povšimnutí při vyšetření specialisty jiných oborů a jehož včasné stanovení mohlo mít zásadní vliv na včasnou diagnostiku jaterního poškození.
„V době návštěvy plzeňského pracoviště měl již hepatocelulární karcinom s metastázami do uzlin, do mediastina i do kalvy. V červenci mu byla indikována cílená léčba nexavarem, kterou hůře toleroval. Pro celkové zhoršení stavu a generalizaci onemocnění byla léčba přerušena a pacient byl postupně převeden na symptomatickou paliativní terapii. Zemřel 9/2021, tedy půl roku poté, kdy se poprvé objevil na našem pracovišti, což dokládá v úvodu predikovaný fakt o časném úmrtí pacientů s pokročilými komplikacemi jaterní cirhózy,“ popsal MUDr. Hejda.
Problémy v diagnostice MASLD
Klíčovým problémem v diagnostice MASLD je nedostatečná informovanost, absence časných příznaků, omezená dostupnost neinvazivní diagnostiky, obava z jaterní biopsie (kterou však již u většiny pacientů obvykle nepoužíváme) i absence účinné terapie. Jedinou účinnou terapií zatím zůstává pokles hmotnosti [1,2,3].
Jak MUDr. Hejda vysvětlil, označení MASLD se užívá od roku 2023 a odráží jaterní manifestaci metabolického syndromu se všemi atributy. Nová nomenklatura navíc definuje novou jednotku, tzv. MetALD, tedy přechod mezi čistě nealkoholovou (MASLD) a alkoholovou (ALD – alcohol‑associated liver disease) chorobou jater, kde je podíl alkoholu jistý, nikoli však dominantní. Právě ta postihuje nemalou část českých pacientů s MASLD, kteří ve zvýšené míře konzumují alkohol a současně mají kardiometabolické riziko. Větší důraz na vliv alkoholu na vývoj steatotického jaterního onemocnění umožňuje stratifikaci rizika a staging onemocnění na individuální úrovni [4].
Trajektorie onemocnění je závažná jak z hlediska individuálního, tak populačně‑epidemiologického. U třetiny pacientů steatóza vede k tzv MASH (steatohepatitida), přičemž každá hepatitida, ať virová, autoimunitní, nebo v tomto případě metabolická, vede k fibróze. Ta se dále rozvíjí do cirhózy – prekancerózy vedoucí k rozvoji hepatocelulárního karcinomu (HCC).
Pohled do budoucnosti rozhodně není optimistický, v roce 2030 se očekává dvojnásobný počet pacientů s MASH, přičemž u jednoho až dvou procent všech osob v populaci se během života vyvine cirhóza. Odhadovaná prevalence MASLD v roce 2040 má dosáhnout 56 procent populace, nad 50 let věku dokonce 62 procent. S tím samozřejmě poroste riziko jaterních selhání a úmrtí z jaterních příčin i nárůst HCC [5].
K největším rizikovým faktorům patří obezita – 80 procent pacientů s obezitou má MASLD, v případě diabetu 2. typu je to 65 procent. U nadváhy či obezity dochází u třetiny pacientů k rizikové MASH, kdy každý pátý má pokročilou fibrózu s rizikem progrese do cirhózy [6].
„Na základě steatózy dochází k jaterní fibróze, zde je nutné pacienty identifikovat, protože jsou na rizikové trajektorii. Fibróza zvyšuje riziko celkové mortality, jaterních příhod, KV příhod a HCC. Pacientům, kterým diagnostikujete steatózu a fibrózu, můžete ihned sdělit, že jsou ve vysokém KV riziku (ICHS, CMP, ICHDK) a pravděpodobně dříve manifestují tyto KV komplikace než jaterní onemocnění,“ zdůraznil MUDr. Hejda.
Diagnostika MASLD
Základem je diagnostikovat ztučnění jater, což je velmi jednoduché. Signifikantní steatóza zahrnuje třetinu hepatocytů, senzitivita a specificita je vysoká pro běžné sonografické vyšetření, kdy se srovnává echogenita jater a echogenita kůry ledvin. Při vyšší echogenitě jater je přítomna steatóza a je vyšší než 33 procent. MRI je velmi přesná, ale kvůli ceně a dlouhým čekacím dobám se příliš nevyužívá.
Důležitý je základní panel jaterních testů. Zde MUDr. Hejda doporučuje nabírat všechny čtyři jaterní testy, tedy ALT, AST, GGT a ALP (alkalická fosfatáza). Jak upozornil, zvýšená GGT neznamená vždy abúzus alkoholu, ale odráží steatózu, která může být způsobena alkoholem, ale mnohem častěji právě metabolickým syndromem. Často lze pozorovat nárůst GGT a s odstupem několika let ji následuje křivka glykémie v důsledku rozvíjejícího se DM2T. Z hlediska alkoholu je důležitější poměr AST/ALT – je‑li větší než 1, je ukazatelem přítomné cirhózy nebo abúzu alkoholu.
Charakteristická je vysoká prevalence pokročilé jaterní fibrózy a MASH u pacientů s DM2T – až 40 procent diabetiků může mít pokročilou jaterní fibrózu. „Zde nutně potřebujeme nástroj screeningu, abychom určili, zda pacienti fibrózu mají, a pak je dále, ev. ve spolupráci s hepatologem, začít léčit. Hlavním testem je skóre FIB‑4, které je velmi jednoduché spočítat,“ vysvětlil MUDr. Hejda. K jeho výpočtu jsou potřeba čtyři proměnné: věk, AST, ALT a trombocyty, lze je spočítat online. Zjištěná hodnota se dělí do tří pilířů: < 1,3 (nízké riziko, vylučuje fibrózu), > 2,6 (vysoké riziko, fibróza je pravděpodobná), oblast 1,3–2,6 (střední riziko, šedá zóna – nutno doplnit další specifické vyšetření). U pacientů ve středním a vysokém riziku by měla být provedena elastografie jater. Výsledek FIB‑4 tedy rozhoduje o dalším směrování pacienta s MASLD v rámci dispenzarizace. V běžné praxi umožňuje stratifikaci rizik, čím vyšší FIB‑4, tím vyšší riziko KV příhod a HCC.
Výhodou skóre FIB‑4 je podle MUDr. Hejdy jeho uspokojivá specificita a senzitivita (pro pacienty ve věku 36–65 let), automatická kalkulace, nepřináší zvýšenou časovou zátěž zdravotnického personálu a má prakticky nulové náklady. Jeho nevýhodou je nižší senzitivita zejména nad 65 let věku, nutná klinická expertiza, tj. komplexní zhodnocení nálezů a potřeba verifikace nálezu druhým testem (elastografie).
„Základní cesta pacienta by měla vycházet z identifikace rizikových faktorů, kterými jsou vyšší věk, KV onemocnění, metabolický syndrom, DM2T a obezita. Na úrovni primární péče mohou sice následovat drahé krevní testy, ale v zásadě stačí ty základní s minimálními náklady. Podle výsledků by měl být pacient po roce až třech letech zkontrolován PL nebo odeslán ke specialistovi,“ shrnuje MUDr. Hejda.
Management MASLD
Pacienti v riziku (s DM2T, abdominální obezita, KV riziko, dlouhodobá elevace jaterních enzymů, kde není jiná dg.) by měli mít vždy určeno skóre FIB‑4 a podle hodnoty by měla následovat elastografie nebo odeslání přímo ke specialistovi. V současné době není k dispozici žádná terapie on‑label, ve všech případech, jako je např. podávání vitaminu E, pioglitazonu nebo semaglutidu, se jedná o léčbu off‑label. Jedinou terapií on‑label stále zůstává redukce hmotnosti.
Neméně důležitý je management přidružených onemocnění. Jak MUDr. Hejda upozornil, statiny nejsou u pacientů s jaterním onemocněním kontraindikovány, ba naopak. K primárním léčebným krokům tedy patří dietní a režimová opatření, management KV rizika a snížení elevace jaterních enzymů.
„Je jednoznačně prokázáno, že pokud pacient zhubne 10 procent a více, u 50 procent pacientů dochází k regresi fibrózy. Fibróza, stejně jako do určité míry i cirhóza, je reverzibilní. Při snížení hmotnosti dojde u pacienta k regresi a ke stabilizaci funkce jater,“ připomněl MUDr. Hejda s tím, že současným trendem je semaglutid či ostatní agonisté GLP‑1, protože vedou k redukci hmotnosti. Hepatoprotektiva jsou v této indikaci bez jednoznačně prokázaného efektu. Jedná se o potravinové doplňky, navíc mohou s sebou nést riziko tzv. HILI (herbal inducted liver injury) i negativní vliv na pacienty, kteří spoléhají na jejich efekt a zanedbávají režimová opatření.
Místo UDCA v léčbě MASLD
 Jediným přípravkem, který může vést k poklesu až normalizaci jaterních testů a pravděpodobně i regresi fibrózy u specifického typu pacientů, je ursodeoxycholová kyselina (UDCA). Není řazena mezi hepatoprotektiva, jedná se o léčivo s prokazatelným efektem při terapii cholestázy (rizikový fenotyp MASLD charakteristický elevací GGT a ALP). U těchto pacientů je na základě EBM jednoznačně prokázáno, že UDCA jaterní enzymy snižuje/normalizuje, zejména GGT, má protizánětlivý účinek, zpomaluje progresi fibrózy nebo vede k její regresi. Vedle toho snižuje riziko komplikací a má i systémový efekt na další mimojaterní tkáně – na srdeční tkáň, střeva i cévy.
Jediným přípravkem, který může vést k poklesu až normalizaci jaterních testů a pravděpodobně i regresi fibrózy u specifického typu pacientů, je ursodeoxycholová kyselina (UDCA). Není řazena mezi hepatoprotektiva, jedná se o léčivo s prokazatelným efektem při terapii cholestázy (rizikový fenotyp MASLD charakteristický elevací GGT a ALP). U těchto pacientů je na základě EBM jednoznačně prokázáno, že UDCA jaterní enzymy snižuje/normalizuje, zejména GGT, má protizánětlivý účinek, zpomaluje progresi fibrózy nebo vede k její regresi. Vedle toho snižuje riziko komplikací a má i systémový efekt na další mimojaterní tkáně – na srdeční tkáň, střeva i cévy.
Je potřeba si uvědomit, že pacienti s cholestázou mají horší prognózu než ti s prostou elevací ALT a AST. Steatóza s cholestázou má vyšší mortalitu než ostatní fenotypy [7].
 „UDCA se běžně používá při terapii cholestatických onemocnění, jako je primární sklerozující cholangoitida (PSC) nebo primární biliární cholangoitida (PBC). UDCA je doporučena k léčbě hepatitid s cholestatickou složkou, kam patří i MASH s cholestatickými rysy,“ připomněl MUDr. Hejda. Podle 20 klinických studií UDCA zlepšuje aktivitu ALT/GGT u pacientů s MASLD (5 studií), s autoimunitní hepatitidou (6 studií) a virovou hepatitidou B nebo C (9 studií).
„UDCA se běžně používá při terapii cholestatických onemocnění, jako je primární sklerozující cholangoitida (PSC) nebo primární biliární cholangoitida (PBC). UDCA je doporučena k léčbě hepatitid s cholestatickou složkou, kam patří i MASH s cholestatickými rysy,“ připomněl MUDr. Hejda. Podle 20 klinických studií UDCA zlepšuje aktivitu ALT/GGT u pacientů s MASLD (5 studií), s autoimunitní hepatitidou (6 studií) a virovou hepatitidou B nebo C (9 studií).
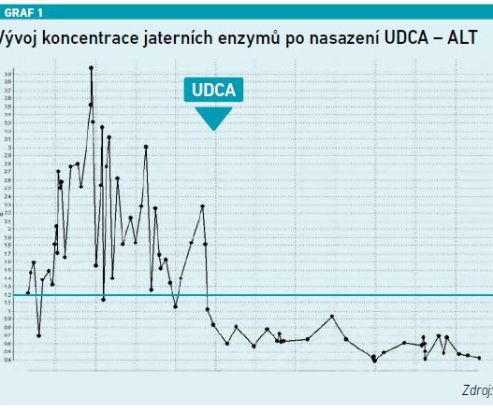
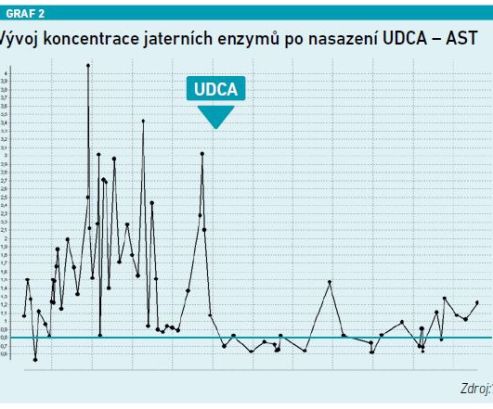
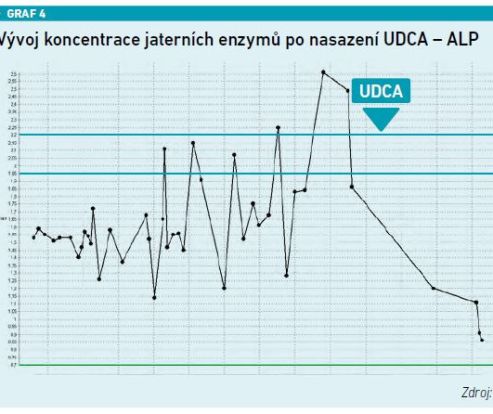
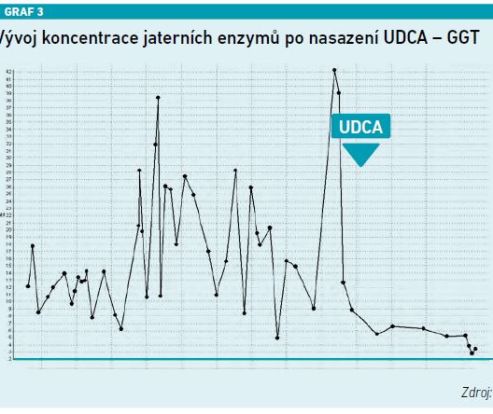 Jednoznačný přínos UDCA ukazuje prezentovaná kazuistika pacienta s velmi rizikovým fenotypem steatózy jater s cholestatickým syndromem. ALT osciluje do pětinásobku normy, obdobně AST, GGT se pohybovala až na úrovni 40 µkat/l, hodnota ALP byla lehce nad normou. V okamžiku nasazení UDCA došlo k rychlému a výraznému poklesu všech těchto parametrů. Zároveň pomocí elastografie bylo potvrzeno, že hodnota elasticity klesla z 19 na 11, došlo tedy k poklesu fibrózy (viz grafy 1–4).
Jednoznačný přínos UDCA ukazuje prezentovaná kazuistika pacienta s velmi rizikovým fenotypem steatózy jater s cholestatickým syndromem. ALT osciluje do pětinásobku normy, obdobně AST, GGT se pohybovala až na úrovni 40 µkat/l, hodnota ALP byla lehce nad normou. V okamžiku nasazení UDCA došlo k rychlému a výraznému poklesu všech těchto parametrů. Zároveň pomocí elastografie bylo potvrzeno, že hodnota elasticity klesla z 19 na 11, došlo tedy k poklesu fibrózy (viz grafy 1–4).
 Jak MUDr. Hejda shrnul, detekce steatózy je klíčová pro stanovení diagnózy MASLD a screenováni by měli být všichni rizikoví pacienti. Základním, levným, jednoduchým a dostupným vyšetřením je ultrasonografické vyšetření. „Skórovací indexy pro detekci steatózy příliš nepoužíváme, ale měly by být použity především k vyloučení pokročilé fibrózy, kdy hodnota FIB‑4 pod 1,3 fibrózu vylučuje. K dispozici je také jaterní elastografie, která s poměrně velkou přesností určí stupeň fibrózy; specialista pak určí interval, kdy by se toto vyšetření mělo opakovat. Pro pacienty s cholestatickou složkou jaterních onemocnění je k dispozici UDCA, která má nezpochybnitelný efekt při normalizaci jaterních testů a regresi fibrózy,“ uzavřel.
Jak MUDr. Hejda shrnul, detekce steatózy je klíčová pro stanovení diagnózy MASLD a screenováni by měli být všichni rizikoví pacienti. Základním, levným, jednoduchým a dostupným vyšetřením je ultrasonografické vyšetření. „Skórovací indexy pro detekci steatózy příliš nepoužíváme, ale měly by být použity především k vyloučení pokročilé fibrózy, kdy hodnota FIB‑4 pod 1,3 fibrózu vylučuje. K dispozici je také jaterní elastografie, která s poměrně velkou přesností určí stupeň fibrózy; specialista pak určí interval, kdy by se toto vyšetření mělo opakovat. Pro pacienty s cholestatickou složkou jaterních onemocnění je k dispozici UDCA, která má nezpochybnitelný efekt při normalizaci jaterních testů a regresi fibrózy,“ uzavřel.
Reference:
Ratziu V, Goodman Z, Sanyal A. Current efforts and trends in the treatment of NASH. J Hepatol. 2015;62(1 Suppl):S65–S75.
Rinella ME, Lominadze Z, Loomba R, et al. Practice patterns in NAFLD and NASH: real life differs from published guidelines. Therap Adv Gastroenterol. 2016;9(1):4–12.
Zelber‑Sagi S, Godos J, Salomone F. Lifestyle changes for the treatment of nonalcoholic fatty liver disease: a review of observational studies and intervention trials. Therap Adv Gastroenterol. 2016;9(3):392–407.
Rinella ME, Lazarus JV, Ratziu V, et al.; NAFLD Nomenclature consensus group. A multisociety Delphi consensus statement on new fatty liver disease nomenclature. Hepatology. 2023;78(6):1966–1986.
Le MH, Yeo YH, Zou B, et al. Forecasted 2040 global prevalence of nonalcoholic fatty liver disease using hierarchical bayesian approach. Clin Mol Hepatol. 2022;28(4):841–850.
Quek J, Chan KE, Wong ZY, et al. Global prevalence of non‑alcoholic fatty liver disease and non‑alcoholic steatohepatitis in the overweight and obese population: a systematic review and meta‑analysis. Lancet Gastroenterol Hepatol. 2023;8(1):20–30.
Ampuero J, Aller R, Gallego‑Durán R, et al.; HEPAmet Registry. The biochemical pattern defines MASLD phenotypes linked to distinct histology and prognosis. J Gastroenterol. 2024;59(7):586–597.