Lp(a) je v módě, ale plným právem
Lp(a) se v roce 1963, kdy byl objeven prof. Bergem, hřál na výsluní zájmu, protože se ukázalo, že je nezávislým rizikovým faktorem aterosklerózy. Postupně se ale ukázalo, že nejsou k dispozici způsoby, jak jeho koncentrace farmakologicky ovlivnit, a zájem o Lp(a) opadl. Nyní jsou ovšem na obzoru nové možnosti skutečně účinné intervence, proto se Lp(a) vrací do centra pozornosti a plní programy odborných konferencí. Nejinak tomu bylo na srpnovém kongresu ESC v Amsterdamu – zájem o přednášky o Lp(a) byl, okem pozorovatele, mimořádný.
Název Lp(a) je odvozen od označení „lipoprotein s antigenními vlastnostmi“. Skládá se z apolipoproteinu (a) a LDL částice (apolipoproteinu B100). Koncentrace Lp(a) v plazmě se pohybuje v rozmezí od < 0,1 mg/dl do > 300 mg/dl (< 0,2–750 nmol/l) a podstatné je, že z více než 90 procent ji určuje genetická variabilita v genu LPA. Polymorfismus počtu repetic v oblasti tzv. Kringle IV je zodpovědný za 30–70 procent variability koncentrace Lp(a). Exprese nízkého počtu (< 23) opakování K‑IV je charakterizována malými izoformami apolipoproteinu (a) a výrazně vyšší koncentrací Lp(a), a tím i vyšším rizikem aterosklerotických kardiovaskulárních onemocnění (ASKVO).
Největší „ošklivák“ v partě
Podstatné je, že Lp(a) je kauzální a nezávislý rizikový faktor KV onemocnění. Má četné účinky proaterogenní a prozánětlivé, protrombotické účinky nebyly zatím in vivo prokázány. Hlavní roli v prozánětlivém a prokalcifikačním účinku Lp(a) mají zřejmě oxidované fosfolipidy (OxPL), přenášené částicemi Lp(a) v plazmě. Ví se s jistotou, že zvýšené koncentrace Lp(a) jsou asociovány s ischemickou chorobou srdeční, cévní mozkovou příhodou, periferní aterosklerózou, srdečním selháním, aortální stenózou a selháním ledvin a vyšší KV a celkovou mortalitou (Kronenberg et al., Atherosclerosis 2023). Elevovaný Lp(a) nezvyšuje jen riziko první KV příhody či revaskularizace, ale i jejich rekurencí (Zhang et al., J Clin Lipidol 2023; Yoon et al., JACC Cardiovasc Interv 2021). Zobrazovací studie ukazují, že elevace Lp(a) negativně ovlivňuje také fenotyp aterosklerotických plaků. Zvýšený Lp(a) je spojen s akcelerovanou progresí plátů, které se stávají vulnerabilními, a to nezávisle na tradičních rizikových faktorech (Kaiser et al., J Am Coll Cadiol 2022). Dále se na OCT ukázalo, že vlivem vysokých hodnot Lp(a) dochází k zeslabování fibrózní čepičky non‑culprit plátů (Kato et al., Int J Cardiol Heart Vasc 2022). Prof. Erik Stroes z Academic Medical Centre v Amsterdamu, Nizozemsko, tak Lp(a) označil za skutečně ošklivého (nasty – angl.) bratra LDL cholesterolu, který už je sám o sobě titulován „zlý“.
Distribuce hodnot Lp(a) v populaci nekopíruje Gaussovu křivku. Copenhagen Study (Kamstrup et al., JAMA 2009) ukazuje, že asi 80 procent populace má normální hodnoty Lp(a) a cca 20 procent má hodnoty zvýšené. „Týká se to přibližně každého pátého člověka, takže jde o relativně častý výskyt. A platí, že čím vyšší jsou koncentrace Lp(a), tím vyšší je kardiovaskulární riziko,“ uvádí dr. Jaimini Ceglová z Imperial College Healthcare NHS Trust v Londýně, Velká Británie. O zhruba 30 procent vyšší KV riziko je spojeno s hodnotami nad 66. percentilem a při hodnotách nad 90. percentilem je riziko vyšší až o 50 procent. Evropská kardiologická společnost (ESC) považuje za rizikové hodnoty 50 mg/dl.
 V doporučeních ESC je zakotveno, že všichni dospělí by měli mít aspoň jednou za život změřeny hodnoty Lp(a). Pokud mají hodnoty nad 180 mg/dl, je jejich riziko považováno za stejně vysoké, jako je riziko osob s familiární hypercholesterolémií (FH), tedy velmi vysoké. „Pacienti s vysokými hodnotami Lp(a) by měli být z pohledu celoživotního kardiovaskulárního rizika v každém případě překlasifikováni, jinak u nich dojde k významnému podhodnocení rizika,“ varovala dr. Ceglová a demonstrovala důležitost stanovení koncentrací Lp (a) na kazuistice 57leté ženy. Ta měla v osobní anamnéze fibromylagie, v roce 2022 podstoupila PCI. Žena byla nekuřačka s TK 132/79 mm Hg a normálním body‑mass indexem. Užívá lisinopril 10 mg, ASA/klopidogrel, metoprolol 50 mg, atorvastatin 20 mg. Její laboratorní výsledky při léčbě nejsou nijak pozoruhodné: HbA1c 28 mmol/mol, celkový cholesterol 4,8 mmol/l, HDL‑C 1,4 mmol/l, LDL‑C 2,5 mmol/l, triglyceridy 1,8 mmol/l, CRP 1 mg/l (před léčbou byl celkový cholesterol 6,8 mmol/l, HDL‑C 1,4 a LDL‑C 4,4 mmol/l, triglyceridy 2,1 mmol/l). Navzdory nijak dramatickým výsledkům musela žena už v relativně mladém věku podstoupit revaskularizaci, varující byla i její rodinná anamnéza: otec měl infarkt myokardu v 59 letech a bratr podstoupil revaskularizaci na prahu šedesátky. Bylo zřejmé, že se někde ukrývá ještě jiná příčina akcelerovaného aterosklerotického procesu, proto byly pacientce změřeny koncentrace Lp(a), které se ukázaly být extrémně zvýšené (355 nmol/l [145 mg/dl], přičemž dle stanoviska EAS z roku 2010 byla pro zpřesnění odhadu desetiletého rizika ASKVO stanovena hraniční hodnota Lp(a) 50 mg/dl [125 nmol/l]).
V doporučeních ESC je zakotveno, že všichni dospělí by měli mít aspoň jednou za život změřeny hodnoty Lp(a). Pokud mají hodnoty nad 180 mg/dl, je jejich riziko považováno za stejně vysoké, jako je riziko osob s familiární hypercholesterolémií (FH), tedy velmi vysoké. „Pacienti s vysokými hodnotami Lp(a) by měli být z pohledu celoživotního kardiovaskulárního rizika v každém případě překlasifikováni, jinak u nich dojde k významnému podhodnocení rizika,“ varovala dr. Ceglová a demonstrovala důležitost stanovení koncentrací Lp (a) na kazuistice 57leté ženy. Ta měla v osobní anamnéze fibromylagie, v roce 2022 podstoupila PCI. Žena byla nekuřačka s TK 132/79 mm Hg a normálním body‑mass indexem. Užívá lisinopril 10 mg, ASA/klopidogrel, metoprolol 50 mg, atorvastatin 20 mg. Její laboratorní výsledky při léčbě nejsou nijak pozoruhodné: HbA1c 28 mmol/mol, celkový cholesterol 4,8 mmol/l, HDL‑C 1,4 mmol/l, LDL‑C 2,5 mmol/l, triglyceridy 1,8 mmol/l, CRP 1 mg/l (před léčbou byl celkový cholesterol 6,8 mmol/l, HDL‑C 1,4 a LDL‑C 4,4 mmol/l, triglyceridy 2,1 mmol/l). Navzdory nijak dramatickým výsledkům musela žena už v relativně mladém věku podstoupit revaskularizaci, varující byla i její rodinná anamnéza: otec měl infarkt myokardu v 59 letech a bratr podstoupil revaskularizaci na prahu šedesátky. Bylo zřejmé, že se někde ukrývá ještě jiná příčina akcelerovaného aterosklerotického procesu, proto byly pacientce změřeny koncentrace Lp(a), které se ukázaly být extrémně zvýšené (355 nmol/l [145 mg/dl], přičemž dle stanoviska EAS z roku 2010 byla pro zpřesnění odhadu desetiletého rizika ASKVO stanovena hraniční hodnota Lp(a) 50 mg/dl [125 nmol/l]).
„U pacientky bylo na začátku stanoveno celoživotní kardiovaskulární riziko ve výši 14 procent, pokud ale vezmeme v úvahu koncentrace Lp(a), její riziko vrostlo na 40 procent,“ upozornila dr. Ceglová a dodala, že u nemocné tak došlo k promeškání příležitosti nasadit agresivnější farmakoterapii. Její celkové riziko totiž může klesnout až o polovinu, pokud je snížen LDL‑C aspoň o 1,2 mmol/l a krevní tlak o 10 mm Hg. Při odhadu rizika pacienta je důležité vědět, že koncentrace Lp(a) 100 mg/dl (~ 250 nmol/l) přibližně zdvojnásobuje riziko ASKVO bez ohledu na základní absolutní riziko. U jedinců s vyšším počátečním rizikem je absolutní navýšení rizika ASKVO vyšší (např. z 20 na 40 procent) než u jedinců s nižším počátečním rizikem (z 5 na 10 procent).
Komu a kdy měřit Lp(a)?
Jak už bylo uvedeno, podle doporučení ESC pro management Lp(a) (Kronenberg et al., EHJ 2022) by koncentrace Lp(a) měla být u dospělých vyšetřena alespoň jednou, ideálně při stanovení prvního lipidového profilu, s cílem identifikovat jedince s vysokým KV rizikem. Kromě několika výjimek opakované měření nevede k vylepšení predikce rizika. „V důsledku toho, že hodnoty Lp(a) jsou dány geneticky, vysoké hodnoty zůstanou vysoké a nízké zase nízké. Máme ale jakési střední pásmo pacientů, kde pozorujeme biologickou variabilitu v rozmezí 10 až 20 procent. U nich bychom měli Lp(a) opakovaně vyšetřovat, abychom prověřili efektivitu hypolipidemických strategií,“ doplnila dr. Ceglová. U dospívajících se měření Lp(a) doporučuje při ischemické mozkové příhodě v anamnéze nebo jestliže rodič má předčasné ASKVO bez jiného identifikovatelného rizikového faktoru. Opakování vyšetření je zde vhodné, protože hodnoty se mohou do dosažení dospělosti zvyšovat. Protože vysoký Lp(a) se dědí v rodinách, je vyšetření u rodičů a sourozenců pacienta oprávněné, lze volit proces kaskádového screeningu, známý a osvědčený z testování FH v rodinách.
Současné možnosti intervence
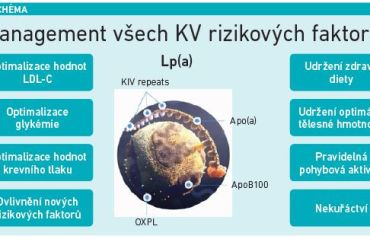
Zatím není k dispozici žádná schválená léčba snižující specificky Lp(a), proto se doporučuje u jedinců se zvýšenou koncentrací Lp(a) časná a intenzivní léčba ostatních rizikových faktorů, tedy redukce LDL‑C, krevního tlaku a glykémie, a úprava životního stylu (viz schéma). Pokud jde o již etablovaná hypolipidemika, statiny hodnoty Lp(a) prakticky neovlivňují, stejně jako ezetimib a fibráty. Asi nejlepší výsledky mají inhibitory PCSK9, které Lp(a) redukují až o 26 procent (a platí, že v čím vyšším percentilu se pacient nachází, tím větší redukce hodnot nastává), nebo inklisiran, který snižuje Lp(a) o zhruba 18 procent. Inhibitory PCSK9 však nejsou registrovány pro snižování Lp(a), profitovat z tohoto jejich efektu tedy mohou např. pacienti, kteří mají FH a zároveň i zvýšený Lp(a) – zvýšený Lp(a) má 30 až 35 procent pacientů s FH. Největšího efektu je dosaženo pomocí LDL aferézy, bezprostředně po ní klesají hodnoty Lp(a) až o 80 procent a dlouhodobě pak asi o 35 procent.
Novou lékovou skupinou na poli terapie vysokých hodnot Lp(a) je tzv. anti‑sense terapie (ASO – antisense oligonucletides), která způsobuje degradaci mRNA pomocí RNázy. V klinických studiích úspěšně postupuje kupředu pelacarsen, který snižuje hodnoty Lp(a) o 70–90 procent a je vyvíjen tak, aby mohl být aplikován (subkutánně) jen jednou měsíčně v dávce 80 mg. Další nadějnou skupinou jsou siRNA (malé interferující RNA), jejichž zástupcem je olpasiran, nacházející se právě ve třetí fázi klinických studií. I on vede, při dobré snášenlivosti, k snížení hodnot Lp(a) až o 90 procent a zdá se, že efekt přetrvává tři až šest měsíců od podání dávky. U obou nových léčebných modalit je důležité, že jsou bezpečné a downregulace exprese genu je dočasná a reverzibilní. O kolik je nutné Lp(a) snížit, aby se projevil příznivý efekt, není zatím jasné, ukazuje se však, že je potřeba dosáhnout velkého absolutního snížení koncentrace Lp(a), a to > 50–100 mg/dl. Neví se však s jistotou, o kolik je nutné snížit hodnotu Lp(a), aby se přínos klinicky projevil.